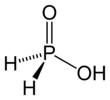
हाइपोफॉस्फोरस एसिड
|
| |||
| Names | |||
|---|---|---|---|
| IUPAC name
Phosphinic acid
| |||
| Other names
Hydroxy(oxo)-λ5-phosphane
Hydroxy-λ5-phosphanone | |||
| Identifiers | |||
3D model (JSmol)
|
|||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| KEGG | |||
PubChem CID
|
| ||
| UNII | |||
| UN number | UN 3264 | ||
| |||
| |||
| Properties | |||
| H3PO2 | |||
| Molar mass | 66.00 g/mol | ||
| Appearance | colorless, deliquescent crystals or oily liquid | ||
| Density | 1.493 g/cm3[2]
1.22 g/cm3 (50 wt% aq. solution) | ||
| Melting point | 26.5 °C (79.7 °F; 299.6 K) | ||
| Boiling point | 130 °C (266 °F; 403 K) decomposes | ||
| miscible | |||
| Solubility | very soluble in alcohol, ether | ||
| Acidity (pKa) | 1.2 | ||
| Conjugate base | Phosphinate | ||
| Structure | |||
| pseudo-tetrahedral | |||
| Hazards | |||
| Flash point | Non-flammable | ||
| Safety data sheet (SDS) | JT Baker | ||
| Related compounds | |||
Related phosphorus oxoacids
|
Phosphorous acid Phosphoric acid | ||
Related compounds
|
Sodium hypophosphite Barium hypophosphite | ||
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
| |||
हाइपोफॉस्फोरस एसिड (एचपीए), या फॉस्फिनिक एसिड, एक फास्फोरस ऑक्सीसिड और आणविक सूत्र H3PO2 के साथ एक शक्तिशाली कम करने वाला एजेंट है। यह एक रंगहीन कम पिघलने वाला यौगिक है, जो पानी, डाइऑक्सिन और ऐल्कोहॉल में घुलनशील है। इस अम्ल का सूत्र सामान्यतः H3PO2 लिखा जाता है, लेकिन एक अधिक वर्णनात्मक प्रस्तुति HOP(O)H2 है, जो इसके मोनोप्रोटिक एसिड चरित्र को उजागर करता है। इस अम्ल से प्राप्त लवणों को उपभास्वित कहा जाता हैl [3] HOP(O)H2 मामूली टॉटोमर HP(OH)2 के साथ रासायनिक संतुलन में उपलब्ध हैl कभी-कभी मामूली टॉटोमर को हाइपोफॉस्फोरस एसिड कहा जाता है और प्रमुख टॉटोमर को फॉस्फिनिक एसिड कहा जाता है।
तैयारी और उपलब्धता
हाइपोफॉस्फोरस एसिड पहली बार 1816 में फ्रांसीसी रसायनज्ञ पियरे लुइस डुलोंग (1785-1838) द्वारा तैयार किया गया था।[4]
एसिड को औद्योगिक रूप से दो चरणों की प्रक्रिया के माध्यम से तैयार किया जाता है: सबसे पहले, प्राथमिक सफेद फास्फोरस, क्षार धातु और क्षारीय पृथ्वी हीड्राकसीड ्स के साथ हाइपोफॉस्फाइट्स का एक जलीय घोल देने के लिए प्रतिक्रिया करता है:
- P4 + 4 OH− + 4 H2O → 4 H2PO−2 + 2 H2
इस चरण में उत्पादित किसी भी फॉस्फेट को कैल्शियम लवण के साथ इलाज के द्वारा चुनिंदा रूप से अवक्षेपित किया जा सकता है। शुद्ध सामग्री को तब सशक्त हाइपोफॉस्फोरस एसिड देने के लिए प्रबल, गैर-ऑक्सीडाइजिंग एसिड (प्रायः सल्फ्यूरिक एसिड) के साथ इलाज किया जाता है:
- H
2PO−
2 + एच+ → एच3बाद2
HPA सामान्यतः 50% जलीय घोल के रूप में आपूर्ति की जाती है। पानी के साधारण वाष्पीकरण द्वारा निर्जल अम्ल प्राप्त नहीं किया जा सकता है, क्योंकि अम्ल आसानी से फास्फोरस एसिड और फॉस्फोरिक एसिड में ऑक्सीकृत हो जाता है और फॉस्फोरस एसिड और फॉस्फीन से भी अनुपातहीन हो जाता है। दिएथील ईथर के साथ जलीय घोल के निरंतर निष्कर्षण से शुद्ध निर्जल हाइपोफॉस्फोरस एसिड का निर्माण किया जा सकता है।[5]
गुण
- अणु फॉस्फोरस एसिड के समान P(═O)H से P-OH टॉटोमेरिज़्म प्रदर्शित करता है; P(═O) फॉर्म का प्रबल समर्थन किया जाता है।[6]
HPA को सामान्यतः 50% जलीय घोल के रूप में आपूर्ति की जाती है और कम तापमान (लगभग 90 ° C तक) पर गर्म करने से यह फॉस्फोरस एसिड और हाइड्रोजन गैस बनाने के लिए पानी के साथ प्रतिक्रिया करता है।
- H3PO2 + H2O → H3PO3 + H2
110°C से ऊपर गर्म करने पर हाइपोफॉस्फोरस एसिड का अनुपातहीन हो जाता है जिससे फॉस्फोरस एसिड और फॉस्फीन बनता है।[7]
- 3 H3PO2 → 2 H3PO3 + PH3
प्रतिक्रियाएं
अकार्बनिक
हाइपोफॉस्फोरस एसिड क्रोमियम (III) ऑक्साइड को क्रोमियम (II) ऑक्साइड में कम कर सकता है:
- H3PO2 + 2 Cr2O3 → 4 CrO + H3PO4
अकार्बनिक डेरिवेटिव
अधिकांश धातु-हाइपोफॉस्फाइट कॉम्प्लेक्स अस्थिर होते हैं, हाइपोफॉस्फाइट्स की प्रवृत्ति के कारण धातु के कैटायन को थोक धातु में वापस लाने के लिए। कुछ उदाहरणों की विशेषता बताई गई है,[8][9] महत्वपूर्ण निकल लवण सहित [Ni(H2O)6](H2PO2)2.[10]
डीईए सूची I रासायनिक स्थिति
क्योंकि हाइपोफॉस्फोरस एसिड प्राथमिक आयोडीन को हाइड्रोआयोडिक एसिड बनाने के लिए कम कर सकता है, जो एफिड्राइन या स्यूडोएफेड्राइन को मेथम्फेटामाइन को कम करने के लिए एक प्रभावी अभिकर्मक है,[11] औषधि आचरण प्रशासन ने 16 नवंबर, 2001 से प्रभावी रसायनों की डीईए सूची के रूप में हाइपोफॉस्फोरस एसिड (और इसके लवण) को नामित किया।[12] तदनुसार, संयुक्त राज्य अमेरिका में हाइपोफॉस्फोरस एसिड या इसके लवणों के संचालक कड़े नियामक नियंत्रणों के अधीन हैं, जिनमें नियंत्रित पदार्थ अधिनियम और 21 (सीएफआर) संघीय विनियम संहिता §§ 1309 और 1310 के अनुसार पंजीकरण, रिकॉर्डकीपिंग, रिपोर्टिंग और आयात/निर्यात आवश्यकताएं सम्मिलित हैं।[12][13][14]
कार्बनिक
कार्बनिक रसायन विज्ञान में H3PO2 डायज़ोनियम लवण या (एरेनेडायज़ोनियम लवण) की कमी, परिवर्तित करने के लिए उपयोग किया जा सकता है ArN+
2rN+2 से Ar–H।[15][16][17] जब हाइपोफॉस्फोरस एसिड के एक केंद्रित समाधान में डायज़ोटाइज़ेशन होता है, तो एक अमीन पदार्थ को एरेन्स से हटाया जा सकता है।
हल्के कम करने वाले एजेंट और ऑक्सीजन अपमार्जक के रूप में कार्य करने की इसकी क्षमता के कारण इसे कभी-कभी फिशर एस्टरीफिकेशन प्रतिक्रियाओं में एक योज्य के रूप में प्रयोग किया जाता है, जहां यह रंगीन अशुद्धियों के गठन को रोकता है।
इसका उपयोग फॉस्फिनिक एसिड डेरिवेटिव तैयार करने के लिए किया जाता है।[18]
अनुप्रयोग
हाइपोफॉस्फोरस अम्ल (और इसके लवण) का उपयोग धातु के लवणों को बल्क धातुओं में वापस लाने के लिए किया जाता है। यह विभिन्न संक्रमण धातुओं के आयनों (अर्थात: Co, Cu, Ag, Mn, Pt) के लिए प्रभावी है, लेकिन निकल को कम करने के लिए सबसे अधिक उपयोग किया जाता है।[19] यह इलेक्ट्रोलस निकल चढ़ाना (Ni–P) का आधार बनाता है, जो हाइपोफॉस्फाइट्स का सबसे बड़ा औद्योगिक अनुप्रयोग है। इस एप्लिकेशन के लिए इसे मुख्य रूप से लवण (सोडियम हाइपोफॉस्फाइट) के रूप में उपयोग किया जाता है।[20]
स्रोत
- Cotton, F. Albert; Wilkinson, Geoffrey; Murillo, Carlos A.; Bochmann, Manfred (1999), Advanced Inorganic Chemistry (6th ed.), New York: Wiley-Interscience, ISBN 0-471-19957-5
- ChemicalLand21 लिस्टिंग
- Corbridge, D. E. C. (1995). फास्फोरस: इसकी रसायन विज्ञान, जैव रसायन और प्रौद्योगिकी की एक रूपरेखा (5th ed.). Amsterdam: Elsevier. ISBN 0-444-89307-5.
- Popik, V. V.; Wright, A. G.; Khan, T. A.; Murphy, J. A. (2004). "Hypophosphorous Acid". In Paquette, L. (ed.). कार्बनिक संश्लेषण के लिए अभिकर्मकों का विश्वकोश. New York: J. Wiley & Sons. doi:10.1002/047084289X. hdl:10261/236866. ISBN 9780471936237.
- Rich, D. W.; Smith, M. C. (1971). निकेल, कोबाल्ट और आयरन का इलेक्ट्रोलेस डिपोजिशन. Poughkeepsie, NY: IBM Corporation.
संदर्भ
- ↑ Petrucci, Ralph H. (2007). General Chemistry (9th ed.). p. 946.
- ↑ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8
- ↑ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ↑ Dulong prepared acide hypo-phosphoreux by adding barium phosphide (Ba3P2) to water, which yielded phosphine gas (PH3), barium phosphate, and barium hypophosphite. Since the phosphine gas left the solution and the barium phosphate precipitated, only the barium hypophosphite remained in solution. Hypophosphorous acid could then be obtained from the filtrate by adding sulfuric acid, which precipitated barium sulfate, leaving hypophosphorous acid in solution. See:
- Dulong (1816) "Extrait d'un mémoire sur les combinaisons du phosphore avec l'oxigène" (Extract from a memoir on the compounds of phosphorus with oxygen), Annales de Chimie et de Physique, 2 : 141–150. [in French]
- Graham, Thomas, Elements of Inorganic Chemistry, 2nd ed. (Philadelphia, Pennsylvania: Blanchard and Lea, 1858), p. 316.
- ↑ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. p. 513. ISBN 978-0-08-037941-8.
- ↑ Janesko, Benjamin G.; Fisher, Henry C.; Bridle, Mark J.; Montchamp, Jean-Luc (2015-09-29). "P(═O)H to P–OH Tautomerism: A Theoretical and Experimental Study". The Journal of Organic Chemistry. American Chemical Society (ACS). 80 (20): 10025–10032. doi:10.1021/acs.joc.5b01618. ISSN 0022-3263.
- ↑ Shechkov, G. T.; Pevneva, I. A.; Meshkova, O. A. (August 2003). "हाइपोफॉस्फोरस एसिड का थर्मल अनुपातहीनता". Russian Journal of Applied Chemistry. 76 (8): 1354–1355. doi:10.1023/B:RJAC.0000008318.22178.07. S2CID 96861842.
- ↑ Kuratieva, Natalia V.; Naumova, Marina I.; Podberezskaya, Nina V.; Naumov, Dmitry Yu. (2005-02-15). "The bivalent metal hypophosphites Sr(H 2 PO 2 ) 2 , Pb(H 2 PO 2 ) 2 and Ba(H 2 PO 2 ) 2". Acta Crystallographica Section C Crystal Structure Communications. 61 (2): i14–i16. doi:10.1107/S010827010403166X. PMID 15695880.
- ↑ Naumova, Marina I.; Kuratieva, Natalia V.; Podberezskaya, Nina V.; Naumov, Dmitry Yu. (2004-05-15). "The alkali hypophosphites KH 2 PO 2 , RbH 2 PO 2 and CsH 2 PO 2". Acta Crystallographica Section C Crystal Structure Communications. 60 (5): i53–i55. doi:10.1107/S0108270104002409. PMID 15131359.
- ↑ Kuratieva, Natalia V.; Naumova, Marina I.; Naumov, Dmitry Yu.; Podberezskaya, Nina V. (2003-01-15). "हेक्साक्वानिकेल (II) बीआईएस (हाइपोफॉस्फाइट)". Acta Crystallographica Section C Crystal Structure Communications. 59 (1): i1–i3. doi:10.1107/S0108270102018541. PMID 12506208.
- ↑ Gordon, P. E.; Fry, A. J.; Hicks, L. D. (23 August 2005). "Further studies on the reduction of benzylic alcohols by hypophosphorous acid/iodine" (PDF). Arkivoc. 2005 (vi): 393–400. ISSN 1424-6376.
- ↑ 12.0 12.1 66 FR 52670—52675. 17 October 2001.
- ↑ "21 CFR 1309". Archived from the original on 2009-05-03. Retrieved 2007-05-02.
- ↑ 21 USC, Chapter 13 (Controlled Substances Act)
- ↑ William H. Brown; Brent L. Iverson; Eric Anslyn; Christopher S. Foote (2013). कार्बनिक रसायन विज्ञान. Cengage Learning. p. 1003. ISBN 9781133952848.
- ↑ Robison, M. M.; Robison, B. L. "2,4,6-Tribromobenzoic acid". Organic Syntheses. 36: 94.; Collective Volume, vol. 4
- ↑ Kornblum, N. (1941). "3,3′-Dimethoxybiphenyl and 3,3′-Dimethylbiphenyl". Organic Syntheses. 21: 30. doi:10.15227/orgsyn.021.0030.
- ↑ Karla Bravo-Altamirano, Jean-Luc Montchamp (2008). "एलिलिक अल्कोहल के साथ हाइपोफॉस्फोरस एसिड का पैलेडियम-उत्प्रेरित डिहाइड्रेटिव एलिलेशन". Org. Synth. 85: 96. doi:10.15227/orgsyn.085.0096.
{{cite journal}}: CS1 maint: uses authors parameter (link) - ↑ Guyon, Carole; Métay, Estelle; Popowycz, Florence; Lemaire, Marc (2015). "कमी में हाइपोफॉस्फाइट डेरिवेटिव के सिंथेटिक अनुप्रयोग". Organic & Biomolecular Chemistry. 13 (29): 7879–7906. doi:10.1039/C5OB01032B. PMID 26083977.
- ↑ Abrantes, L. M. (1994). "On the Mechanism of Electroless Ni–P Plating". Journal of the Electrochemical Society. 141 (9): 2356–2360. Bibcode:1994JElS..141.2356A. doi:10.1149/1.2055125.