पाई बंध
This article needs additional citations for verification. (February 2013) (Learn how and when to remove this template message) |

रसायन विज्ञान में, पाई बांड (π बांड) सहसंयोजक बंधन रासायनिक रासायनिक बांड हैं, जिनमें से प्रत्येक में एक परमाणु पर एक परमाणु कक्षीय के दो भाग दूसरे परमाणु पर एक कक्षीय के दो पालियों के साथ ओवरलैप होते हैं, और जिसमें यह ओवरलैप बाद में होता है। इनमें से प्रत्येक परमाणु कक्षा में एक साझा नोड (भौतिकी) पर शून्य का इलेक्ट्रॉन घनत्व होता है जो दो बंधुआ परमाणु नाभिक से गुजरता है। यह तल पाई बांड के आणविक कक्षीय के लिए एक नोडल तल भी है। पाई बॉन्ड डबल बंधन और ट्रिपल बंधन में बन सकते हैं लेकिन ज्यादातर मामलों में एकल बंधन में नहीं बनते हैं।
उनके नाम में ग्रीक अक्षर π पी कक्षीय्स को संदर्भित करता है, क्योंकि pi बॉन्ड की कक्षीय समरूपता डी कक्षीय के समान होती है, जब बॉन्ड अक्ष को नीचे देखा जाता है। इस प्रकार के संबंध के एक सामान्य रूप में p ऑर्बिटल्स स्वयं शामिल होते हैं, हालांकि d ऑर्बिटल्स भी pi बॉन्डिंग में संलग्न होते हैं। यह बाद वाला मोड पाँच गुना छलांग | मेटल-मेटल मल्टीपल बॉन्डिंग के लिए आधार का हिस्सा है।
गुण
पाई बॉन्ड आमतौर पर सिग्मा बंधन से कमजोर होते हैं। कार्बन-कार्बन बांड | सीसी डबल बांड, एक सिग्मा और एक पाई बांड से बना है,[1] सी-सी सिंगल बॉन्ड की तुलना में दो बार से कम बंधन ऊर्जा है, यह दर्शाता है कि पीआई बॉन्ड द्वारा जोड़ी गई स्थिरता सिग्मा बॉन्ड की स्थिरता से कम है। क्वांटम यांत्रिकी के परिप्रेक्ष्य से, इस बंधन की कमजोरी को उनके समानांतर अभिविन्यास के कारण घटक पी-ऑर्बिटल्स के बीच काफी कम ओवरलैप द्वारा समझाया गया है। यह सिग्मा बांडों के विपरीत है जो बंधन परमाणुओं के नाभिक के बीच सीधे संबंध कक्ष बनाते हैं, जिसके परिणामस्वरूप अधिक ओवरलैप और एक मजबूत सिग्मा बंधन होता है।
पाई बांड परमाणु ऑर्बिटल्स के ओवरलैप से उत्पन्न होते हैं जो ओवरलैप के दो क्षेत्रों के माध्यम से संपर्क में होते हैं। पाई बांड सिग्मा बांड की तुलना में अधिक विसरित बंधन हैं। पीआई बॉन्ड में इलेक्ट्रॉनों को कभी-कभी पीआई इलेक्ट्रॉनों के रूप में जाना जाता है। पीआई बंधन से जुड़े आणविक टुकड़े उस बंधन के बारे में पीआई बंधन को तोड़ने के बिना घूम नहीं सकते हैं, क्योंकि रोटेशन में घटक पी ऑर्बिटल्स के समांतर अभिविन्यास को नष्ट करना शामिल है।
होमोन्यूक्लियर अणु डायटोमिक अणुओं के लिए, बॉन्डिंग π आणविक ऑर्बिटल्स में केवल एक नोडल प्लेन होता है जो बॉन्डेड परमाणुओं से होकर गुजरता है, और बॉन्डेड परमाणुओं के बीच कोई नोडल प्लेन नहीं होता है। संबंधित एंटीबॉन्ड|एंटीबॉन्डिंग, या π* (पी-स्टार) आणविक कक्षीय, इन दो बंधुआ परमाणुओं के बीच एक अतिरिक्त नोडल विमान की उपस्थिति से परिभाषित किया गया है।
एकाधिक बंधन
एक विशिष्ट दोहरे बंधन में एक सिग्मा बंधन और एक पाई बंधन होता है; उदाहरण के लिए, एथिलीन में सी = सी डबल बॉन्ड (एच2सी = सीएच2). एक विशिष्ट चौगुना बंधन, उदाहरण के लिए एसिटिलीन (HC≡CH) में, एक सिग्मा बॉन्ड और दो पीआई बॉन्ड होते हैं जो बॉन्ड अक्ष वाले दो परस्पर लंबवत विमानों में होते हैं। दो पाई बांड अधिकतम हैं जो परमाणुओं की एक जोड़ी के बीच मौजूद हो सकते हैं। चौगुनी बांड अत्यंत दुर्लभ हैं और केवल संक्रमण धातु परमाणुओं के बीच ही बन सकते हैं, और इसमें एक सिग्मा बांड, दो पाई बांड और एक डेल्टा बंधन शामिल हैं।
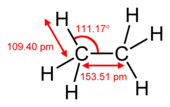
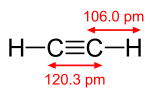
एक पाई बॉन्ड सिग्मा बॉन्ड से कमजोर होता है, लेकिन पाई और सिग्मा बॉन्ड का संयोजन अपने आप में किसी भी बॉन्ड से ज्यादा मजबूत होता है। एकल (सिग्मा बांड) की तुलना में एक बहु बंधन की बढ़ी हुई ताकत कई तरह से इंगित की जाती है, लेकिन सबसे स्पष्ट रूप से बांड की लंबाई में संकुचन से। उदाहरण के लिए, कार्बनिक रसायन विज्ञान में, एटैन में कार्बन-कार्बन बॉन्ड की लंबाई लगभग 154 पीकोमीटर होती है,[2][3] एथिलीन में दोपहर 134 और एसिटिलीन में दोपहर 120 बजे। अधिक बंधन कुल बंधन को छोटा और मजबूत बनाते हैं।
|

|
|
| ethane (1 σ bond) | ethylene (1 σ bond + 1 π bond) | acetylene (1 σ bond + 2 π bonds) |
विशेष मामले
एक पाई बांड दो परमाणुओं के बीच मौजूद हो सकता है जिनके बीच शुद्ध सिग्मा-बॉन्डिंग प्रभाव नहीं होता है।
कुछ धातु संकुलों में, एक धातु परमाणु और alkyne और एल्केन पाई एंटीबॉन्डिंग ऑर्बिटल्स के बीच पाई अन्योन्य क्रियाएं पाई-बॉन्ड बनाती हैं।
दो परमाणुओं के बीच कई बंधनों के कुछ मामलों में, कोई शुद्ध सिग्मा-बॉन्डिंग नहीं है, केवल पाई बांड हैं। उदाहरणों में डाइरॉन हेक्साकारबोनील (Fe2(सीओ)6), डाइकार्बन (सी2), और डिबोराने (2) (बी2H2). इन यौगिकों में केंद्रीय बंधन में केवल सिग्मा बंधन के साथ सिग्मा एंटीबॉडी के कारण केवल पाई बॉन्डिंग होती है। इन यौगिकों का उपयोग पीआई बॉन्डिंग के विश्लेषण के लिए कम्प्यूटेशनल मॉडल के रूप में किया गया है, जिससे पता चलता है कि अधिकतम कक्षीय ओवरलैप प्राप्त करने के लिए बॉन्ड की दूरी अपेक्षा से बहुत कम है।[4]
यह भी देखें
- सुगंधित बातचीत
- डेल्टा बंधन
- आणविक ज्यामिति
- पाई बैकबॉन्डिंग
- पाई इंटरेक्शन
संदर्भ
- ↑ Streitwieser, Andrew; Heathcock, Clayton H.; Kosower, Edward M. (1992). कार्बनिक रसायन का परिचय।. Heathcock, Clayton H., Kosower, Edward M. (4th ed.). New York: Macmillan. pp. 250. ISBN 978-0024181701. OCLC 24501305.
- ↑ Veillard, A. (1970). "आंतरिक रोटेशन इथेन और हाइड्रोजन पेरोक्साइड के दौरान आराम". Theoretica Chimica Acta. 18 (1): 21–33. doi:10.1007/BF00533694. S2CID 94310101.
- ↑ Harmony, Marlin D. (1990). "The equilibrium carbon–carbon single‐bond length in ethane". J. Chem. Phys. 93 (10): 7522–7523. Bibcode:1990JChPh..93.7522H. doi:10.1063/1.459380.
- ↑ Jemmis, Eluvathingal D.; Pathak, Biswarup; King, R. Bruce; Schaefer III, Henry F. (2006). "Bond length and bond multiplicity: σ-bond prevents short π-bonds". Chemical Communications (20): 2164–2166. doi:10.1039/b602116f. PMID 16703142.
