पाई बंध

रसायन विज्ञान में, पाई बंध (π बंध) सहसंयोजक बंधन रासायनिक रासायनिक बंध हैं, जिनमें से प्रत्येक में परमाणु पर एक परमाणु कक्षीय के दो भाग दूसरे परमाणु पर कक्षीय के दो भाग के साथ अतिव्यापन होते हैं, और जिसमें यह अतिव्यापन बाद में होता है। इनमें से प्रत्येक परमाणु कक्षा में साझा नोड (भौतिकी) पर शून्य का इलेक्ट्रॉन घनत्व होता है जो दो आबंधित परमाणु नाभिक से गुजरते है। यह तल पाई बंध के आणविक कक्षीय के लिए नोडल तल भी है। पाई बंध द्विबंधन और त्रिबंधन में बन सकते हैं परन्तु अधिकतर स्थितियों में एकल बंधन में नहीं बनते हैं।
उनके नाम में ग्रीक अक्षर π p कक्षीय को संदर्भित करते है, क्योंकि पाई बंध की कक्षीय समरूपता d कक्षीय के समान होती है, जब बंध अक्ष को नीचे देखा जाता है। इस प्रकार के संबंध के एक सामान्य रूप में p कक्षाओं स्वयं सम्मिलित होते हैं, यद्यपि d कक्षाओं भी पाई आबंधन में संलग्न होते हैं। यह बाद वाला मोड पंचक आबंधन के लिए आधार का भाग है।
गुण
पाई बंध सामान्यतः सिग्मा बंधन से दुर्बल होते हैं। कार्बन-कार्बन बंध, एक सिग्मा और एक पाई बंध से बना है,[1] C-C एकल बंध की तुलना में दो बार से कम बंधन ऊर्जा है, यह दर्शाता है कि पाई बंध द्वारा जोड़ी गई स्थिरता सिग्मा बंध की स्थिरता से कम है। क्वांटम यांत्रिकी के परिप्रेक्ष्य से, इस बंधन की दुर्बलता को उनके समानांतर अभिविन्यास के कारण घटक p-कक्षाओं के बीच अत्यधिक कम अतिव्यापन द्वारा समझाया गया है। यह सिग्मा बंधों के विपरीत है जो बंधन परमाणुओं के नाभिक के बीच सीधे संबंध कक्ष बनाते हैं, जिसके परिणामस्वरूप अधिक अतिव्यापन और दृढ सिग्मा बंधन होता है।
पाई बंध परमाणु कक्षाओं के अतिव्यापन से उत्पन्न होते हैं जो अतिव्यापन के दो क्षेत्रों के माध्यम से संपर्क में होते हैं। पाई बंध सिग्मा बंध की तुलना में अधिक विसरित बंधन हैं। पाई बंध में इलेक्ट्रॉनों को कभी-कभी पाई इलेक्ट्रॉनों के रूप में जाना जाता है। पाई बंधन से जुड़े आणविक टुकड़े उस बंधन के विषय में पाई बंधन को तोड़ने के बिना घूम नहीं सकते हैं, क्योंकि घूर्णन में घटक p कक्षाओं के समांतर अभिविन्यास को नष्ट करना सम्मिलित है।
समानाभिकीय अणु द्विपरमाणुक अणुओं के लिए, आबंधन π आणविक कक्षाओं में मात्र नोडल समतल होता है जो आबंधित परमाणुओं से होकर गुजरते है, और आबंधित परमाणुओं के बीच कोई नोडल समतल नहीं होता है। संबंधित प्रतिबंधन, या π* (पाई -तारक) आणविक कक्षीय, इन दो आबंधित परमाणुओं के बीच अतिरिक्त नोडल समतल की उपस्थिति से परिभाषित किया गया है।
एकाधिक बंधन
विशिष्ट दोहरे बंधन में एक सिग्मा बंधन और एक पाई बंधन होता है; उदाहरण के लिए, एथिलीन में C=C दोहरा बंधन (H2C=CH2)। विशिष्ट त्रिक आबंध, उदाहरण के लिए एसिटिलीन (HC≡CH) में, सिग्मा बंध और दो पाई बंध होते हैं जो बंध अक्ष वाले दो परस्पर लंबवत समतलों में होते हैं। दो पाई बंध अधिकतम हैं जो परमाणुओं के युग्म के बीच स्थित हो सकते हैं। त्रिक बंध अत्यंत दुर्लभ हैं और मात्र संक्रमण धातु परमाणुओं के बीच ही बन सकते हैं, और इसमें एक सिग्मा बंध, दो पाई बंध और एक डेल्टा बंधन सम्मिलित हैं।
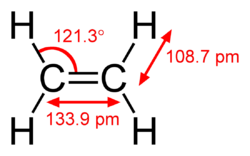
पाई बंध सिग्मा बंध से दुर्बल होता है, परन्तु पाई और सिग्मा बंध का संयोजन अपने आप में किसी भी बंध से अधिक दृढ होता है। एकल (सिग्मा बंध) की तुलना में बहु बंधन की बढ़ी हुई दृढ़ता कई प्रकार से इंगित की जाती है, परन्तु सबसे स्पष्ट रूप से बंध की लंबाई में संकुचन से है। उदाहरण के लिए, कार्बनिक रसायन विज्ञान में, एथेन में कार्बन-कार्बन बंध की लंबाई लगभग 154 पीकोमीटर होती है,[2][3] एथिलीन में 134 पीकोमीटर और एसिटिलीन में 120 पीकोमीटर होती है। अधिक बंधन कुल बंधन को छोटा और दृढ बनाते हैं।
विशेष स्थितियां
एक पाई बंध दो परमाणुओं के बीच स्थित हो सकते है जिनके बीच शुद्ध सिग्मा-आबंधन प्रभाव नहीं होते है।
कुछ धातु संकुलों में, धातु परमाणु और ऐल्काइन और एल्केन पाई प्रतिआबंधन कक्षाओं के बीच पाई अन्योन्य क्रियाएं पाई-बंध बनाती हैं।
दो परमाणुओं के बीच कई बंधनों के कुछ स्थितियों में, कोई शुद्ध सिग्मा-आबंधन नहीं है, मात्र पाई बंध हैं। उदाहरणों में डाइरॉन हेक्साकारबोनील (Fe2(CO)6), डाइकार्बन (C2), और डिबोराने (2) (B2H2) सम्मिलित हैं। इन यौगिकों में केंद्रीय बंधन में मात्र सिग्मा बंधन के साथ सिग्मा प्रतिआबंधन के कारण मात्र पाई आबंधन होती है। इन यौगिकों का उपयोग पाई आबंधन के विश्लेषण के लिए संगणनात्मक मॉडल के रूप में किया गया है, जिससे पता चलता है कि अधिकतम कक्षीय अतिव्यापन प्राप्त करने के लिए बंध की दूरी अपेक्षा से बहुत कम है।[4]
यह भी देखें
संदर्भ
- ↑ Streitwieser, Andrew; Heathcock, Clayton H.; Kosower, Edward M. (1992). कार्बनिक रसायन का परिचय।. Heathcock, Clayton H., Kosower, Edward M. (4th ed.). New York: Macmillan. pp. 250. ISBN 978-0024181701. OCLC 24501305.
- ↑ Veillard, A. (1970). "आंतरिक रोटेशन इथेन और हाइड्रोजन पेरोक्साइड के दौरान आराम". Theoretica Chimica Acta. 18 (1): 21–33. doi:10.1007/BF00533694. S2CID 94310101.
- ↑ Harmony, Marlin D. (1990). "The equilibrium carbon–carbon single‐bond length in ethane". J. Chem. Phys. 93 (10): 7522–7523. Bibcode:1990JChPh..93.7522H. doi:10.1063/1.459380.
- ↑ Jemmis, Eluvathingal D.; Pathak, Biswarup; King, R. Bruce; Schaefer III, Henry F. (2006). "Bond length and bond multiplicity: σ-bond prevents short π-bonds". Chemical Communications (20): 2164–2166. doi:10.1039/b602116f. PMID 16703142.