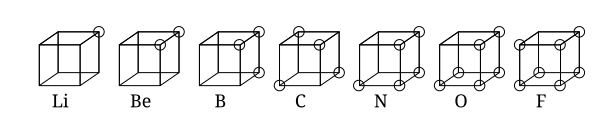
घनाकार परमाणु
क्यूबिकल परमाणु एक प्रारंभिक परमाणु मॉडल था जिसमें एक गैर-ध्रुवीय परमाणु या अणु में घन के आठ कोनों पर इलेक्ट्रॉनों को रखा गया था। यह सिद्धांत 1902 में गिल्बर्ट एन. लुईस द्वारा विकसित किया गया था और 1916 में लेख द एटम एंड द मॉलिक्यूल में प्रकाशित हुआ था और वैलेंसी (रसायन विज्ञान) की घटना के लिए इस्तेमाल किया गया था।[1] लुईस का सिद्धांत अबेग के नियम पर आधारित था। इसे 1919 में इरविंग लैंगमुइर द्वारा क्यूबिकल ऑक्टेट परमाणु के रूप में विकसित किया गया था।[2] नीचे दिया गया आंकड़ा आवर्त सारणी की दूसरी पंक्ति के तत्वों के लिए संरचनात्मक निरूपण दिखाता है।
यद्यपि श्रोडिंगर समीकरण के आधार पर क्वांटम यांत्रिक मॉडल के पक्ष में परमाणु के क्यूबिकल मॉडल को जल्द ही छोड़ दिया गया था, और इसलिए अब मुख्य रूप से ऐतिहासिक रुचि है, यह रासायनिक बंधन की समझ की दिशा में एक महत्वपूर्ण कदम का प्रतिनिधित्व करता है। लुईस के 1916 के लेख ने सहसंयोजक बंधन, ऑक्टेट नियम और अब तथाकथित लुईस संरचना में इलेक्ट्रॉन जोड़ी की अवधारणा को भी पेश किया।
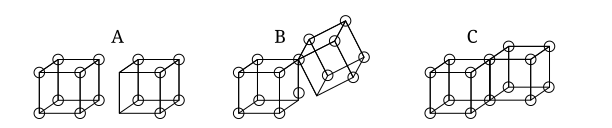
क्यूबिकल एटम मॉडल में बॉन्डिंग
एकल सहसंयोजक बंधन तब बनते हैं जब दो परमाणु किनारे साझा करते हैं, जैसा कि नीचे संरचना सी में है। इसके परिणामस्वरूप दो इलेक्ट्रॉनों की साझेदारी होती है। आयनिक बंधन एक किनारे (संरचना ए) को साझा किए बिना एक घन से दूसरे घन में एक इलेक्ट्रॉन के स्थानांतरण से बनते हैं। एक मध्यवर्ती राज्य जहां केवल एक कोने को साझा किया जाता है (संरचना बी) भी लुईस द्वारा पोस्ट किया गया था।
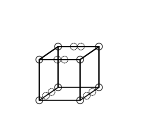
 दो घन परमाणुओं के बीच एक चेहरा साझा करके दोहरे बंधन बनते हैं। इसका परिणाम चार इलेक्ट्रॉनों को साझा करने में होता है:
दो घन परमाणुओं के बीच एक चेहरा साझा करके दोहरे बंधन बनते हैं। इसका परिणाम चार इलेक्ट्रॉनों को साझा करने में होता है:
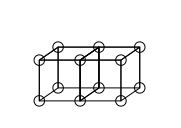 क्यूबिकल परमाणु मॉडल द्वारा ट्रिपल बॉन्ड का हिसाब नहीं लगाया जा सकता है, क्योंकि दो क्यूब्स के तीन समानांतर किनारों को साझा करने का कोई तरीका नहीं है। लुईस ने सुझाव दिया कि परमाणु बंधनों में इलेक्ट्रॉन जोड़े का एक विशेष आकर्षण होता है, जिसके परिणामस्वरूप टेट्राहेड्रल संरचना होती है, जैसा कि नीचे की आकृति में है (इलेक्ट्रॉनों का नया स्थान मोटे किनारों के बीच में बिंदीदार हलकों द्वारा दर्शाया गया है)। यह एक कोने को साझा करके एक एकल बंधन, एक किनारे को साझा करके एक दोहरा बंधन और एक चेहरा साझा करके एक ट्रिपल बंधन बनाने की अनुमति देता है। यह एकल बंधों के चारों ओर मुक्त घूर्णन और मीथेन की चतुष्फलकीय ज्यामिति के लिए भी जिम्मेदार है।
क्यूबिकल परमाणु मॉडल द्वारा ट्रिपल बॉन्ड का हिसाब नहीं लगाया जा सकता है, क्योंकि दो क्यूब्स के तीन समानांतर किनारों को साझा करने का कोई तरीका नहीं है। लुईस ने सुझाव दिया कि परमाणु बंधनों में इलेक्ट्रॉन जोड़े का एक विशेष आकर्षण होता है, जिसके परिणामस्वरूप टेट्राहेड्रल संरचना होती है, जैसा कि नीचे की आकृति में है (इलेक्ट्रॉनों का नया स्थान मोटे किनारों के बीच में बिंदीदार हलकों द्वारा दर्शाया गया है)। यह एक कोने को साझा करके एक एकल बंधन, एक किनारे को साझा करके एक दोहरा बंधन और एक चेहरा साझा करके एक ट्रिपल बंधन बनाने की अनुमति देता है। यह एकल बंधों के चारों ओर मुक्त घूर्णन और मीथेन की चतुष्फलकीय ज्यामिति के लिए भी जिम्मेदार है।
यह भी देखें
संदर्भ
- ↑ Lewis, Gilbert N. (1916-04-01). "The Atom and the Molecule". Journal of the American Chemical Society. 38 (4): 762–785. doi:10.1021/ja02261a002. S2CID 95865413.
- ↑ Langmuir, Irving (1919-06-01). "The Arrangement of Electrons in Atoms and Molecules". Journal of the American Chemical Society. 41 (6): 868–934. doi:10.1021/ja02227a002.