कार्नो चक्र
| थर्मोडायनामिक्स |
|---|
 |
कार्नोट चक्र 1824 में फ्रांसीसी भौतिक विज्ञानी निकोलस लियोनार्ड सादी कार्नोट द्वारा प्रस्तावित एक आदर्श ऊष्मागतिकी चक्र है और 1830 और 1840 के दशक में दूसरों द्वारा विस्तारित किया गया। कार्नोट के सिद्धांत के अनुसार, यह किसी भी पारम्परिक ऊष्मागतिकी इंजन की प्रदर्शकता के ऊपरी सीमा प्रदान करता है जब वह ऊष्मा को कार्य में परिवर्तित करता है, या उल्टा, एक प्रशीतन प्रणाली की प्रदर्शकता को जब वह कार्य को प्रणाली पर लागू करके तापमान मे अंतर करता है।
कार्नोट चक्र में,एक प्रणाली या इंजन एक ऊष्मीय भंडारण और एक शीतल भंडारण के मध्य ऊष्मा के रूप में ऊर्जा स्थानांतरित करती है, जिसे गर्म और शीत भंडारण के रूप में कहा जाता है, और इस स्थानांतरित ऊर्जा का एक भाग प्रणाली द्वारा किये गए कार्य में परिवर्तित होता है। यह चक्र परिवर्तनीय होता है, और भेदक उत्पन्न नहीं होता है। दूसरे शब्दों में, भेदक संरक्षित होता है; भेदक केवल ऊष्मा भंडारणों और प्रणाली के मध्य स्थानांतरित होता है और उसमें बढ़ोतरी या हानि नहीं होती है। जब प्रणाली पर कार्य लागू किया जाती है, तो ऊष्मा शीतल भंडारण से गर्म भंडारण में स्थानांतरित होती है, जिससे प्रणाली पर्यावरण पर काम करती है। प्रति कार्नोट चक्र में पर्यावरण के द्वारा किया गया कार्य प्राथमिकता रखता है, जो ऊष्मा भंडारणों के तापमानों और गर्म भंडारण से प्रणाली में स्थानांतरित भेदक के अनुसार होता है,जहां
, है जहां प्रति कार्नोट चक्र गर्म भंडारण से प्रणाली में स्थानांतरित ऊष्मा है।
| External video | |
|---|---|
चरण
एक ऊष्मा इंजन (कार्नोट ऊष्मा इंजन) द्वारा निष्पादित एक आदर्श ऊष्मागतिकी चक्र के रूप में एक कार्नोट चक्र में निम्नलिखित चरण होते हैं।
-
Isothermal expansion. Heat (as an energy) is transferred reversibly from hot temperature reservoir at constant temperature TH to the gas at temperature infinitesimally less than TH (to allow heat transfer to the gas without practically changing the gas temperature so isothermal heat addition or absorption). During this step (1 to 2 on Figure 1, A to B in Figure 2), the gas is thermally in contact with the hot temperature reservoir (while thermally isolated from the cold temperature reservoir) and the gas is allowed to expand, doing work on the surroundings by gas pushing up the piston (stage 1 figure, right). Although the pressure drops from points 1 to 2 (figure 1) the temperature of the gas does not change during the process because the heat transferred from the hot temperature reservoir to the gas is exactly used to do work on the surroundings by the gas, so no gas internal energy changes (no gas temperature change for an ideal gas). Heat QH > 0 is absorbed from the hot temperature reservoir, resulting in an increase in the entropy of the gas by the amount .
-
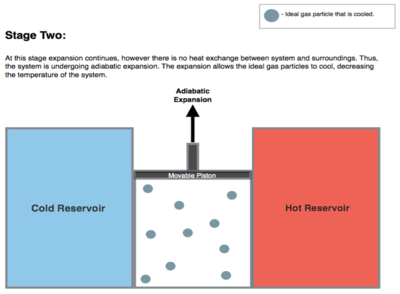
Isentropic (reversible adiabatic) expansion of the gas (isentropic work output). For this step (2 to 3 on Figure 1, B to C in Figure 2) the gas in the engine is thermally insulated from both the hot and cold reservoirs, thus they neither gain nor lose heat, an 'adiabatic' process. The gas continues to expand with reduction of its pressure, doing work on the surroundings (raising the piston; stage 2 figure, right), and losing an amount of internal energy equal to the work done. The gas expansion without heat input causes the gas to cool to the "cold" temperature (by losing its internal energy), that is infinitesimally higher than the cold reservoir temperature TC. The entropy remains unchanged as no heat Q transfers (Q = 0) between the system (the gas) and its surroundings, so an isentropic process, meaning no entropy change in the process).
-
Isothermal compression. Heat transferred reversibly to low temperature reservoir at constant temperature TC (isothermal heat rejection). In this step (3 to 4 on Figure 1, C to D on Figure 2), the gas in the engine is in thermal contact with the cold reservoir at temperature TC (while thermally isolated from the hot temperature reservoir) and the gas temperature is infinitesimally higher than this temperature (to allow heat transfer from the gas to the cold reservoir without practically changing the gas temperature). The surroundings do work on the gas, pushing the piston down (stage 3 figure, right). An amount of energy earned by the gas from this work exactly transfers as a heat energy QC < 0 (negative as leaving from the system, according to the universal convention in thermodynamics) to the cold reservoir so the entropy of the system decreases by the amount .[1] because the isothermal compression decreases the multiplicity of the gas.
-
Isentropic compression. (4 to 1 on Figure 1, D to A on Figure 2) Once again the gas in the engine is thermally insulated from the hot and cold reservoirs, and the engine is assumed to be frictionless and the process is slow enough, hence reversible. During this step, the surroundings do work on the gas, pushing the piston down further (stage 4 figure, right), increasing its internal energy, compressing it, and causing its temperature to rise back to the temperature infinitesimally less than TH due solely to the work added to the system, but the entropy remains unchanged. At this point the gas is in the same state as at the start of step 1.
इस मामले में, चूंकि यह एक प्रतिवर्ती प्रक्रिया (ऊष्मागतिकी्स) ऊष्मागतिकी चक्र है (प्रणाली में कोई शुद्ध परिवर्तन नहीं है और प्रति चक्र इसके आसपास है)[2][1]
दबाव-आयतन आरेख
जब एक कार्नोट चक्र को दबाव-आयतन आरेख पर प्लॉट किया जाता है (Figure 1), इज़ोटेर्मल चरण कार्यशील तरल पदार्थ के लिए इज़ोटेर्म लाइनों का अनुसरण करते हैं, एडियाबेटिक चरण इज़ोटेर्म के मध्य चलते हैं, और पूर्ण चक्र पथ से घिरा क्षेत्र कुल कार्य का प्रतिनिधित्व करता है जो एक चक्र के समय किया जा सकता है। बिंदु 1 से 2 और बिंदु 3 से 4 तक तापमान स्थिर (इज़ोटेर्मल प्रक्रिया) है। बिंदु 4 से 1 और बिंदु 2 से 3 तक ऊष्मा का स्थानांतरण शून्य (एडियाबेटिक प्रक्रिया) के बराबर है।
गुण और महत्व
तापमान-एन्ट्रॉपी आरेख


क्यू C (ठंडे भंडार में खोई हुई ऊर्जा) को प्रत्यक्ष घटाव के रूप में देखा जा सकता है, या एक नकारात्मक मात्रा के योग के रूप में व्यक्त किया जा सकता है, जिससे विभिन्न सम्मेलन हो सकते हैं।
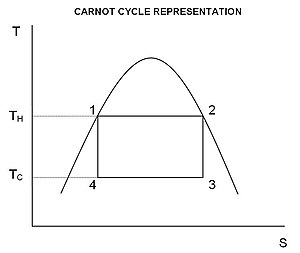
कार्नोट इंजन या प्रशीतक के व्यवहार को तापमान-एन्ट्रॉपी आरेख (टी-एस आरेख) का उपयोग करके सबसे अच्छी तरह से समझा जाता है, जिसमें ऊष्मागतिकी स्थिति को क्षैतिज अक्ष और तापमान के रूप में एंट्रॉपी (एस) के साथ आरेख पर एक बिंदु द्वारा निर्दिष्ट किया जाता है ( टी) ऊर्ध्वाधर अक्ष के रूप में ((चित्र 2). एक साधारण बंद प्रणाली के लिए, आरेख पर कोई भी बिंदु प्रणाली की एक विशेष स्थिति का प्रतिनिधित्व करता है। प्रारंभिक अवस्था (A) और अंतिम अवस्था (B) को जोड़ने वाले वक्र द्वारा एक ऊष्मागतिकी प्रक्रिया का प्रतिनिधित्व किया जाता है। वक्र के अंतर्गत क्षेत्र है:
-
(1)
यदि प्रक्रिया प्रणाली को अधिक भेदक की ओर ले जाती है, तो वक्र के नीचे क्षेत्र उस प्रक्रिया में प्रणाली द्वारा शोषित ऊष्मा की मात्रा होती है; अन्यथा, यह प्रक्रिया में से निकाली गई या प्रणाली से बाहर निकलने वाली ऊष्मा की मात्रा होती है। किसी भी चक्रीय प्रक्रिया के लिए, चक्र का एक ऊपरी भाग और एक निचला भाग होता है। टी-एस आरेखणों में एक घड़े की दिशा में चक्रीय प्रक्रिया के लिए, ऊचे भाग के नीचे का क्षेत्र प्रक्रिया के समय प्रणाली द्वारा शोषित ऊर्जा को दर्शाता है, जबकि निचले भाग के नीचे का क्षेत्र प्रक्रिया के समय प्रणाली से हटाई गई ऊर्जा को दर्शाता है। चक्र के अंदर का क्षेत्र तब दोनों के मध्य का अंतर है, चूंकि प्रणाली की आंतरिक ऊर्जा अपने प्रारंभिक मूल्य पर पुनरावर्तित हो जाती है, यह अंतर प्रणाली द्वारा प्रति चक्र किए गए कार्य की मात्रा होती है। प्रतिवर्ती प्रक्रिया के लिए, गणितीय रूप से चित्र 1, का संदर्भ लेते हुए, हम एक चक्रीय प्रक्रिया पर किए गए कार्य की मात्रा को इस प्रकार लिख सकते हैं:
-
(2)
चूँकि डीयू एक सटीक परिशिष्ट है, तो किसी भी बंद लूप पर इसकी समाकलनिका शून्य होती है, और इससे प्राप्त होता है कि टी-एस आरेखण पर लूप के अंदरीकृत क्षेत्र उस प्रणाली द्वारा पर्यावरण पर संपूर्ण कार्य के बराबर होता है, यदि लूप को दक्षिणावर्त दिशा मे पार किया जाता है, तो परिवेश द्वारा प्रणाली पर किए गए कुल कार्य के बराबर है क्योंकि लूप वामावर्त दिशा में घूमता है।
कार्नोट चक्र
उपरोक्त समाकलित का मूल्यांकन कार्नोट चक्र के लिए विशेष रूप से सरल है। कार्य के रूप में स्थानांतरित ऊर्जा की मात्रा है
-
(3)
जहाँ पे
- W प्रणाली द्वारा किया गया कार्य है
- <0 प्रणाली से ली गई ऊष्मा है ऊष्मा ऊर्जा प्रणाली को छोड़ती है,
- > 0 प्रणाली में डाली गई गर्मी है (प्रणाली में प्रवेश करने वाली ऊष्मा ऊर्जा),
- ठंडे जलाशय का पूर्ण तापमान है, और
- गर्म जलाशय का पूर्ण तापमान है।
- अधिकतम प्रणाली एन्ट्रापी है
- न्यूनतम प्रणाली एन्ट्रापी है
ऊपर दिए गए भेदकता संबंधित निरूपण से इस रूप में एक अभिव्यक्ति प्राप्त की जा सकती है: हॉट भंडारण का तापमान है :
और . तब से , के लिए .अंतिम अभिव्यक्ति में एक ऋण चिह्न प्रकट होता है .
यह कार्नोट ऊष्मा इंजन की कार्य क्षमता की परिभाषा है जिसमें प्रणाली द्वारा किया गया कार्य प्रति चक्र में गर्म भंडारण से प्राप्त ऊष्मिक ऊर्जा के अनुपात के रूप में प्रकट होती है। यह ऊष्मिक ऊर्जा प्रणाली का चक्र प्रारंभ करने वाली ऊर्जा होती है
विपरीत कार्नोट चक्र
वर्णित एक कार्नोट ऊष्मा-इंजन चक्र एक पूरी तरह से प्रतिवर्ती चक्र है। अर्थात्, इसे बनाने वाली सभी प्रक्रियाओं को उलटा किया जा सकता है, जिस स्थिति में यह कार्नोट ऊष्मा पम्प और प्रशीतन चक्र बन जाता है। इस बार, चक्र ठीक वैसा ही रहता है, सिवाय इसके कि किसी भी गर्मी और कार्य की बातचीत की दिशा उलट जाती है। गर्मी को कम तापमान वाले जलाशय से अवशोषित किया जाता है, गर्मी को उच्च तापमान वाले जलाशय से खारिज कर दिया जाता है, और यह सब पूरा करने के लिए एक कार्य इनपुट की आवश्यकता होती है। उत्क्रमित कार्नोट चक्र का पी-वी आरेख कार्नोट ताप-इंजन चक्र के समान है, सिवाय इसके कि प्रक्रियाओं की दिशा उलट जाती है।[3]
कार्नोट का प्रमेय
उपरोक्त आरेख से यह देखा जा सकता है कि तापमान के मध्य चलने वाले किसी भी चक्र के लिए और , कोई भी कार्नोट चक्र की दक्षता से अधिक नहीं हो सकता।

कार्नोट की प्रमेय इस तथ्य का एक औपचारिक कथन है: दो ताप जलाशयों के मध्य चलने वाला कोई भी इंजन उन्हीं जलाशयों के मध्य चलने वाले कार्नोट इंजन की तुलना में अधिक कुशल नहीं हो सकता है। इस प्रकार, समीकरण 3 इसी तापमान का उपयोग करके किसी भी इंजन के लिए अधिकतम संभव दक्षता देता है। कार्नोट के प्रमेय के परिणाम में कहा गया है कि: समान ताप जलाशयों के मध्य काम करने वाले सभी उत्क्रमणीय इंजन समान रूप से कुशल होते हैं। समीकरण के दाहिने हिस्से को पुनर्व्यवस्थित करने से समीकरण का अधिक आसानी से समझा जाने वाला रूप हो सकता है, अर्थात् ताप इंजन की सैद्धांतिक अधिकतम दक्षता गर्म जलाशय के पूर्ण तापमान से विभाजित गर्म और ठंडे जलाशय के मध्य तापमान में अंतर के बराबर होती है। . इस सूत्र को देखते हुए एक दिलचस्प तथ्य स्पष्ट हो जाता है: ठंडे जलाशय के तापमान को कम करने से ताप इंजन की छत दक्षता पर अधिक प्रभाव पड़ता है, उसी मात्रा में गर्म जलाशय के तापमान को बढ़ाने से। वास्तविक दुनिया में, इसे हासिल करना मुश्किल हो सकता है क्योंकि ठंडा जलाशय अक्सर मौजूदा परिवेश का तापमान होता है।
दूसरे शब्दों में, अधिकतम दक्षता तभी प्राप्त की जाती है जब और केवल अगर एंट्रॉपी प्रति चक्र नहीं बदलती है। प्रति चक्र एक एंट्रॉपी परिवर्तन किया जाता है, उदाहरण के लिए, यदि घर्षण होता है जिससे गर्मी में काम का अपव्यय होता है। उस स्थिति में, चक्र उत्क्रमणीय नहीं होता है और क्लॉसियस प्रमेय एक समानता के बजाय एक असमानता बन जाता है। अन्यथा, चूंकि एंट्रॉपी एक राज्य कार्य है, अतिरिक्त एंट्रॉपी को निपटाने के लिए पर्यावरण में गर्मी की आवश्यक डंपिंग दक्षता में कमी (न्यूनतम) की ओर ले जाती है। तो समीकरण 3 किसी भी प्रतिवर्ती प्रक्रिया (ऊष्मागतिकी्स) ताप इंजन की दक्षता देता है।
मेसोस्कोपिक ताप इंजनों में, थर्मल शोर के कारण सामान्य रूप से संचालन के प्रति चक्र में उतार-चढ़ाव होता है। यदि चक्र अर्ध-स्थैतिक रूप से किया जाता है, तो मेसोस्केल पर भी उतार-चढ़ाव गायब हो जाता है।[4] हालाँकि, यदि कार्य माध्यम के विश्राम समय की तुलना में चक्र तेजी से किया जाता है, तो कार्य में उतार-चढ़ाव अपरिहार्य है। फिर भी, जब काम और गर्मी के उतार-चढ़ाव की गणना की जाती है, तो एक सटीक समानता गर्म गर्मी स्नान से गर्मी हस्तांतरण के लिए किसी भी गर्मी इंजन द्वारा किए गए काम के घातीय औसत से संबंधित होती है।[5]
वास्तविक ताप इंजन की क्षमता
कार्नोट ने महसूस किया कि, वास्तव में, ऊष्मागतिकी रिवर्सिबिलिटी इंजन बनाना संभव नहीं है। तो, समीकरण द्वारा इंगित की तुलना में वास्तविक ताप इंजन भी कम कुशल हैं 3. इसके अलावा, वास्तविक इंजन जो कार्नोट चक्र शैली (आइसोथर्मल एक्सपेंशन/आइसेंट्रोपिक एक्सपेंशन/आइसोथर्मल कम्प्रेशन/आइसेंट्रोपिक कम्प्रेशन) के साथ काम करते हैं, दुर्लभ हैं। फिर भी, समीकरण 3 थर्मल जलाशयों के दिए गए सेट के लिए कभी भी अपेक्षित अधिकतम दक्षता निर्धारित करने के लिए अत्यंत उपयोगी है।
हालांकि कार्नोट का चक्र एक आदर्शीकरण है, समीकरण 3 क्योंकि कार्नोट दक्षता की अभिव्यक्ति अभी भी उपयोगी है। औसत तापमान पर विचार करें,
कार्नोट चक्र, या इसके समतुल्य के लिए, औसत मान 〈TH〉 उपलब्ध उच्चतम तापमान के बराबर होगा, अर्थात् टीH, और टीC〉 सबसे कम, अर्थात् टीC. अन्य कम कुशल ऊष्मागतिकी चक्रों के लिए, 〈टीH〉 टी से कम होगाH, और टीC〉 टी से अधिक होगाC. यह समझाने में मदद कर सकता है, उदाहरण के लिए, क्यों एक अर्थशास्त्री या पुनर्योजी हीट एक्सचेंजर भाप बिजली संयंत्रों की थर्मल दक्षता में सुधार कर सकता है और क्यों संयुक्त-चक्र बिजली संयंत्रों की थर्मल दक्षता (जिसमें उच्च तापमान पर संचालित गैस टर्बाइन शामिल हैं) से अधिक है पारंपरिक भाप संयंत्र। डीजल इंजन का पहला प्रोटोटाइप कार्नोट चक्र पर आधारित था।
एक अव्यावहारिक मैक्रोस्कोपिक निर्माण के रूप में कार्नो हीट इंजन
एक कार्नोट ताप इंजन एक ऊष्मा इंजन है जो एक कार्नोट चक्र का प्रदर्शन करता है, और मैक्रोस्कोपिक पैमाने पर इसकी प्राप्ति अव्यावहारिक है। उदाहरण के लिए, कार्नोट चक्र के इज़ोटेर्माल प्रक्रिया भाग के लिए, विस्तार में प्रत्येक चरण पर एक साथ निम्नलिखित शर्तों को पूरा किया जाना चाहिए:[6]
- गर्म जलाशय का तापमान टीHप्रणाली गैस तापमान टी की तुलना में असीम रूप से अधिक है, इसलिए गर्म जलाशय से गैस में गर्मी का प्रवाह (ऊर्जा हस्तांतरण) टी को बढ़ाए बिना किया जाता है (गैस द्वारा एक अन्य ऊर्जा हस्तांतरण के रूप में परिवेश पर असीम काम के माध्यम से); अगर टीHटी से काफी अधिक है, तो टी गैस के माध्यम से एक समान नहीं हो सकता है, इसलिए प्रणाली थर्मल संतुलन से विचलित हो जाएगा और साथ ही एक प्रतिवर्ती प्रक्रिया नहीं होगी (अर्थात कार्नोट चक्र नहीं) या टी काफ़ी बढ़ सकता है, इसलिए यह एक इज़ोटेर्मल नहीं होगा प्रक्रिया।
- बाहरी रूप से पिस्टन पर लगाए गए बल (गैस द्वारा पिस्टन पर आंतरिक बल के विपरीत) को किसी तरह असीम रूप से कम करने की आवश्यकता है। इस बाहरी सहायता के बिना, गैस PV (दबाव-आयतन) वक्र का स्थिर T पर नीचे की ओर चलना संभव नहीं होगा क्योंकि इस वक्र का अनुसरण करने का अर्थ है कि गैस-से-पिस्टन बल घटता है (P घटता है) जैसे-जैसे आयतन बढ़ता है (दबाव-आयतन) पिस्टन बाहर की ओर जाता है)। यदि यह सहायता इतनी मजबूत है कि आयतन विस्तार महत्वपूर्ण है, तो प्रणाली थर्मल संतुलन से विचलित हो सकती है और साथ ही एक प्रतिवर्ती प्रक्रिया नहीं हो सकती है (अर्थात कार्नोट चक्र नहीं)।
ये (और अन्य) अतिसूक्ष्म आवश्यकताएं कार्नोट चक्र को अनंत समय लेती हैं। अन्य व्यावहारिक आवश्यकताएं जो कार्नोट चक्र को महसूस करने के लिए कठिन बनाती हैं (जैसे, गैस का ठीक नियंत्रण, उच्च और निम्न तापमान जलाशयों सहित परिवेश के साथ थर्मल संपर्क), इसलिए कार्नोट इंजन को मैक्रोस्कोपिक स्केल हीट इंजन की सैद्धांतिक सीमा के रूप में सोचा जाना चाहिए बजाय एक व्यावहारिक उपकरण की तुलना में जिसे कभी भी बनाया जा सकता है।
यह भी देखें
- कार्नोट हीट इंजन
- प्रतिवर्ती प्रक्रिया (ऊष्मागतिकी्स)
संदर्भ
- Notes
- ↑ 1.0 1.1 1.2 Planck, M. (1945). "equations 39, 40 and 65 in sections §90 & §137". Treatise on Thermodynamics. Dover Publications. pp. 75, 135.
- ↑ Fermi, E. (1956). "equation 64". Thermodynamics (PDF). Dover Publications. p. 48.
- ↑ Çengel, Yunus A., and Michael A. Boles. Thermodynamics: An Engineering Approach. 7th ed. New York: McGraw-Hill, 2011. p. 299. Print.
- ↑ Holubec Viktor and Ryabov Artem (2018). "Cycling Tames Power Fluctuations near Optimum Efficiency". Phys. Rev. Lett. 121 (12): 120601. arXiv:1805.00848. Bibcode:2018PhRvL.121l0601H. doi:10.1103/PhysRevLett.121.120601. PMID 30296120. S2CID 52943273.
- ↑ N. A. Sinitsyn (2011). "Fluctuation Relation for Heat Engines". J. Phys. A: Math. Theor. 44 (40): 405001. arXiv:1111.7014. Bibcode:2011JPhA...44N5001S. doi:10.1088/1751-8113/44/40/405001. S2CID 119261929.
- ↑ D, Bob (2020-01-15). "In the isothermal expansion phase of a Carnot cycle, why does the gas expand?". StackExchange. Retrieved 2022-01-02.
{{cite web}}: CS1 maint: url-status (link)
- Sources
-
- Carnot, Sadi, Reflections on the Motive Power of Fire
- Ewing, J. A. (1910) The Steam-Engine and Other Engines edition 3, page 62, via Internet Archive
- Feynman, Richard P.; Leighton, Robert B.; Sands, Matthew (1963). The Feynman Lectures on Physics. Addison-Wesley Publishing Company. pp. Chapter 44. ISBN 978-0-201-02116-5.
- Halliday, David; Resnick, Robert (1978). Physics (3rd ed.). John Wiley & Sons. pp. 541–548. ISBN 978-0-471-02456-9.
- Kittel, Charles; Kroemer, Herbert (1980). Thermal Physics (2nd ed.). W. H. Freeman Company. ISBN 978-0-7167-1088-2.
- Kostic, M (2011). "Revisiting The Second Law of Energy Degradation and Entropy Generation: From Sadi Carnot's Ingenious Reasoning to Holistic Generalization". AIP Conf. Proc. AIP Conference Proceedings. 1411 (1): 327–350. Bibcode:2011AIPC.1411..327K. CiteSeerX 10.1.1.405.1945. doi:10.1063/1.3665247. American Institute of Physics, 2011. ISBN 978-0-7354-0985-9. Abstract at: [1]. Full article (24 pages [2]), also at [3].
बाहरी कड़ियाँ
- Hyperphysics article on the Carnot cycle.
- S. M. Blinder Carnot Cycle on Ideal Gas powered by Wolfram Mathematica