ठोस नाइट्रोजन

ठोस नाइट्रोजन तत्व नाइट्रोजन के कई ठोस रूप हैं, जिन्हें पहली बार 1884 में देखा गया था। ठोस नाइट्रोजन मुख्य रूप से अकादमिक शोध का विषय है, लेकिन कम तापमान, कम दबाव वाला ठोस नाइट्रोजन बाहरी सौर मंडल में निकायों का एक महत्वपूर्ण घटक है और उच्च तापमान, उच्च दबाव ठोस नाइट्रोजन एक शक्तिशाली विस्फोटक है, जिसमें किसी अन्य गैर-परमाणु सामग्री की तुलना में उच्च ऊर्जा घनत्व होता है।[1]
पीढ़ी
करोल ओल्ज़वेस्की ने पहली बार 1884 में ठोस नाइट्रोजन का अवलोकन किया, पहले तरल हाइड्रोजन को वाष्पित करने वाले तरल नाइट्रोजन के साथ, और फिर तरल हाइड्रोजन को नाइट्रोजन को जमने की अनुमति दी।[2] ठोस नाइट्रोजन से वाष्प को वाष्पित करके, ओल्ज़वेस्की ने अत्यंत निम्न तापमान 48 K भी उत्पन्न किया , उस समय एक विश्व रिकॉर्ड था।[3]
आधुनिक तकनीकें सामान्यतः एक समान दृष्टिकोण अपनाती हैं: ठोस नाइट्रोजन को सामान्यतः एक प्रयोगशाला में तरल नाइट्रोजन को एक निर्वात में वाष्पित करके बनाया जाता है। उत्पादित ठोस झरझरा होता है।[4]
प्रकृति में घटना
ठोस नाइट्रोजन प्लूटो (जहाँ यह ठोस कार्बन मोनोआक्साइड और मीथेन के साथ मिश्रित होता है) और नेप्च्यूनियन चंद्रमा ट्राइटन (चंद्रमा) की सतह का एक बड़ा हिस्सा बनाता है। प्लूटो पर इसे पहली बार जुलाई 2015 में नए क्षितिज अंतरिक्ष जांच द्वारा और ट्राइटन पर सीधे वोयाजर 2 अंतरिक्ष जांच द्वारा अगस्त 1989 में देखा गया था।[5][6][7]
ट्राइटन की अधिकांश सतह ठोस नाइट्रोजन (बीटा क्रिस्टल चरण) के हेक्सागोनल रूप में ढकी हुई है, जिसे इस कृत्रिम रंग फोटोमोज़ेक में भूमध्य रेखा के चारों ओर एक नीले हरे रंग की पट्टी के रूप में देखा जा सकता है।
ठोस नाइट्रोजन में बाहरी सौर मंडल में चट्टानों के निर्माण के लिए प्रासंगिक कई गुण होते हैं। ठोस नाइट्रोजन के कम तापमान पर भी यह काफी अस्थिर होता है और वातावरण बनाने के लिए ऊर्ध्वपातन कर सकता है, या नाइट्रोजन ठंढ में वापस संघनित हो सकता है। अन्य पदार्थों की तुलना में, ठोस नाइट्रोजन कम दबाव पर संसंजन खो देता है और एकत्रित होने पर हिमनदो के रूप में प्रवाहित होता है। फिर भी इसका घनत्व पानी की बर्फ की तुलना में अधिक है, इसलिए उछाल की ताकत स्वाभाविक रूप से पानी के बर्फ के ब्लॉक को सतह की ओर ले जाएगी। वास्तव में, न्यू होराइजन्स ने प्लूटो की सतह पर नाइट्रोजन की बर्फ के ऊपर तैरती हुई पानी की बर्फ देखी।[5]
ट्राइटन पर, ठोस नाइट्रोजन ठंढ क्रिस्टल और तापानुशीतित नाइट्रोजन बर्फ की एक पारदर्शी शीट परत का रूप ले लेती है, जिसे प्रायः शीशे का आवरण कहा जाता है।[7]वायेजर 2 द्वारा ट्राइटन के दक्षिणी ध्रुवीय बर्फ की उच्चतम सीमा के आसपास उपध्रुवीय क्षेत्रों से निकलने के लिए नाइट्रोजन गैस के उष्णोत्स देखे गए।[8] इस देखी गई घटना की एक संभावित व्याख्या यह है कि सूर्य नाइट्रोजन बर्फ की पारदर्शी परत के माध्यम से चमकता है, नीचे की परतों को गर्म करता है। नाइट्रोजन उर्ध्वपातित होती है और अंततः ऊपरी परत में छिद्रों के माध्यम से मिट जाती है, धूल को अपने साथ ले जाती है और काली धारियाँ बनाती है।
द्रव अलॉट्रोप्स में संक्रमण
पिघलना
मानक वायुमंडलीय दबाव पर, N2 का गलनांक 63.23 K है .[9]
अधिकांश पदार्थों की तरह, नाइट्रोजन तब तक उच्च तापमान पर पिघलता है जब तक परिवेश का दबाव 50 GPa तक बढ़ जाता है , जब तरल नाइट्रोजन की बहुलकीकरण की भविष्यवाणी की जाती है।[10][11]उस क्षेत्र के भीतर, गलनांक लगभग 190 K/GPa की दर से बढ़ जाता है .[10] ऊपर 50 GPa, गलनांक गिर जाता है।[11]
| दबाव (GPa) | तापमान (K) |
|---|---|
| 2.8 | 308 |
| 4 | 368 |
| 7 | 484 |
| 50 | 1920 |
| 71[11] | 1400 |
उर्ध्वपातन
नाइट्रोजन का त्रिगुण बिंदु होता है 63.14±0.06 K और 0.1255±0.0005 बार; इस दबाव के नीचे, ठोस नाइट्रोजन का सीधे गैस में उर्ध्वपातन होता है।[12] इन कम दबावों पर, नाइट्रोजन केवल दो ज्ञात अपररूपों में उपस्थित है: α-नाइट्रोजन (नीचे 35 K) और β-नाइट्रोजन (35–63 K)। 20–63 K से वाष्प के दबाव का मापन निम्नलिखित अनुभवजन्य संबंध का सुझाव देंता है:[12]
सामान्य क्रायोजेन्स में घुलनशीलता
ठोस नाइट्रोजन तरल हाइड्रोजन में थोड़ा घुलनशील है। घुलनशीलता के आधार पर 60–75 K गैसीय हाइड्रोजन,[13] सेडल एट अल का अनुमान है कि तरल हाइड्रोजन पर 15 K (1–10)×1010 (molecule N2)/cm3 घुल सकता है।[14] अतिरिक्त ठोस नाइट्रोजन के साथ हाइड्रोजन के क्वथनांक पर, घुलित मोलर अंश 10−8 होता है. पर 32.5 K (H2 के क्वथनांक के ठीक नीचे ) और 15 atm, घुलित N2 की अधिकतम मोलर सान्द्रता 7.0×10−6है।[15]
नाइट्रोजन और ऑक्सीजन तरल अवस्था में मिश्रणीय होते हैं लेकिन ठोस अवस्था में अलग होते हैं। इस प्रकार अतिरिक्त नाइट्रोजन (63 K पर पिघलना) या ऑक्सीजन (55 K पर पिघलना) पहले जम जाता है, और यूटेक्टिक तरल हवा 50 K पर जम जाती है।[16]
क्रिस्टल संरचना
डिनाइट्रोजन क्रिस्टल
परिवेशी और मध्यम दबावों पर, नाइट्रोजन डाइनाइट्रोजन बनाती हैN2 अणु; कम तापमान पर लंदन फैलाव बल इन अणुओं को जमने के लिए पर्याप्त है।[17]
α और β
ठोस नाइट्रोजन परिवेश के दबाव में दो चरणों को स्वीकार करता है: α- और β-नाइट्रोजन।
नीचे 35.6 K, नाइट्रोजन अंतरिक्ष समूह Pa3 के साथ एक घन संरचना को गोद लेती है; N2 अणु यूनिट सेल क्यूब के शरीर के विकर्णों पर स्थित होते हैं। कम तापमान पर α- चरण को संकुचित किया जा सकता है 3500 atm इसके बदलने से पहले (γ तक), और जैसे-जैसे तापमान ऊपर उठता है 20 K, यह दबाव लगभग बढ़ जाता है 4500 atm. पर 21 K, इकाई सेल आयाम है 5.667 Å, घटते हुए 5.433 Å अंतर्गत 3785 bar.[10][18] ऊपर 35.6 K (जब तक यह पिघल नहीं जाता), नाइट्रोजन एक हेक्सागोनल बंद पैक संरचना को अपनाता है, यूनिट सेल अनुपात के साथ c⁄a ≈ 1.633 = √8⁄3. नाइट्रोजन के अणुओं को बेतरतीब ढंग से के कोण पर इत्तला दे दी जाती है 55°, मजबूत चौगुनी-चतुर्भुज अंतःक्रिया के कारण। पर 45 K यूनिट सेल है a = 4.050 Å और c = 6.604 Å, लेकिन ये सिकुड़ जाते हैं 4125 atm और 49 K को a = 3.861 Å और c = 6.265 Å. उच्च दबावों पर, c⁄a व्यावहारिक रूप से कोई भिन्नता प्रदर्शित नहीं करता है।[10][18]
γ ==
चतुष्कोणीय γ रूप नीचे कम तापमान पर मौजूद है 44.5 K और चारों ओर दबाव 0.3–3 GPa. ए/बी/सी2 त्रिगुण बिंदु पर होता है 0.47 GPa और 44.5 K. γ-डाइनिट्रोजन का निर्माण पर्याप्त संतुलन स्थिरांक # समस्थानिक प्रतिस्थापन का प्रभाव प्रदर्शित करता है: पर 20 K, आइसोटोप 15N दाब पर γ रूप में परिवर्तित होता है 400 atm (0.041 GPa) प्राकृतिक नाइट्रोजन से कम।
γ चरण का अंतरिक्ष समूह P4 है2/ एमएनएम। और 20 K और 4000 bar, यूनिट सेल में जाली स्थिरांक होते हैं a = 3.957 Å और c = 5.109 Å.
नाइट्रोजन के अणु स्वयं P4 में व्यवस्थित होते हैं2/ एमएनएम पैटर्न एफ[Note 1] और लंबे आयाम के साथ लम्बी गोलाकार आकृति लें 4.34 Å और व्यास 3.39 Å.[Note 2] अणु तक कंपन कर सकते हैं 10° पर ab विमान, और ऊपर 15° की दिशा में c एक्सिस।[10][18]
डी, डीloc, और ε
उच्च दबाव (लेकिन परिवेश के तापमान) पर, डाइनाइट्रोजन घन δ रूप को ग्रहण करता है, अंतरिक्ष समूह pm3n और आठ अणु प्रति यूनिट सेल के साथ। यह चरण एक जाली स्थिरांक को स्वीकार करता है 6.164 Å (पर 300 K और 4.9 GPa).[19] डी-N2 दो ट्रिपल अंक स्वीकार करता है। (δ-N2, बी-N2, द्रव) त्रिक बिंदु कहीं आस-पास होता है 8–10 GPa और 555–578 K.[10] (δ-N2, बी-N2, सी-N2) त्रिक बिंदु पर होता है 2.3 GPa और 150 K.[19]
जाली कोशिकाओं के भीतर, अणुओं में स्वयं अव्यवस्थित अभिविन्यास होता है,[20]लेकिन दबाव में वृद्धि एक चरण संक्रमण को थोड़ा अलग चरण में बदल देती है, δloc, जिसमें आणविक अभिविन्यास उत्तरोत्तर क्रमबद्ध होते हैं, एक भेद जो केवल रमन स्पेक्ट्रोस्कोपी के माध्यम से दिखाई देता है।[21] उच्च दबाव पर (मोटे तौर पर 2–13 GPa) और कम तापमान,[Note 3] डाइनाइट्रोजन अणु अभिविन्यास पूरी तरह से rhombohedral ε चरण में व्यवस्थित होता है, जो अंतरिक्ष समूह R का अनुसरण करता है3सी।[10][20][23] सेल आयाम हैं a = 8.02 Å, b = 8.02 Å, c = 11.104 Å, α = β = 90°, γ = 120°, आयतन 618.5 Å3, Z = 24.[24] भंग He स्थिर कर सकते हैं ε-N2 उच्च तापमान या कम दबाव में δ- में बदलने सेN2 (देखना § Related substances).[20]
=
ऊपर 69 GPa, उह-N2 ζ- द्वारा नामित ऑर्थोरोम्बिक चरण में बदल जाता हैN2 के साथ 6% मात्रा में कमी। ζ- का अंतरिक्ष समूहN2 P222 है1. जाली स्थिरांक हैं a = 4.159 Å, b = 2.765 Å, c = 5.039 Å प्रति यूनिट सेल आठ परमाणुओं के साथ। ζ प्रावस्था में नाइट्रोजन परमाणुओं के बीच अंतराअणुक दूरी होती है 0.982–1.93 Å और एक अलग अणु में निकटतम नाइट्रोजन परमाणु है 1.73–2.38 Å (दबाव पर निर्भर करता है; कम दबाव उच्च इंट्रामोल्युलर और कम इंटरमॉलिक्युलर दूरी के अनुरूप होता है)।[1]
θ और ι
आगे संपीड़न और ताप आश्चर्यजनक मेटास्टेबिलिटी के साथ नाइट्रोजन के दो क्रिस्टलीय चरणों का उत्पादन करता है।[25] एक जी-N2 चरण के लिए संकुचित 95 GPa और फिर गर्म करने के लिए 600 K एक समान रूप से पारभासी संरचना का निर्माण करता है जिसे θ-नाइट्रोजन कहा जाता है।[25]
ι चरण को समदाबीय रूप से ताप ε- द्वारा पहुँचा जा सकता हैN2 को 750 K पर 65 GPa या θ- का इज़ोटेर्माल विसंपीड़नN2 को 69 GPa पर 850 K.[26] ι-N2 क्रिस्टल संरचना की इकाई-कोशिका आयामों के साथ आदिम मोनोक्लिनिक जाली की विशेषता है: a = 9.899(2) Å, b = 8.863(2) Å, c = 8.726(2) Å और β = 91.64(3)° पर 56 GPa और परिवेश का तापमान। अंतरिक्ष समूह P2 है1/c और यूनिट सेल में 48 होते हैं N2 अणु एक स्तरित संरचना में व्यवस्थित होते हैं।[27] दबाव मुक्त होने पर, θ-N2 ε- पर वापस नहीं आता हैN2 आसपास तक 30 GPa; मैं-N2 ε- में बदल जाता हैN2 आसपास तक 23 GPa.[25]
ब्लैक फॉस्फोरस नाइट्रोजन
दबाव में नाइट्रोजन को संपीड़ित करते समय 120–180 GPa और तापमान ऊपर 4000 °C,[28][29] नाइट्रोजन काला फास्फोरस (ऑर्थोरोम्बिक, सीएमसीई अंतरिक्ष समूह) के समान एक क्रिस्टल संरचना (बीपी-एन) को गोद लेती है।[30] काले फास्फोरस की तरह, बीपी-एन एक विद्युत कंडक्टर है।[31] बीपी-एन संरचना का अस्तित्व भारी निक्टोजन के व्यवहार से मेल खाता है, और इस प्रवृत्ति की पुष्टि करता है कि उच्च दबाव वाले तत्व कम दबाव पर समूह (आवर्त सारणी) के समान संरचनाओं को अपनाते हैं।[32]
ओलिगोमेर क्रिस्टल
हेक्सागोनल स्तरित बहुलक नाइट्रोजन
हेक्सागोनल स्तरित बहुलक नाइट्रोजन (एचएलपी-एन) को प्रयोगात्मक रूप से संश्लेषित किया गया था 244 GPa और 3300 K. यह एक टेट्रागोनल यूनिट सेल (P4) को अपनाता है।2बीसी) जिसमें एकल-बंधित नाइट्रोजन परमाणु आपस में जुड़ी दो परतों का निर्माण करते हैं N6 षट्भुज। HPL-N कम से कम 66 GPa तक मेटास्टेबल है।[33]
रेखीय रूप (एन6 और n8)
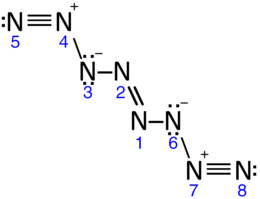
उच्च दबाव और कम तापमान पर हाइड्राज़ीनियम एजाइड का अपघटन 8 नाइट्रोजन परमाणुओं की रैखिक श्रृंखलाओं से बना एक आणविक ठोस बनाता है (N≡N+−N−−N=N−N−−N+≡N). सिमुलेशन सुझाव देते हैं N8 कम तापमान और दबावों पर स्थिर है (<20 GPa); व्यवहार में, सूचना दी N8 25 GPa से नीचे ε एलोट्रोप में विघटित हो जाता है लेकिन एक अवशेष 3 GPa जितना कम दबाव में रहता है।[34][35]

ग्रीचनर एट अल। 2016 में भविष्यवाणी की गई थी कि परिवेशी परिस्थितियों में छह नाइट्रोजेन के साथ एक समान आबंटन मौजूद होना चाहिए।[36]
अनाकार और नेटवर्क आवंटन
ठोस नाइट्रोजन के गैर-आणविक रूप उच्चतम ज्ञात गैर-परमाणु ऊर्जा घनत्व प्रदर्शित करते हैं।[1]
μ
जब ζ-N2 चरण कमरे के तापमान पर संकुचित होता है 150 GPa एक अनाकार रूप निर्मित होता है।[1]यह एक नैरो गैप सेमीकंडक्टर है, और इसे μ-फेज नामित किया गया है। μ-चरण को पहले ठंडा करके वायुमंडलीय दबाव में लाया गया है 100 K.[37]
=
η-N नाइट्रोजन का अर्धचालक अक्रिस्टलीय रूप है। यह आसपास के दबावों पर बनता है 80–270 GPa और तापमान 10–510 K. परावर्तित प्रकाश में यह काला दिखाई देता है, लेकिन कुछ लाल या पीले रंग का प्रकाश संचारित करता है। इन्फ्रारेड में चारों ओर एक अवशोषण बैंड होता है 1700 cm−1. इससे भी अधिक दबाव में लगभग 280 GPa, ऊर्जा अंतराल बंद हो जाता है और η-नाइट्रोजन धातुकृत हो जाता है।[38]
क्यूबिक गौचे
से अधिक दाब पर 110 GPa और आसपास का तापमान 2000 K, नाइट्रोजन एक ठोस नेटवर्क बनाता है, जो क्यूबिक-लेफ्ट संरचना में सहसंयोजक बंधों से बंधा होता है, जिसे cg-N के रूप में संक्षिप्त किया जाता है। क्यूबिक-गौचे फॉर्म में स्पेस ग्रुप I2 है13. प्रत्येक एकक कोष्ठिका के किनारे की लंबाई होती है 3.805 Å, और इसमें आठ नाइट्रोजन परमाणु होते हैं।[23] एक नेटवर्क के रूप में, cg-N में नाइट्रोजन परमाणुओं के जुड़े हुए छल्ले होते हैं; प्रत्येक परमाणु पर, बंधन कोण टेट्राहेड्रल के बहुत करीब होते हैं। इलेक्ट्रॉनों के एकाकी युग्मों की स्थिति को इस प्रकार परासित किया जाता है कि उनका अतिच्छादन कम से कम हो।[37]
नाइट्रोजन के लिए क्यूबिक-गौचे संरचना में 1.40 Å की बॉन्ड लंबाई, 114.0° के बॉन्ड कोण और -106.8° के डायहेड्रल कोण होने की भविष्यवाणी की गई है। गॉचे शब्द विषम डायहेड्रल कोणों को संदर्भित करता है, यदि यह 0° होता तो इसे सीस-ट्रांस आइसोमेरिज़्म कहा जाता, और यदि 180° इसे ट्रांस कहा जाता। डायहेड्रल कोण Φ बॉन्ड कोण θ से sec(Φ) = sec(θ) - 1 से संबंधित है। x, x, x पर यूनिट सेल में एक परमाणु का समन्वय cos(θ) = द्वारा बॉन्ड कोण को भी निर्धारित करता है। एक्स(एक्स-1/4)/(एक्स2+(x-1/4)2).[39] सीजी-एन में सभी बंधनों की लंबाई समान होती है: 1.346 Å पर 115 GPa.[1][40] इससे पता चलता है कि सभी बॉन्ड में एक ही अनुबंध आदेश होता है: एकल बंधन कैरीइंग 4.94 eV/atom. इसके विपरीत नाइट्रोजन गैस में त्रिक बंधन ही वहन करता है 0.83 eV/atom, ताकि गैसीय रूप में छूट में जबरदस्त ऊर्जा रिलीज शामिल हो: किसी भी अन्य गैर-परमाणु प्रतिक्रिया से अधिक।[1][41] इस कारण विस्फोटकों और रॉकेट ईंधन में उपयोग के लिए क्यूबिक-गौचे नाइट्रोजन की जांच की जा रही है।[1] इसके ऊर्जा घनत्व के अनुमान भिन्न होते हैं: सिमुलेशन भविष्यवाणी करते हैं 10–33 kJ/g की भविष्यवाणी की है, जो है 160%–300% HMX का ऊर्जा घनत्व।[42][43] सीजी-एन भी चारों ओर एक थोक मापांक के साथ बहुत कठोर है 298 GPa, हीरे के समान।[40]
पॉली-एन
2006 में पॉली-एन और संक्षिप्त पीएन नामक एक अन्य नेटवर्क ठोस नाइट्रोजन की भविष्यवाणी की गई थी।[23]pN में स्पेस ग्रुप C2/c और सेल डायमेंशन a = 5.49 Å, β = 87.68° है। अन्य उच्च दबाव बहुलक रूपों की सिद्धांत में भविष्यवाणी की जाती है, और दबाव पर्याप्त होने पर धातु के रूप की अपेक्षा की जाती है।[44]
अन्य
फिर भी ठोस डाइनाइट्रोजन के अन्य चरणों को ζ'-N कहा जाता है2 और κ-एन2.[37]
थोक गुण
पर 58 K परम संपीड़न शक्ति 0.24 एमपीए है। जैसे-जैसे तापमान 40.6 K पर 0.54 MPa घटता है, शक्ति बढ़ती है। लोचदार मापांक समान सीमा में 161 से 225 MPa तक भिन्न होता है।[45] ठोस नाइट्रोजन की तापीय चालकता 0.7 W m है−1 के-1.[46] तापीय चालकता तापमान के साथ बदलती है और संबंध k = 0.1802 × T द्वारा दिया जाता है0.1041 डब्ल्यू मी−1 के-1.[47] विशिष्ट ऊष्मा 926.91×e द्वारा दी जाती है0.0093T जूल प्रति किलोग्राम प्रति केल्विन।[47]50 केल्विन पर इसका स्वरूप पारदर्शी होता है, जबकि 20 K पर यह सफेद होता है।
नाइट्रोजन ठंढ का घनत्व 0.85 ग्राम सेमी है−3.[48] एक थोक सामग्री के रूप में क्रिस्टल एक साथ दबाए जाते हैं और घनत्व पानी के करीब होता है। यह तापमान पर निर्भर है और ρ = 0.0134T द्वारा दिया गया है2 − 0.6981T + 1038.1 kg/m3</उप>।[47]प्रसार का आयतन गुणांक 2×10 द्वारा दिया जाता है−6टी2 − 0.0002T + 0.006 K-1.[47]
6328 Å पर अपवर्तन का सूचकांक 1.25 है और तापमान के साथ शायद ही बदलता है।[48]
ध्वनि की गति[clarification needed] ठोस नाइट्रोजन में 1452 m/s 20 K और 1222 m/s 44 K पर है। अनुदैर्ध्य वेग 1850 m/s से 5 K से 1700 m/s 35 K पर है। तापमान वृद्धि के साथ नाइट्रोजन परिवर्तन चरण और अनुदैर्ध्य वेग एक छोटी सी तापमान सीमा पर तेजी से 1600 मीटर/सेकेंड से नीचे गिर जाता है और फिर यह धीरे-धीरे 1400 मीटर/सेकंड के गलनांक के पास गिर जाता है। समान तापमान रेंज में अनुप्रस्थ वेग 900 से 800 मी/से के बीच बहुत कम है।[17]
एस एन के थोक मापांक2 20 K पर 2.16 GPa और 44 K पर 1.47 GPa है।[17]30 K से कम तापमान पर ठोस नाइट्रोजन भंगुर विफलता से गुजरेगा, खासकर अगर तनाव जल्दी से लगाया जाता है। इस तापमान से ऊपर विफलता मोड नमनीय विफलता है। 10K छोड़ने से ठोस नाइट्रोजन 10 गुना कठोर हो जाता है।[17]
संबंधित पदार्थ
दबाव में नाइट्रोजन अन्य अणुओं के साथ क्रिस्टलीय वैन डेर वाल्स यौगिक बना सकती है। यह 5 GPa से ऊपर मीथेन के साथ ऑर्थोरोम्बिक चरण बना सकता है।[49] हीलियम के साथ वह (एन2)11 बन गया है।[20] N2 नाइट्रोजन क्लैथ्रेट में पानी के साथ और ऑक्सीजन ओ के मिश्रण में क्रिस्टलीकृत होता है2 और हवा क्लैथ्रेट में पानी।[50]
हीलियम
ठोस नाइट्रोजन γ-चरण जैसे अव्यवस्थित चरणों में दबाव में 2 मोल% हीलियम को भंग कर सकता है। उच्च दाब 9mol% हीलियम में, वह ε-नाइट्रोजन के साथ प्रतिक्रिया कर एक हेक्सागोनल द्विप्रतिरोधी क्रिस्टलीय वैन डेर वाल्स यौगिक बना सकता है। यूनिट सेल में 22 नाइट्रोजन परमाणु और 2 हीलियम परमाणु होते हैं। इसका आयतन 580Å है3 11 GPa के दबाव के लिए घटकर 515 Å हो जाता है14 GPa पर 3।[20]यह ε-चरण जैसा दिखता है।[51] 14.5 GPa और 295 K पर यूनिट सेल में स्पेस ग्रुप P6 है3/m और a=7.936 Å c=9.360 Å. 28 GPa पर एक ट्रांज़िशन होता है जिसमें N का ओरिएंटेशन होता है2 अणु अधिक व्यवस्थित हो जाते हैं। जब उस पर दबाव (एन2)11 135 GPa से अधिक होने पर पदार्थ स्पष्ट से काले रंग में बदल जाता है, और η-N के समान आकारहीन रूप धारण कर लेता है2.[52]
मीथेन
ठोस नाइट्रोजन शामिल कुछ ठोस मीथेन के साथ क्रिस्टलीकृत हो सकता है। 55 K पर मोलर प्रतिशत 16.35% CH तक हो सकता है4, और 40 हज़ार पर केवल 5%। पूरक स्थिति में, ठोस मीथेन अपने क्रिस्टल में कुछ नाइट्रोजन, 17.31% नाइट्रोजन तक शामिल कर सकता है। जैसे ही तापमान गिरता है, कम मीथेन ठोस नाइट्रोजन में और α-N में घुल सकता है2 मीथेन घुलनशीलता में भारी गिरावट आई है। ये मिश्रण बाहरी सौर मंडल की वस्तुओं जैसे प्लूटो में प्रचलित हैं जिनकी सतह पर नाइट्रोजन और मीथेन दोनों हैं।[53] कमरे के तापमान पर मीथेन और नाइट्रोजन का clathrate 1:1 के अनुपात में 5.6 GPa से अधिक दबाव पर बनता है।[54]
कार्बन मोनोऑक्साइड
कार्बन मोनोऑक्साइड अणु (CO) आकार में डाइनाइट्रोजन के समान है, और यह क्रिस्टल संरचना को बदले बिना ठोस नाइट्रोजन के साथ सभी अनुपातों में मिश्रित हो सकता है। प्लूटो और ट्राइटन (चंद्रमा) की सतहों पर 1% से कम स्तरों पर कार्बन मोनोऑक्साइड भी पाया जाता है। कार्बन मोनोऑक्साइड अवशोषण के इन्फ्रारेड लाइनविड्थ में भिन्नताएं एकाग्रता को प्रकट कर सकती हैं।[55]
नोबल गैसें
नियोन या क्सीनन परमाणुओं को β और δ चरणों में ठोस नाइट्रोजन में भी शामिल किया जा सकता है। नियॉन का समावेश β-δ चरण सीमा को उच्च दबावों की ओर धकेलता है।[56] आर्गन भी ठोस नाइट्रोजन में बहुत मिश्रणीय है।[56]60% से 70% नाइट्रोजन के साथ आर्गन और नाइट्रोजन की रचनाओं के लिए, हेक्सागोनल रूप 0 K तक स्थिर रहता है।[57] जेनॉन और नाइट्रोजन का वैन डेर वाल्स यौगिक 5.3 GPa से ऊपर मौजूद होता है।[56]रमन स्पेक्ट्रोस्कोपी का उपयोग करके नियॉन और नाइट्रोजन के वैन डेर वाल्स यौगिक को दिखाया गया था।[56]यौगिक का सूत्र है (N2)6हाँ7. इसकी हेक्सागोनल संरचना है, a=14.400 c=8.0940 8 GPa के दबाव पर। आर्गन के साथ वैन डेर वाल्स यौगिक ज्ञात नहीं है।[58]
हाइड्रोजन
डाइड्यूटेरियम के साथ, एक क्लैथ्रेट (एन2)12D2 लगभग 70 जीपीए से बाहर निकलता है।[59]
ऑक्सीजन
ठोस नाइट्रोजन ऑक्सीजन O द्वारा एक पाँचवें प्रतिस्थापन तक ले सकता है2 और अभी भी वही क्रिस्टल संरचना रखें।[60] डी-एन2 95% O तक प्रतिस्थापित किया जा सकता है2 और उसी संरचना को बनाए रखें। ठोस ओ2 केवल 5% या उससे कम N का ठोस समाधान हो सकता है2.[60]
प्रयोग करें
तरल नाइट्रोजन की तुलना में तेजी से ठंडा करने के लिए ठोस नाइट्रोजन का उपयोग तरल नाइट्रोजन के साथ स्लश मिश्रण में किया जाता है, जो शुक्राणु क्रियोप्रेज़र्वेशन जैसे अनुप्रयोगों के लिए उपयोगी होता है।[61] अर्ध-ठोस मिश्रण को स्लश नाइट्रोजन भी कहा जा सकता है[62] या SN2।[63] ठोस नाइट्रोजन का उपयोग एक मैट्रिक्स के रूप में किया जाता है, जिस पर प्रतिक्रियाशील रासायनिक प्रजातियों को संग्रहीत और अध्ययन किया जाता है, जैसे मुक्त कण या पृथक परमाणु।[64] एक उपयोग अन्य अणुओं से अलगाव में धातुओं के डाइनाइट्रोजन परिसरों का अध्ययन करना है।[65]
प्रतिक्रियाएं
जब उच्च गति के प्रोटॉन या इलेक्ट्रॉनों द्वारा ठोस नाइट्रोजन का विकिरण किया जाता है, तो परमाणु नाइट्रोजन (N), नाइट्रोजन केशन (N) सहित कई प्रतिक्रियाशील मूलक बनते हैं।+), डाइनाइट्रोजन धनायन (N2+), ट्राइनाइट्रोजन रेडिकल्स (N3 और n3+), और अब्द (एन3-).[66]
टिप्पणियाँ
- ↑ Within the unit cell, atoms are located at positions (x,x,0), (-x,-x,0), (1⁄2+x,1⁄2-x,1⁄2), (1⁄2-x,1⁄2+x,1⁄2) where x = (molecular interatomic distance) / (√8a). This corresponds to molecules lined up in rows end to end diagonally on the ab plane. These rows stack side by side with molecules offset by half their length to form layers in the (001) plane, perpendicular to the c-axis. The layers then stack on top of each other, each rotated by 90° compared to the plane below.
- ↑ Because of the uncertainty principle, the electron wavefunctions for N2 have infinite extent. The quoted dimensions correspond to an arbitrary cutoff at electron density 0.0135 (e−)/Å3.
- ↑ The ε-δ phase transition temperature varies substantially with pressure. At 2 GPa, the transition occurs around 50 K.[22]
संदर्भ
- ↑ 1.0 1.1 1.2 1.3 1.4 1.5 1.6 Eremets, M. I.; Gavriliuk, A. G.; Serebryanaya, N. R.; Trojan, I. A.; Dzivenko, D. A.; Boehler, R.; Mao, H. K.; Hemley, R. J. (2004). "उच्च दबावों पर आणविक नाइट्रोजन का एकल-बंधित परमाणु अवस्था में संरचनात्मक परिवर्तन" (PDF). The Journal of Chemical Physics. 121 (22): 11296–300. Bibcode:2004JChPh.12111296E. doi:10.1063/1.1814074. PMID 15634085. S2CID 25122837.
- ↑ Olszewski, K (1884). "Nouveaux essais de liquéfaction de l'hydrogène. Solidification et pression critique de l'azote". Comptes Rendus Hebdomadaires des Séances de l'Académie des Sciences (in français). 98: 913–915.
- ↑ Cohen, E. G. D. (1 January 1977). "Toward Absolute Zero: During the past three centuries attempts to approach the absolute zero of temperature have led to the discovery of many important phenomena, including superconductivity and superfluidity". American Scientist. 65 (6): 752–758. Bibcode:1977AmSci..65..752C. JSTOR 27848176.
- ↑ Mikhal'chenko, R. S.; Getmanets, V. F.; Arkhipov, V. T. (September 1972). "झरझरा ठोस नाइट्रोजन में गर्मी हस्तांतरण की ख़ासियतें". Journal of Engineering Physics. 23 (3): 1075–1081. Bibcode:1972JEP....23.1075M. doi:10.1007/BF00832213. S2CID 121585322.
- ↑ 5.0 5.1 "प्लूटो की रहस्यमयी तैरती पहाड़ियाँ". NASA. 2016-02-04. Retrieved 1 May 2016.
- ↑ "न्यू होराइजन्स फ्लाईबी के बाद प्लूटो की सतह पर बहने वाले नाइट्रोजन बर्फ के ग्लेशियर". ABC. 25 July 2015. Retrieved 6 October 2015.
- ↑ 7.0 7.1 McKinnon, William B.; Kirk, Randolph L. (2014). "Triton". In Spohn, Tilman; Breuer, Doris; Johnson, Torrence (eds.). सौर मंडल का विश्वकोश (3rd ed.). Amsterdam; Boston: Elsevier. pp. 861–882. ISBN 978-0-12-416034-7.
- ↑ "Neptune: Moons: Triton". NASA. Archived from the original on October 15, 2011. Retrieved September 21, 2007.
- ↑ Lide, David R. (1990–1991). सीआरसी हैंडबुक ऑफ फिजिक्स एंड केमिस्ट्री (in English) (71st ed.). Boca Raton, Ann Arbor, Boston: CRC Press, inc. pp. 4–22 (one page).
- ↑ 10.0 10.1 10.2 10.3 10.4 10.5 10.6 10.7 Tonkov, E. Yu; Ponyatovsky, E.G. (15 November 2004). उच्च दबाव में तत्वों का चरण परिवर्तन. CRC Press. pp. 126–132. ISBN 978-0-8493-3367-5.
- ↑ 11.0 11.1 11.2 Mukherjee, Goutam Dev; Boehler, Reinhard (30 November 2007). "High-Pressure Melting Curve of Nitrogen and the Liquid-Liquid Phase Transition". Physical Review Letters. 99 (22): 225701. Bibcode:2007PhRvL..99v5701M. doi:10.1103/PhysRevLett.99.225701. PMID 18233298.
- ↑ 12.0 12.1 Fray, N.; Schmitt, B. (December 2009). "Sublimation of ices of astrophysical interest: A bibliographic review". Planetary and Space Science. 57 (14–15): 2053–2080. Bibcode:2009P&SS...57.2053F. doi:10.1016/j.pss.2009.09.011.
- ↑ Omar, M. H.; Dokoupil, Z. (1962-01-01). "नाइट्रोजन के त्रिगुण बिंदु से अधिक तापमान पर सिस्टम हाइड्रोजन-नाइट्रोजन के वाष्प-तरल संतुलन पर कुछ पूरक माप". Physica (in English). 28 (1): 33–43. Bibcode:1962Phy....28...33O. doi:10.1016/0031-8914(62)90089-7. ISSN 0031-8914.
- ↑ Seidel, G. M.; Maris, H. J.; Williams, F. I. B.; Cardon, J. G. (2 June 1986). "तरल हाइड्रोजन का सुपरकूलिंग". Physical Review Letters. 56 (22): 2380–2382. Bibcode:1986PhRvL..56.2380S. doi:10.1103/PhysRevLett.56.2380. PMID 10032971.
- ↑ Omar, M.H.; Dokoupil, Z. (May 1962). "Solubility of nitrogen and oxygen in liquid hydrogen at temperatures between 27 and 33K". Physica. 28 (5): 461–471. Bibcode:1962Phy....28..461O. doi:10.1016/0031-8914(62)90033-2.
- ↑ Kochenburger, Thomas M.; Grohmann, Steffen; Oellrich, Lothar R. (2015). "Evaluation of a Two-stage Mixed Refrigerant Cascade for HTS Cooling Below 60 K". Physics Procedia. 67: 227–232. Bibcode:2015PhPro..67..227K. doi:10.1016/j.phpro.2015.06.039.
- ↑ 17.0 17.1 17.2 17.3 Yamashita, Yasuyuki; Kato, Manabu; Arakawa, Masahiko (June 2010). "Experimental study on the rheological properties of polycrystalline solid nitrogen and methane: Implications for tectonic processes on Triton". Icarus. 207 (2): 972–977. Bibcode:2010Icar..207..972Y. doi:10.1016/j.icarus.2009.11.032.
- ↑ 18.0 18.1 18.2 Schuch, A. F.; Mills, R. L. (1970). "Crystal Structures of the Three Modifications of Nitrogen 14 and Nitrogen 15 at High Pressure". The Journal of Chemical Physics. 52 (12): 6000–6008. Bibcode:1970JChPh..52.6000S. doi:10.1063/1.1672899.
- ↑ 19.0 19.1 Cromer, D. T.; Mills, R. L.; Schiferi, D.; Schwalbe, L. A. (15 January 1981). "The structure of N2 at 49 kbar and 299 K". Acta Crystallographica Section B: Structural Crystallography and Crystal Chemistry. 37 (1): 8–11. doi:10.1107/S0567740881002070.
- ↑ 20.0 20.1 20.2 20.3 20.4 Vos, W. L.; Finger, L. W.; Hemley, R. J.; Hu, J. Z.; Mao, H. K.; Schouten, J. A. (2 July 1992). "ठोस नाइट्रोजन-हीलियम मिश्रण में एक उच्च दबाव वैन डेर वाल्स यौगिक". Nature. 358 (6381): 46–48. Bibcode:1992Natur.358...46V. doi:10.1038/358046a0. S2CID 4313676.
- ↑ Tassini, Leonardo; Gorelli, Federico; Ulivi, Lorenzo (2005-02-04). "संपीड़ित ठोस नाइट्रोजन में उच्च तापमान संरचनाएं और ओरिएंटल डिसऑर्डर". The Journal of Chemical Physics (in English). 122 (7): 074701. Bibcode:2005JChPh.122g4701T. doi:10.1063/1.1849154. ISSN 0021-9606. PMID 15743259.
- ↑ Mills, R. L.; Olinger, Bart; Cromer, D. T. (1986). "Structures and phase diagrams of N2 and CO to 13 GPa by x-ray diffraction". The Journal of Chemical Physics. 84 (5): 2837. Bibcode:1986JChPh..84.2837M. doi:10.1063/1.450310.
- ↑ 23.0 23.1 23.2 Kotakoski, J.; Albe, K. (10 April 2008). "First-principles calculations on solid nitrogen: A comparative study of high-pressure phases". Physical Review B. 77 (14): 144109. Bibcode:2008PhRvB..77n4109K. doi:10.1103/PhysRevB.77.144109.
- ↑ NIMS. "परमाणु कार्य सामग्री डेटाबेस". Retrieved 3 October 2015.
- ↑ 25.0 25.1 25.2 Goncharov, A.; Gregoryanz, E. (15 April 2004). उच्च दबाव और तापमान की चरम स्थितियों में ठोस नाइट्रोजन. Lawrence Livermore National Lab Special Collections (Report). Chemistry at Extreme Conditions. Archived (PDF) from the original on 28 January 2017. Retrieved 6 December 2021.
- ↑ Gregoryanz, E.; Goncharov, A. F.; Hemley, R. J.; Mao, H. K.; Somayazulu, M.; Shen, G. (13 December 2002). "उच्च दबाव और तापमान पर नाइट्रोजन के नए चरणों के लिए रमन, अवरक्त और एक्स-रे साक्ष्य". Phys. Rev. B. 66 (22): 224108. Bibcode:2002PhRvB..66v4108G. doi:10.1103/physrevb.66.224108.
- ↑ Turnbull, R.; Hanfland, M.; Binns, J.; Martinez-Canales, M.; Frost, M.; Marqués, M.; Howie, R.; Gregoryanz, E. (9 November 2018). "अत्यधिक परिस्थितियों में सघन नाइट्रोजन की असामान्य रूप से जटिल प्रावस्था". Nature Communications. 9 (1): 4717. Bibcode:2018NatCo...9.4717T. doi:10.1038/s41467-018-07074-4. PMC 6226474. PMID 30413685.
- ↑ "पहले कभी नहीं देखा गया "ब्लैक नाइट्रोजन" आवर्त सारणी में पहेली को जोड़ता है". New Atlas. 2 June 2020. Retrieved 16 July 2020.
- ↑ “Black Nitrogen” – Scientists Solve a Puzzle of the Periodic Table. On: SciTechDaily. June 6, 2020
- ↑ Laniel, Dominique; Winkler, Bjoern; Fedotenko, Timofey; Pakhomova, Anna; Chariton, Stella; Milman, Victor; Prakapenka, Vitali; Dubrovinsky, Leonid; Dubrovinskaia, Natalia (2020-05-28). "ब्लैक फॉस्फोरस संरचना के साथ हाई-प्रेशर पॉलीमेरिक नाइट्रोजन एलोट्रोप". Physical Review Letters (in English). 124 (21): 216001. arXiv:2003.02758. Bibcode:2020PhRvL.124u6001L. doi:10.1103/PhysRevLett.124.216001. ISSN 0031-9007. PMID 32530671. S2CID 212414928.
- ↑ Delbert, Caroline (4 June 2020). "वैज्ञानिकों ने बनाया काला नाइट्रोजन". Popular Mechanics. Retrieved 16 July 2020.
- ↑ Ultrahigh-pressure mineralogy : physics and chemistry of the earth's deep interior. Hemley, Russell J. (Russell Julian). Washington, DC: Mineralogical Society of America. 1998. ISBN 0-939950-48-0. OCLC 40542380.
{{cite book}}: CS1 maint: others (link) - ↑ Laniel, D.; Geneste, G.; Weck, G.; Mezouar, M.; Loubeyre, P. (2019-02-11). "Hexagonal Layered Polymeric Nitrogen Phase Synthesized near 250 GPa". Physical Review Letters (in English). 122 (6): 066001. Bibcode:2019PhRvL.122f6001L. doi:10.1103/PhysRevLett.122.066001. ISSN 0031-9007. PMID 30822079. S2CID 73462260.
- ↑ 34.0 34.1 Hirshberg, Barak; Krylov, Anna I.; Gerber, R. Benny (January 2014). "Calculations predict a stable molecular crystal of N8" (PDF). Nature Chemistry (in English). 6 (1): 52–56. Bibcode:2014NatCh...6...52H. doi:10.1038/nchem.1818. ISSN 1755-4349. PMID 24345947.
- ↑ Duwal, Sakun; Ryu, Young-Jay; Kim, Minseob; Yoo, Choong-Shik; Bang, Sora; Kim, Kyungtae; Hur, Nam Hwi (2018-04-07). "Transformation of hydrazinium azide to molecular N8 at 40 GPa". The Journal of Chemical Physics. 148 (13): 134310. Bibcode:2018JChPh.148m4310D. doi:10.1063/1.5021976. ISSN 0021-9606. OSTI 1432864. PMID 29626901.
- ↑ 36.0 36.1 Michael J. Greschner et al. (April 2016). "A New Allotrope of Nitrogen as High-Energy Density Material". The Journal of Physical Chemistry A 120(18). doi:10.1021/acs.jpca.6b01655.
- ↑ 37.0 37.1 37.2 Plašienka, Dušan; Martoňák, Roman (7 March 2015). "Transformation pathways in high-pressure solid nitrogen: From molecular N2 to polymeric cg-N". The Journal of Chemical Physics. 142 (9): 094505. arXiv:1412.1246. Bibcode:2015JChPh.142i4505P. doi:10.1063/1.4908161. PMID 25747092. S2CID 119112608.
- ↑ Gregoryanz, Eugene; Goncharov, Alexander F.; Hemley, Russell J.; Mao, Ho-kwang (13 July 2001). "उच्च दबाव अनाकार नाइट्रोजन". Physical Review B. 64 (5): 052103. arXiv:cond-mat/0105101v1. Bibcode:2001PhRvB..64e2103G. doi:10.1103/PhysRevB.64.052103. S2CID 119343638.
- ↑ Mailhiot, C.; Yang, L. H.; McMahan, A. K. (1 December 1992). "पॉलिमरिक नाइट्रोजन". Physical Review B. 46 (22): 14419–14435. Bibcode:1992PhRvB..4614419M. doi:10.1103/PhysRevB.46.14419. PMID 10003540.
- ↑ 40.0 40.1 Boehler, Reinhard (November 2005). "हीरे की कोशिकाएं और नई सामग्री". Materials Today. 8 (11): 34–42. doi:10.1016/S1369-7021(05)71158-5.
- ↑ Eremets, Mikhail I.; Gavriliuk, Alexander G.; Trojan, Ivan A.; Dzivenko, Dymitro A.; Boehler, Reinhard (4 July 2004). "नाइट्रोजन का एकल-बंधित घन रूप". Nature Materials. 3 (8): 558–563. Bibcode:2004NatMa...3..558E. doi:10.1038/nmat1146. PMID 15235595. S2CID 38483662.
- ↑ Yoo, Choong-Shik (February 2003). "चरम स्थितियों में उपन्यास कार्यात्मक विस्तारित ठोस". DTIC. p. 11. Archived from the original on March 4, 2016. Retrieved 5 October 2015.
- ↑ Bondarchuk, Sergey V.; Minaev, Boris F. (2017). "Super high-energy density single-bonded trigonal nitrogen allotrope—a chemical twin of the cubic gauche form of nitrogen". Physical Chemistry Chemical Physics. 19 (9): 6698–6706. Bibcode:2017PCCP...19.6698B. doi:10.1039/C6CP08723J. PMID 28210733 – via The Royal Society of Chemistry.
- ↑ Ma, Yanming; Oganov, Artem R.; Li, Zhenwei; Xie, Yu; Kotakoski, Jani (9 February 2009). "पॉलिमरिक नाइट्रोजन की उपन्यास उच्च दबाव संरचनाएं". Physical Review Letters. 102 (6): 065501. Bibcode:2009PhRvL.102f5501M. doi:10.1103/PhysRevLett.102.065501. PMID 19257600.
- ↑ Pederson, R. C.; Miller, C. D.; Arvidson, J. M.; Blount, K.; Schulze, M. (1998). "Problems Involved in Determining the Mechanical Properties of Solid Nitrogen and a Composite of Solid Nitrogen and Aluminum Foam (40 K – 61 K)". In Balachandran, U. B.; Gubser, D. G.; Hartwig, K. T.; Reed, R.; Warnes, W. H.; Bardos, V. A. (eds.). क्रायोजेनिक इंजीनियरिंग (सामग्री) में अग्रिम. Vol. 44. Springer Science & Business Media. pp. 339–347. ISBN 9781475790566.
- ↑ Cook, T.; Davey, G. (June 1976). "ठोस नाइट्रोजन और कार्बन डाइऑक्साइड का घनत्व और तापीय चालकता". Cryogenics. 16 (6): 363–369. Bibcode:1976Cryo...16..363C. doi:10.1016/0011-2275(76)90217-4.
- ↑ 47.0 47.1 47.2 47.3 Trowbridge, A. J.; Melosh, H. J.; Steckloff, J. K.; Freed, A. M. (1 June 2016). "प्लूटो के बहुभुज भूभाग की व्याख्या के रूप में जोरदार संवहन". Nature. 534 (7605): 79–81. Bibcode:2016Natur.534...79T. doi:10.1038/nature18016. PMID 27251278. S2CID 6743360. Methods section
- ↑ 48.0 48.1 Satorre, M. A.; Domingo, M.; Luna, R.; Santonja, C. (30 November 2004). "विभिन्न तापमानों पर मीथेन और नाइट्रोजन का घनत्व" (PDF). Springer. Retrieved 1 October 2015.
- ↑ Aldous, Catherine; Desgreniers, Serge (2008). "मीथेन-नाइट्रोजन बाइनरी सिस्टम में उपन्यास वैन डेर वाल्स ठोस चरण" (PDF). Retrieved 21 September 2015.
- ↑ Choukroun, Mathieu; Kieffer, Susan W.; Lu, Xinli; Tobie, Gabriel (2013). "Clathrate Hydrates: Implications for Exchange Processes in the Outer Solar System". सौर मंडल के बर्फ का विज्ञान. pp. 409–454. doi:10.1007/978-1-4614-3076-6_12. ISBN 978-1-4614-3075-9.
- ↑ Olijnyk, H; Jephcoat, A P (15 December 1997). "High-pressure Raman studies of a nitrogen – helium mixture up to 40 GPa". Journal of Physics: Condensed Matter. 9 (50): 11219–11226. Bibcode:1997JPCM....911219O. doi:10.1088/0953-8984/9/50/022. S2CID 250867438.
- ↑ Ninet, S. (1 January 2011). "Structural and vibrational properties of the van der Waals compound (N2)11He up to 135 GPa". Physical Review B. 83 (13): 134107. Bibcode:2011PhRvB..83m4107N. doi:10.1103/PhysRevB.83.134107.
- ↑ Protopapa, S.; Grundy, W.M.; Tegler, S.C.; Bergonio, J.M. (June 2015). "Absorption coefficients of the methane–nitrogen binary ice system: Implications for Pluto". Icarus. 253: 179–188. arXiv:1503.00703. Bibcode:2015Icar..253..179P. doi:10.1016/j.icarus.2015.02.027. S2CID 96796422.
- ↑ Aldous, Catherine. "मीथेन-नाइट्रोजन बाइनरी सिस्टम में उपन्यास वैन डेर वाल्स ठोस चरण" (PDF). www.lightsource.ca. Retrieved 22 September 2015.
- ↑ Quirico, Eric; Schmitt, Bernard (July 1997). "A Spectroscopic Study of CO Diluted in N2Ice: Applications for Triton and Pluto". Icarus. 128 (1): 181–188. Bibcode:1997Icar..128..181Q. doi:10.1006/icar.1997.5710.
- ↑ 56.0 56.1 56.2 56.3 Kooi, M. E.; Schouten, J. A. (1 November 1999). "High-pressure Raman investigation of mutual solubility and compound formation in Xe-N2 and NeN2" (PDF). Physical Review B. 60 (18): 12635–12643. Bibcode:1999PhRvB..6012635K. doi:10.1103/PhysRevB.60.12635.
- ↑ Nosé, Shuichi; Klein, Michael L. (October 1985). "Molecular dynamics study of the alloy (N2)67(Ar)29". Canadian Journal of Physics. 63 (10): 1270–1273. Bibcode:1985CaJPh..63.1270N. doi:10.1139/p85-209.
- ↑ Lotz, H. T.; Schouten, J. A. (19 June 2001). "Phase behavior of the N2-Ar system at high pressures: A Raman spectroscopy study". Physical Review B. 64 (2): 024103. Bibcode:2001PhRvB..64b4103L. doi:10.1103/PhysRevB.64.024103.
- ↑ Kim, Minseob; Yoo, Choong-Shik (2011). "Highly repulsive interaction in novel inclusion D2–N2 compound at high pressure: Raman and x-ray evidence". The Journal of Chemical Physics. 134 (4): 044519. Bibcode:2011JChPh.134d4519K. doi:10.1063/1.3533957. PMID 21280760.
- ↑ 60.0 60.1 Sihachakr, D.; Loubeyre, P. (15 October 2004). "O2 / N2 mixtures under pressure: A structural study of the binary phase diagram at 295 K". Physical Review B. 70 (13): 134105. Bibcode:2004PhRvB..70m4105S. doi:10.1103/PhysRevB.70.134105.
- ↑ Sansinena, M; Santos, MV; Zaritzky, N; Chirife, J (May 2012). "स्पर्म क्रायोप्रिजर्वेशन के लिए इस्तेमाल होने वाले फ्रेंच स्ट्रॉ के लिए कूलिंग रेट के न्यूमेरिकल सिमुलेशन द्वारा लिक्विड और स्लश नाइट्रोजन में हीट ट्रांसफर की तुलना।". Theriogenology. 77 (8): 1717–1721. doi:10.1016/j.theriogenology.2011.10.044. PMID 22225685.
- ↑ Schutte, Eliane; Picciolo, Grace Lee; Kaplan, David S. (2004). ऊतक इंजीनियर चिकित्सा उत्पाद (टीईएमपी) (in English). ASTM International. p. 8. ISBN 9780803134713.
- ↑ Porcu, Eleonora; Ciotti, Patrizia; Venturoli, Stefano (2012-12-06). हैंडबुक ऑफ ह्यूमन ओसाइट क्रायोप्रिजर्वेशन (in English). Cambridge University Press. p. 33. ISBN 9781139851022.
- ↑ Becker, Edwin D.; Pimentel, George C. (1956). "मैट्रिक्स अलगाव विधि द्वारा प्रतिक्रियाशील अणुओं का स्पेक्ट्रोस्कोपिक अध्ययन". The Journal of Chemical Physics. 25 (2): 224. Bibcode:1956JChPh..25..224B. doi:10.1063/1.1742860.
- ↑ Ozin, Geoffrey A.; Voet, Anthony Vander (15 October 1973). "Binary Dinitrogen Complexes of Rhodium, Rh(N2)n (where n= 1–4), in Low Temperature Matrices". Canadian Journal of Chemistry. 51 (20): 3332–3343. doi:10.1139/v73-498.
- ↑ Wu, Yu-Jong; Chen, Hui-Fen; Chuang, Shiang-Jiun; Huang, Tzu-Ping (10 December 2013). "Far Ultraviolet Absorption Spectra of N3 AND N2+ Generated by Electrons Impacting Gaseous N 2". The Astrophysical Journal. 779 (1): 40. Bibcode:2013ApJ...779...40W. doi:10.1088/0004-637X/779/1/40.
बाहरी संबंध
 Media related to ठोस नाइट्रोजन at Wikimedia Commons
Media related to ठोस नाइट्रोजन at Wikimedia Commons- Jessica Orwig: Freezing Liquid Nitrogen Creates Something Amazing. On: BusinessInsider. Jan 28, 2015 - Videos of nitrogen boiling, freezing, and spontaneously changing crystal form.
- Xiaoli Wang, J. Li, N. Xu et al. (2015): Layered polymeric nitrogen in RbN3 at high pressures. In: Scientific Reports volume 5, Article number: 16677. doi:10.1038/srep16677.
