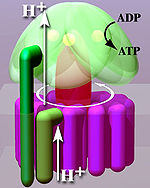
एटीपी सिंथेज़
एटीपी सिंथेज़ ऐसा प्रोटीन है, जो एडेनोसिन डिपोस्फेट (एटीपी) और अकार्बनिक फास्फेट (Pi) का उपयोग करके ऊर्जा भंडारण अणु एडेनोसाइन ट्रायफ़ोस्फेट (एटीपी) के गठन को उत्प्रेरित करता है।) एटीपी सिंथेज़ आणविक मशीन है। एटीपी सिंथेज़ द्वारा उत्प्रेरित होने वाली समग्र प्रतिक्रिया है:
- ADP + Pi + 2H+out ⇌ ATP + H2O + 2H+in
एटीपी सिंथेज़ सेलुलर झिल्ली में स्थित होता है और छिद्र बनाता है, जिसे हाइड्रोन (रसायन विज्ञान) उच्च सांद्रता वाले क्षेत्रों से कम सांद्रता वाले क्षेत्रों में पार कर सकता है, यह एटीपी के संश्लेषण के लिए ऊर्जा प्रदान करता है। इस प्रकार के विद्युत रसायनिक अभिकर्मक इलेक्ट्रॉन परिवहन श्रृंखला द्वारा उत्पन्न होता है और कोशिकाओं को बाद में उपयोग के लिए एटीपी में ऊर्जा संग्रहीत करने की अनुमति देता है। इस प्रकार प्रोकैरियोट में एटीपी सिंथेज़ प्लाज्मा झिल्ली के पार स्थित होता है, जबकि यूकेरियोट में यह आंतरिक माइटोकॉन्ड्रियल झिल्ली के पार होता है। इस प्रकार प्रकाश संश्लेषण में सक्षम जीवों में थायलाकोइड झिल्ली के पार एटीपी सिंथेज़ भी होता है, जो पौधों में क्लोरोप्लास्ट में और साइनोबैक्टीरीया में कोशिका द्रव्य में स्थित होता है।
यूकेरियोटिक एटीपी सिंथेस F-एटीपीसेस हैं, जो एटीपीस के लिए विपरीत दिशा में चलते हैं। यह आलेख मुख्य रूप से इसी प्रकार से संबंधित है। एफ-एटीपेस में दो मुख्य उपइकाइयाँ FO और F1 होती हैं, जिसमें घूर्णी मोटर तंत्र कार्य करता है, जो एटीपी उत्पादन की अनुमति देता है।[1][2]
नामकरण
F1 भिन्न का नाम भिन्न 1 और FO से लिया गया है (सबस्क्रिप्ट अक्षर O के रूप में लिखा गया है, शून्य नहीं) इसका नाम ओलिगोमाइसिन के लिए बाध्यकारी अंश होने से लिया गया है, जो प्राकृतिक रूप से प्राप्त एंटीबायोटिक का प्रकार है जो FO को बाधित करने में सक्षम है। यह एटीपी सिंथेज़ की इकाई हैं।[3][4] इन कार्यात्मक क्षेत्रों में विभिन्न प्रोटीन उपइकाइयाँ सम्मिलित हैं - इसके लिए उपयुक्त तालिकाएँ देखें। इस एंजाइम का उपयोग एरोबिक श्वसन के माध्यम से एटीपी के संश्लेषण में किया जाता है।
संरचना और कार्य
थायलाकोइड झिल्ली और आंतरिक माइटोकॉन्ड्रियल झिल्ली के भीतर स्थित, एटीपी सिंथेज़ में दो क्षेत्र FO और F1 होते हैं, जिसमें FO F1 के घूर्णन का कारण बनता है और सी-रिंग और उपइकाई ए, 2 बी, एफ6 से बना है। F1 α, β, γ, और δ उपइकाई से बना है। इस प्रकार F1 इसमें पानी में घुलनशील भाग होता है जो एटीपी को हाइड्रोलाइज कर सकता है। FO दूसरी ओर मुख्य रूप से हाइड्रोफोबिक क्षेत्र हैं। जहाँ पर FO F1 झिल्ली के पार प्रोटॉन के आवागमन के लिए मार्ग बनाता है।[7]
F1 क्षेत्र
F1 एटीपी सिंथेज़ का हिस्सा हाइड्रोफिलिक है और एटीपी को हाइड्रोलाइज करने के लिए उत्तरदायी है। F1 इकाई माइटोकॉन्ड्रियल आव्यूह स्थान में फैलती है। उपइकाई्स α और β 6 बाइंडिंग साइटों के साथ हेक्सामर बनाते हैं। उनमें से तीन उत्प्रेरक रूप से निष्क्रिय हैं और वे एडीपी को बांधते हैं।
तीन अन्य उपइकाइयाँ एटीपी संश्लेषण को उत्प्रेरित करती हैं। दूसरे F1 उपइकाई γ, δ, और ε घूर्णी मोटर तंत्र (रोटर/एक्सल) का भाग हैं। इस प्रकार γ उपइकाई β को गठनात्मक परिवर्तनों (अर्ताथ, संवृत, आधा विवृत और विवृत स्थिति) से गुजरने की अनुमति देता है जो एटीपी को संश्लेषित होने के बाद बाध्य और निरंतर करने की अनुमति देता है। इस प्रकार F1 कण बड़ा होता है और इसे ट्रांसमिशन इलेक्ट्रॉन माइक्रोस्कोप में ऋणात्मक विवर्णता द्वारा देखा जा सकता है।[8] ये 9 एनएम व्यास के कण हैं जो आंतरिक माइटोकॉन्ड्रियल झिल्ली को हानि पहुंचाते हैं।
| उपइकाई | मानव जीन | टिप्पणी |
|---|---|---|
| एल्फा | एटीपी5ए1, एटीपीएएफ2 | |
| बीटा | एटीपी5बी, एटीपीएएफ1 | |
| गामा | एटीपी5सी1 | |
| डेल्टा | एटीपी5डी | माइटोकॉन्ड्रियल "डेल्टा" जीवाणु/क्लोरोप्लास्टिक एप्सिलॉन है। |
| एप्सिलाॅन | एटीपी5ई | माइटोकॉन्ड्रिया के लिए अद्वितीय। |
| ओएससीपी | एटीपी5ओ | बैक्टीरिया और क्लोरोप्लास्टिक संस्करणों में इसे "डेल्टा" कहा जाता है। |
FO क्षेत्र

FO आठ उपइकाइयों और ट्रांसमेम्ब्रेन रिंग वाला पानी में अघुलनशील प्रोटीन है। इस प्रकार के वलय में हेलिक्स पाश-हेलिक्स प्रोटीन के साथ टेट्रामर आकार होता है जो प्रोटोनेटेड और डिप्रोटोनेटेड होने पर गठनात्मक परिवर्तनों से गुजरता है, इसके लिए समीपस्थ उपइकाई को घूमने के लिए प्रेरित करता है, जिससे FO की घूर्णन होता है। जो फिर F1 की संरचना को भी प्रभावित करता है, जिसके परिणामस्वरूप अल्फा और बीटा उपइकाई की स्थिति में परिवर्तित हो जाती है। FO एटीपी सिंथेज़ का क्षेत्र प्रोटॉन छिद्र है जो माइटोकॉन्ड्रियल झिल्ली में अंतर्निहित होता है। इसमें तीन मुख्य उपइकाइयाँ ए, बी और सी उपस्थित हैं। इस प्रकार छह सी उपइकाई रोटर रिंग बनाती हैं, और उपइकाई b F1 से जुड़कर आधार बनाती है, इसी प्रकार ओएससीपी जो αβ हेक्सामर को घूमने से रोकता है। उपइकाई ए, बी को सी वलय से जोड़ता है।[11] मनुष्य की छह अतिरिक्त उपइकाइयाँ एटीपी5एच, एटीपी5आई, एटीपी5जे2, एटीपी5एल, एटीपी5जे, और एमटी-एटीपी8 (या ए6एल) हैं। एंजाइम का यह भाग माइटोकॉन्ड्रियल आंतरिक झिल्ली में स्थित होता है और इस प्रकार प्रोटॉन के घूर्णन में स्थानांतरित करता है, जो F1 क्षेत्र में एटीपी5जे2 संश्लेषण का कारण बनता है।
यूकेरियोट्स में, माइटोकॉन्ड्रियल FO झिल्ली-झुकने वाले डिमर बनाता है। ये डिमर क्राइस्टे के अंत में लंबी पंक्तियों में स्वयं व्यवस्थित हो जाते हैं, जो संभवतः क्राइस्टे के गठन का पहला चरण है।[12] डिमेरिक यीस्ट FO क्षेत्र के लिए परमाणु मॉडल को क्रायो-ईएम द्वारा 3.6 Å के समग्र रिज़ॉल्यूशन पर निर्धारित किया गया था।[13]
| उपइकाई | मानव जीन |
|---|---|
| ए | एमटी-एटीपी6 |
| बी | एटीपी5एफ1 |
| सी | एटीपी5जी1, एटीपी5जी2, एटीपी5जी3 |
बाइंडिंग मॉडल

1960 से 1970 के दशक में, कैलिफोर्निया विश्वविद्यालय, लॉस एंजिल्स के प्रोफेसर पॉल डी. बॉयर ने बाइंडिंग चेंज, या फ्लिप-फ्लॉप, तंत्र सिद्धांत विकसित किया था, जिसने बताया कि एटीपी संश्लेषण एटीपी सिंथेज़ में गठनात्मक परिवर्तन पर निर्भर करता है। इसके आधार पर गामा उपइकाई का घूर्णन करता हैं। जॉन ई. वॉकर के अनुसंधान समूह ने उस समय कैंब्रिज में आणविक जीव विज्ञान की प्रयोगशाला में, F1 को क्रिस्टलीकृत किया एटीपी सिंथेज़ का उत्प्रेरक-डोमेन हैं। इस संरचना में उस समय ज्ञात था कि सबसे बड़ी असममित प्रोटीन संरचना ने संकेत दिया कि बॉयर का रोटरी-कैटलिसिस मॉडल संक्षेप में सही था। इसे स्पष्ट करने के लिए बॉयर और वॉकर ने रसायन विज्ञान में 1997 के नोबेल पुरस्कार का आधा भाग साझा किया जाता हैं।
F1 की क्रिस्टल संरचना बारी-बारी से अल्फा और बीटा प्रोटीन उपइकाई (प्रत्येक में से 3) को दिखाया गया, जो घूमते हुए असममित गामा उपइकाई के चारों ओर नारंगी के खंडों के समान व्यवस्थित था। इस प्रकार एटीपी संश्लेषण के वर्तमान मॉडल (प्रत्यावर्ती उत्प्रेरक मॉडल के रूप में जाना जाता है) के अनुसार, इलेक्ट्रॉन परिवहन श्रृंखला द्वारा आपूर्ति की गई (H+) प्रोटॉन धनायनों द्वारा निर्मित ट्रांसमेम्ब्रेन क्षमता, झिल्ली के माध्यम से इंटरमेम्ब्रेन स्पेस से (H+) प्रोटॉन धनायनों को चलाती है। जो इस प्रकार FO एटीपी सिंथेज़ का क्षेत्र हैं। इस प्रकार FO का भाग (एटीपी सिंथेज़ उपइकाई सी या सी-उपइकाई की वलय) जीवित प्रणालियों में घूर्णन गति, जैसे प्रोटॉन झिल्ली से गुजरते हैं। इस प्रकार एटीपी सिंथेज़ उपइकाई सी या सी-रिंग असममित केंद्रीय प्रतिपादिका (मुख्य रूप से गामा उपइकाई से मिलकर) से कसकर जुड़ा हुआ है, जिससे यह अल्फा3बीटा3 गामा1 के भीतर घूमता है, जिससे 3 उत्प्रेरक न्यूक्लियोटाइड बाइंडिंग साइटें गठनात्मक परिवर्तनों की श्रृंखला से गुजरती हैं जो एटीपी संश्लेषण की ओर ले जाती हैं। इस प्रकार प्रमुख F1 अल्फा3 बीटा3 से जुड़ने वाले परिधीय प्रतिपादिका द्वारा उपइकाइयों को केंद्रीय प्रतिपादिका रोटर के साथ सहानुभूति में घूमने से रोका जाता है, जिसमें FO के गैर-घूर्णन भाग में अक्षुण्ण एटीपी सिंथेज़ की संरचना वर्तमान में कॉम्प्लेक्स के इलेक्ट्रॉन क्रायो-माइक्रोस्कोपी (क्रायो-ईएम) अध्ययन से कम-रिज़ॉल्यूशन पर ज्ञात है। एटीपी सिंथेज़ के क्रायो-ईएम मॉडल से पता चलता है कि परिधीय प्रतिपादिका लचीली संरचना है, जो F1 से जुड़ते ही कॉम्प्लेक्स के चारों ओर लपेट जाती है, FO को सही परिस्थितियों में, एंजाइम प्रतिक्रिया को रिवर्स में भी किया जा सकता है, जिसमें एटीपी हाइड्रोलिसिस झिल्ली के पार प्रोटॉन पंप चलाता है।
बाइंडिंग परिवर्तन तंत्र में तीन राज्यों के बीच बीटा उपइकाई के चक्रण की सक्रिय साइट उपस्थित है।[14] इस प्रकार की कमजोर अवस्था में, एडीपी और फॉस्फेट सक्रिय स्थल में प्रवेश करते हैं, जिसके निकटवर्ती चित्र में, इसे गुलाबी रंग में दिखाया गया है। फिर एंजाइम आकार में परिवर्तन से गुजरता है और इन अणुओं को साथ मजबूर करता है, इसके लिए परिणामी तंग अवस्था में सक्रिय साइट (लाल रंग में दिखाया गया है) के साथ नव निर्मित एटीपी अणु को बहुत उच्च पृथक्करण स्थिरांक के साथ बांधता है। अंत में, सक्रिय साइट चक्र वापस विवृत अवस्था (नारंगी) में आ जाता है, एटीपी उत्पन्न करता है और अधिक एडीपी और फॉस्फेट को बांधता है, एटीपी उत्पादन के अगले चक्र के लिए तैयार होता है।[15]
शारीरिक भूमिका
अन्य एंजाइमों की तरह, F1 की गतिविधि FO एटीपी सिंथेज़ प्रतिवर्ती है। एटीपी की बड़ी-पर्याप्त मात्रा इसे ट्रांसमेम्ब्रेन प्रोटोन ग्रेडियेंट बनाने का कारण बनती है, इसका उपयोग उन जीवाणु को किण्वित करके किया जाता है, जिनमें इलेक्ट्रॉन परिवहन श्रृंखला नहीं होती है, इसके अतिरिक्त प्रोटॉन अभिकर्मक बनाने के लिए एटीपी को हाइड्रोलाइज किया जाता है, जिसका उपयोग वे कशाभिका को चलाने और कोशिका में पोषक तत्व के परिवहन के लिए करते हैं।
शारीरिक स्थितियों के अनुसार सांस लेने वाले बैक्टीरिया में, एटीपी सिंथेज़, सामान्य रूप से, विपरीत दिशा में चलता है, ऊर्जा के स्रोत के रूप में इलेक्ट्रॉन स्थानांतरण श्रृंखला द्वारा बनाई गई विद्युत रसायनिक क्षमता का उपयोग करते हुए एटीपी बनाता है। इस प्रकार से ऊर्जा बनाने की समग्र प्रक्रिया को ऑक्सीडेटिव फास्फारिलीकरण कहा जाता है।
यही प्रक्रिया माइटोकॉन्ड्रिया में होती है, जहां एटीपी सिंथेज़ आंतरिक माइटोकॉन्ड्रियल झिल्ली में और F1-माइटोकॉन्ड्रियल आव्यूह में भाग परियोजनाएं में स्थित होता है। इस आव्यूह में प्रोटॉन धनायनों को पंप करके, एटीपी-सिंथेज़ एडीपी को एटीपी में परिवर्तित करता है।
विकास
ऐसा माना जाता है कि एटीपी सिंथेज़ का विकास मॉड्यूलर हुआ है जिससे दो कार्यात्मक रूप से स्वतंत्र उपइकाईें जुड़ीं और नई कार्यक्षमता प्राप्त की।[16][17] ऐसा प्रतीत होता है कि यह जुड़ाव विकासवादी इतिहास की शुरुआत में हुआ था, क्योंकि अनिवार्य रूप से एटीपी सिंथेज़ एंजाइम की समान संरचना और गतिविधि जीवन के सभी स्थितियों में उपस्थित है।[16] इस प्रकार F-एटीपी सिंथेज़ वी-एटीपेस के साथ उच्च कार्यात्मक और यंत्रवत समानता प्रदर्शित करता है।[18] चूंकि, जबकि F-एटीपी सिंथेज़ प्रोटॉन अभिकर्मक का उपयोग करके एटीपी उत्पन्न करता है, वी-एटीपीस एटीपी की कीमत पर प्रोटॉन अभिकर्मक उत्पन्न करता है, जिससे pH मान 1 जितना कम होता है।[19]
F1 क्षेत्र हेक्सामेरिक डीएनए हेलिकेज़ (विशेष रूप से आरएचओ कारक) के साथ महत्वपूर्ण समानता दिखाता है, और संपूर्ण एंजाइम क्षेत्र कुछ समानता दिखाता है, इस प्रकार H+
-संचालित टी3एसएस या कशाभिका कॉम्प्लेक्स हैं।[18][20][21] α3β3 F1 क्षेत्र का हेक्सामर हेक्सामेरिक डीएनए हेलिकेसेस के लिए महत्वपूर्ण संरचनात्मक समानता दिखाता है; दोनों केंद्रीय छिद्र के साथ 3-गुना घूर्णी समरूपता वाला वलय बनाते हैं। इसके लिए दोनों की भूमिकाएं छिद्र के भीतर मैक्रोमोलेक्यूल के सापेक्ष घूर्णन पर निर्भर होती हैं; डीएनए हेलिकेस डीएनए अणु के साथ अपनी गति को चलाने और सुपरकोलिंग का पता लगाने के लिए डीएनए के पेचदार आकार का उपयोग करते हैं, जबकि α3β3 हेक्सामर एंजाइमेटिक प्रतिक्रिया को चलाने के लिए γ उपइकाई के घूर्णन के माध्यम से गठनात्मक परिवर्तनों का उपयोग करता है।[22]
H+
+} FO की मोटर कण से महान कार्यात्मक समानता दर्शाता है, जहाँ पर H+
मोटरें जो फ़्लैगेला को चलाती हैं।[18]दोनों में कई छोटे अल्फा-हेलिकल प्रोटीन के वलय होते है, जो पास के स्थिर प्रोटीन के सापेक्ष घूमती है, H+
ऊर्जा स्रोत के रूप में संभावित ढाल के समान हैं। चूंकि, यह लिंक कमजोर होता है, क्योंकि फ्लैगेलर मोटर्स की समग्र संरचना FO की तुलना में कहीं अधिक जटिल है, इस प्रकार लगभग 30 घूर्णन प्रोटीन वाला कण और वलय FO की जटिलता में 10, 11, या 14 पेचदार प्रोटीन से कहीं बड़ा है। चूंकि वर्तमान समय के संरचनात्मक डेटा से पता चलता है कि वलय और प्रतिपादिका संरचनात्मक रूप से F1 कण के समान हैं।[21]
एटीपी सिंथेज़ की उत्पत्ति के लिए मॉड्यूलर विकास सिद्धांत से पता चलता है कि स्वतंत्र कार्य के साथ दो उपइकाई, एटीपीस गतिविधि के साथ डीएनए हेलिकेज़ और H+
मोटर, बांधने में सक्षम थी, और मोटर के घूमने से हेलीकॉप्टर की एटीपीस गतिविधि विपरीत दिशा में चली गई हैं।[16][22] इसके आधार पर कॉम्प्लेक्स ने तब अधिक दक्षता विकसित की और अंततः वर्तमान समय के जटिल एटीपी सिंथेस में विकसित हुआ हैं। इस प्रकार वैकल्पिक रूप से, डीएनए हेलिकेज़ या H+
मोटर कॉम्प्लेक्स हो सकता है H+
हेलीकॉप्टर चलाने की एटीपीस गतिविधि के साथ पंप गतिविधि H+
मोटर व्युत्क्रम हैं।[16] यह विपरीत प्रतिक्रिया करने और एटीपी सिंथेज़ के रूप में कार्य करने के लिए विकसित हुआ होगा।[17][23][24]
अवरोधक
एटीपी सिंथेज़ के विभिन्न प्रकार के प्राकृतिक और सिंथेटिक अवरोधकों की खोज की गई है।[25] इनका उपयोग एटीपी सिंथेज़ की संरचना और तंत्र की जांच के लिए किया गया है। कुछ चिकित्सीय उपयोग के हो सकते हैं। एटीपी सिंथेज़ अवरोधकों के कई वर्ग हैं, जिनमें पेप्टाइड अवरोधक, पॉलीफेनोलिक फाइटोकेमिकल्स, पॉलीकेटाइड्स, ऑर्गेनोटिन यौगिक, पॉलीनिक α-पाइरोन डेरिवेटिव, धनायनित अवरोधक, सब्सट्रेट एनालॉग्स, अमीनो एसिड संशोधक और अन्य विविध रसायन उपस्थित हैं।[25] सबसे अधिक उपयोग किए जाने वाले एटीपी सिंथेज़ अवरोधकों में से कुछ ऑलिगोमाइसिन और एन, एन'-डाइसीक्लोहेक्सिलकार्बोडिमाइड हैं।
विभिन्न जीवों में
बैक्टीरिया ई कोली एटीपी सिंथेज़ का सबसे सरल ज्ञात रूप है, जिसमें 8 अलग-अलग उपइकाई प्रकार हैं।[11]
बैक्टीरियल F-एटीपेसs कभी-कभी विपरीत दिशा में काम कर सकते हैं, जिससे वे एटीपेस में परिवर्तित हो जाते हैं।[26] कुछ जीवाणुओं में कोई F-एटीपेस नहीं होता है, वे द्विदिश रूप से ए/वी-प्रकार एटीपेस का उपयोग करते हैं।[9]
ख़मीर
यीस्ट एटीपी सिंथेज़ सबसे अच्छी तरह से अध्ययन किए गए यूकेरियोटिक एटीपी सिंथेज़ में से है, और पांच F1, आठ FO उपइकाइयाँ, और सात संबद्ध प्रोटीन की पहचान की गई है।[7] इनमें से अधिकांश प्रोटीन अन्य यूकेरियोट्स में समरूप हैं।[27][28][29][30]
पौधा
पौधों में, एटीपी सिंथेज़ क्लोरोप्लास्ट (cF1FO-एटीपी सिंथेज़) में भी उपस्थित होता है)। इस प्रकार एंजाइम थायलाकोइड झिल्ली में एकीकृत होता है, cF1-भाग स्ट्रोमा (द्रव) में चिपक जाता है, जहां प्रकाश संश्लेषण की अंधेरे प्रतिक्रियाएं (जिसे प्रकाश-स्वतंत्र प्रतिक्रियाएं या केल्विन चक्र भी कहा जाता है) और एटीपी संश्लेषण होता है। इस प्रकार क्लोरोप्लास्ट एटीपी सिंथेज़ की समग्र संरचना और उत्प्रेरक तंत्र लगभग बैक्टीरिया एंजाइम के समान ही हैं। चूंकि, क्लोरोप्लास्ट में, विद्युत रासायनिक क्षमता श्वसन इलेक्ट्रॉन परिवहन श्रृंखला द्वारा नहीं बल्कि प्राथमिक प्रकाश संश्लेषक प्रोटीन द्वारा उत्पन्न होती है। अंधेरा होने पर बेकार गतिविधि को रोकने के लिए सिंथेज़ में गामा-उपइकाई में 40-एए सम्मिलित होता है।[31]
स्तनपायी
गोजातीय (बोस टॉरस) हृदय माइटोकॉन्ड्रिया से पृथक एटीपी सिंथेज़, जैव रसायन और संरचना के संदर्भ में, सबसे अच्छी विशेषता वाला एटीपी सिंथेज़ है। हृदय की मांसपेशी में माइटोकॉन्ड्रिया की उच्च सांद्रता के कारण बीफ़ हृदय को एंजाइम के स्रोत के रूप में उपयोग किया जाता है। उनके जीन में मानव एटीपी सिंथेस के समान समरूपता होती है।[32][33][34]
मानव जीन जो एटीपी सिंथेस के घटकों को एनकोड करते हैं:
- एटीपी सिंथेज़, H+ ट्रांसपोर्टिंग, माइटोकॉन्ड्रियल F1 कॉम्प्लेक्स, अल्फा 1
- मैं खाना बनाता हूँ
- एटीपी5सी1, एटीपी5डी, एटीपी5ई, एटीपी5एफ1, एटीपी5जी1, एटीपी5जी2, एटीपी5जी3, एटीपी5एच, एटीपी5आई, एटीपी5जे, एटीपी5जे2, एटीपी5एल, एटीपी5ओ
- एमटी-एटीपी6, एमटी-एटीपी8
अन्य यूकेरियोट्स
कुछ भिन्न वंशों से संबंधित यूकेरियोट्स में एटीपी सिंथेज़ का बहुत विशेष संगठन होता है। यूग्लेनोज़ोआ एटीपी सिंथेज़ बूमरैंग के आकार के F1 के साथ डिमर बनाता है, इस प्रकार अन्य माइटोकॉन्ड्रियल एटीपी सिंथेस की तरह सिर परन्तु FO सबकॉम्प्लेक्स में कई अद्वितीय उपइकाई हैं। इसमें कार्डियोलिपिन का उपयोग किया जाता है। इसके कारण निरोधात्मक F1 ट्रिपैनोसोमेटीडा के साथ साझा करने की विधि से अलग-अलग करने की विधि से भी बांधता है।[35]
आर्किया
आर्किया में सामान्यतः एफ-एटीपेस नहीं होता है। इसके अतिरिक्त, वे ए-एटीपेस/सिंथेज़ का उपयोग करके एटीपी को संश्लेषित करते हैं, इस प्रकार रोटरी मशीन संरचनात्मक रूप से वी-एटीपेस के समान है, परन्तु मुख्य रूप से एटीपी सिंथेज़ के रूप में कार्य करती है।[26] ऐसा माना जाता है कि बैक्टीरिया एफ-एटीपेस के समान यह भी एटीपेस के रूप में कार्य करता है।[9]
लुका और पहले
एफ-एटीपेस जीन लिंकेज और जीन क्रम को प्राचीन प्रोकैरियोट वंशावली में व्यापक रूप से संरक्षित किया गया है, जिसका अर्थ है कि यह प्रणाली अंतिम सार्वभौमिक सामान्य पूर्वज, एलयूसीए से पहले से ही सम्मिलित थी।[36]
यह भी देखें
- FO के संयोजन के लिए आवश्यक एटीपी10 प्रोटीन माइटोकॉन्ड्रियल एटीपीस कॉम्प्लेक्स का क्षेत्र।
- क्लोरोप्लास्ट
- इलेक्ट्रॉन स्थानांतरण श्रृंखला
- फ्लेवोप्रोटीन
- माइटोकांड्रिया
- ऑक्सीडेटिव फाृॉस्फॉरिलेशन
- पी-एटीपेस
- प्रोटॉन पंप
- जीवित प्रणालियों में घूर्णन गति
- ट्रांसमेम्ब्रेन एटीपीस
- वी-एटीपेस
संदर्भ
- ↑ Okuno D, Iino R, Noji H (June 2011). "FoF1-ATP सिंथेज़ का घूर्णन और संरचना". Journal of Biochemistry. 149 (6): 655–664. doi:10.1093/jb/mvr049. PMID 21524994.
- ↑ Junge W, Nelson N (June 2015). "एटीपी सिंथेज़". Annual Review of Biochemistry. 84: 631–657. doi:10.1146/annurev-biochem-060614-034124. PMID 25839341.
- ↑ Kagawa Y, Racker E (May 1966). "ऑक्सीडेटिव फास्फारिलीकरण को उत्प्रेरित करने वाले एंजाइमों का आंशिक समाधान। 8. माइटोकॉन्ड्रियल एडेनोसिन ट्राइफॉस्फेटेज़ पर ओलिगोमाइसिन संवेदनशीलता प्रदान करने वाले कारक के गुण". The Journal of Biological Chemistry. 241 (10): 2461–2466. doi:10.1016/S0021-9258(18)96640-8. PMID 4223640.
- ↑ Mccarty RE (November 1992). "H+-ATPases और ATP सिंथेस के बारे में एक पादप जैव रसायनज्ञ का दृष्टिकोण". The Journal of Experimental Biology. 172 (Pt 1): 431–441. doi:10.1242/jeb.172.1.431. PMID 9874753.
- ↑ PDB: 5ARA; Zhou A, Rohou A, Schep DG, Bason JV, Montgomery MG, Walker JE, et al. (October 2015). "Structure and conformational states of the bovine mitochondrial ATP synthase by cryo-EM". eLife. 4: e10180. doi:10.7554/eLife.10180. PMC 4718723. PMID 26439008.
- ↑ Goodsell D (December 2005). "एटीपी सिंथेज़". Molecule of the Month. doi:10.2210/rcsb_pdb/mom_2005_12.
- ↑ 7.0 7.1 Velours J, Paumard P, Soubannier V, Spannagel C, Vaillier J, Arselin G, Graves PV (May 2000). "यीस्ट एटीपी सिंथेज़ एफ(0) का संगठन: सिस्टीन म्यूटेंट, थिओल संशोधन और क्रॉस-लिंकिंग अभिकर्मकों पर आधारित एक अध्ययन". Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1458 (2–3): 443–456. doi:10.1016/S0005-2728(00)00093-1. PMID 10838057.
- ↑ Fernandez Moran H, Oda T, Blair PV, Green DE (July 1964). "माइटोकॉन्ड्रियल संरचना और कार्य की एक मैक्रोमोलेक्यूलर दोहराई जाने वाली इकाई। गोमांस हृदय की मांसपेशी के पृथक माइटोकॉन्ड्रिया और सबमिटोकॉन्ड्रियल कणों के सहसंबद्ध इलेक्ट्रॉन सूक्ष्म और जैव रासायनिक अध्ययन". The Journal of Cell Biology. 22 (1): 63–100. doi:10.1083/jcb.22.1.63. PMC 2106494. PMID 14195622.
- ↑ 9.0 9.1 9.2 Stewart AG, Laming EM, Sobti M, Stock D (April 2014). "रोटरी ATPases--गतिशील आणविक मशीनें". Current Opinion in Structural Biology. 25: 40–48. doi:10.1016/j.sbi.2013.11.013. PMID 24878343.
- ↑ PDB: 1VZS; Carbajo RJ, Silvester JA, Runswick MJ, Walker JE, Neuhaus D (September 2004). "गोजातीय हृदय माइटोकॉन्ड्रिया से एटीपी सिंथेज़ के परिधीय डंठल क्षेत्र से सबयूनिट एफ(6) की समाधान संरचना". Journal of Molecular Biology. 342 (2): 593–603. doi:10.1016/j.jmb.2004.07.013. PMID 15327958.
- ↑ 11.0 11.1 Ahmad Z, Okafor F, Laughlin TF (2011). "एस्चेरिचिया कोली एटीपी सिंथेज़ की उत्प्रेरक साइटों में चार्ज किए गए अवशेषों की भूमिका". Journal of Amino Acids. 2011: 785741. doi:10.4061/2011/785741. PMC 3268026. PMID 22312470.
- ↑ Blum TB, Hahn A, Meier T, Davies KM, Kühlbrandt W (March 2019). "माइटोकॉन्ड्रियल एटीपी सिंथेज़ के डिमर झिल्ली वक्रता को प्रेरित करते हैं और पंक्तियों में स्वयं-इकट्ठे होते हैं". Proceedings of the National Academy of Sciences of the United States of America. 116 (10): 4250–4255. Bibcode:2019PNAS..116.4250B. doi:10.1073/pnas.1816556116. PMC 6410833. PMID 30760595.
- ↑ Guo H, Bueler SA, Rubinstein JL (November 2017). "Atomic model for the dimeric FO region of mitochondrial ATP synthase". Science. 358 (6365): 936–940. Bibcode:2017Sci...358..936G. doi:10.1126/science.aao4815. PMC 6402782. PMID 29074581.
- ↑ Gresser MJ, Myers JA, Boyer PD (October 1982). "Catalytic site cooperativity of beef heart mitochondrial F1 adenosine triphosphatase. Correlations of initial velocity, bound intermediate, and oxygen exchange measurements with an alternating three-site model". The Journal of Biological Chemistry. 257 (20): 12030–12038. doi:10.1016/S0021-9258(18)33672-X. PMID 6214554.
- ↑ Nakamoto RK, Baylis Scanlon JA, Al-Shawi MK (August 2008). "एटीपी सिंथेज़ का रोटरी तंत्र". Archives of Biochemistry and Biophysics. 476 (1): 43–50. doi:10.1016/j.abb.2008.05.004. PMC 2581510. PMID 18515057.
- ↑ 16.0 16.1 16.2 16.3 Doering C, Ermentrout B, Oster G (December 1995). "रोटरी डीएनए मोटर्स". Biophysical Journal. 69 (6): 2256–2267. Bibcode:1995BpJ....69.2256D. doi:10.1016/S0006-3495(95)80096-2. PMC 1236464. PMID 8599633.
- ↑ 17.0 17.1 Crofts A. "व्याख्यान 10: एटीपी सिंथेज़". Life Sciences at the University of Illinois at Urbana–Champaign.
- ↑ 18.0 18.1 18.2 "एटीपी सिंथेज़". InterPro Database.
- ↑ Beyenbach KW, Wieczorek H (February 2006). "वी-प्रकार एच+ एटीपीस: आणविक संरचना और कार्य, शारीरिक भूमिकाएं और विनियमन". The Journal of Experimental Biology. 209 (Pt 4): 577–589. doi:10.1242/jeb.02014. PMID 16449553.
- ↑ Skordalakes E, Berger JM (July 2003). "Structure of the Rho transcription terminator: mechanism of mRNA recognition and helicase loading". Cell. 114 (1): 135–146. doi:10.1016/S0092-8674(03)00512-9. PMID 12859904. S2CID 5765103.
- ↑ 21.0 21.1 Imada K, Minamino T, Uchida Y, Kinoshita M, Namba K (March 2016). "टाइप III एटीपीस और उसके नियामक की जटिल संरचना से फ्लैगेल्ला प्रकार III निर्यात की अंतर्दृष्टि का पता चला". Proceedings of the National Academy of Sciences of the United States of America. 113 (13): 3633–3638. Bibcode:2016PNAS..113.3633I. doi:10.1073/pnas.1524025113. PMC 4822572. PMID 26984495.
- ↑ 22.0 22.1 Martinez LO, Jacquet S, Esteve JP, Rolland C, Cabezón E, Champagne E, et al. (January 2003). "एटीपी सिंथेज़ की एक्टोपिक बीटा-श्रृंखला हेपेटिक एचडीएल एंडोसाइटोसिस में एक एपोलिपोप्रोटीन ए-आई रिसेप्टर है". Nature. 421 (6918): 75–79. Bibcode:2003Natur.421...75M. doi:10.1038/nature01250. PMID 12511957. S2CID 4333137.
- ↑ Cross RL, Taiz L (January 1990). "Gene duplication as a means for altering H+/ATP ratios during the evolution of FOF1 ATPases and synthases". FEBS Letters. 259 (2): 227–229. doi:10.1016/0014-5793(90)80014-a. PMID 2136729. S2CID 32559858.
- ↑ Cross RL, Müller V (October 2004). "The evolution of A-, F-, and V-type ATP synthases and ATPases: reversals in function and changes in the H+/ATP coupling ratio". FEBS Letters. 576 (1–2): 1–4. doi:10.1016/j.febslet.2004.08.065. PMID 15473999. S2CID 25800744.
- ↑ 25.0 25.1 Hong S, Pedersen PL (December 2008). "एटीपी सिंथेज़ और अवरोधकों की क्रियाओं का उपयोग मानव स्वास्थ्य, बीमारी और अन्य वैज्ञानिक क्षेत्रों में इसकी भूमिकाओं का अध्ययन करने के लिए किया जाता है". Microbiology and Molecular Biology Reviews. 72 (4): 590–641, Table of Contents. doi:10.1128/MMBR.00016-08. PMC 2593570. PMID 19052322.
- ↑ 26.0 26.1 Kühlbrandt W, Davies KM (January 2016). "Rotary ATPases: A New Twist to an Ancient Machine". Trends in Biochemical Sciences. 41 (1): 106–116. doi:10.1016/j.tibs.2015.10.006. PMID 26671611.
- ↑ Devenish RJ, Prescott M, Roucou X, Nagley P (May 2000). "यीस्ट माइटोकॉन्ड्रियल एंजाइम कॉम्प्लेक्स की उपइकाइयों के आणविक आनुवंशिक हेरफेर के माध्यम से एटीपी सिंथेज़ असेंबली और फ़ंक्शन में अंतर्दृष्टि". Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1458 (2–3): 428–442. doi:10.1016/S0005-2728(00)00092-X. PMID 10838056.
- ↑ Kabaleeswaran V, Puri N, Walker JE, Leslie AG, Mueller DM (November 2006). "Novel features of the rotary catalytic mechanism revealed in the structure of yeast F1 ATPase". The EMBO Journal. 25 (22): 5433–5442. doi:10.1038/sj.emboj.7601410. PMC 1636620. PMID 17082766.
- ↑ Stock D, Leslie AG, Walker JE (November 1999). "एटीपी सिंथेज़ में रोटरी मोटर की आणविक वास्तुकला". Science. 286 (5445): 1700–1705. doi:10.1126/science.286.5445.1700. PMID 10576729.
- ↑ Liu S, Charlesworth TJ, Bason JV, Montgomery MG, Harbour ME, Fearnley IM, Walker JE (May 2015). "चार कवक प्रजातियों के माइटोकॉन्ड्रिया से एटीपी सिंथेज़ कॉम्प्लेक्स का शुद्धिकरण और लक्षण वर्णन". The Biochemical Journal. 468 (1): 167–175. doi:10.1042/BJ20150197. PMC 4422255. PMID 25759169.
- ↑ Hahn A, Vonck J, Mills DJ, Meier T, Kühlbrandt W (May 2018). "क्लोरोप्लास्ट एटीपी सिंथेज़ की संरचना, तंत्र और विनियमन". Science. 360 (6389): eaat4318. doi:10.1126/science.aat4318. PMC 7116070. PMID 29748256.
- ↑ Abrahams JP, Leslie AG, Lutter R, Walker JE (August 1994). "Structure at 2.8 A resolution of F1-ATPase from bovine heart mitochondria". Nature. 370 (6491): 621–628. Bibcode:1994Natur.370..621A. doi:10.1038/370621a0. PMID 8065448. S2CID 4275221.
- ↑ Gibbons C, Montgomery MG, Leslie AG, Walker JE (November 2000). "The structure of the central stalk in bovine F(1)-ATPase at 2.4 A resolution". Nature Structural Biology. 7 (11): 1055–1061. doi:10.1038/80981. PMID 11062563. S2CID 23229994.
- ↑ Menz RI, Walker JE, Leslie AG (August 2001). "Structure of bovine mitochondrial F(1)-ATPase with nucleotide bound to all three catalytic sites: implications for the mechanism of rotary catalysis". Cell. 106 (3): 331–341. doi:10.1016/s0092-8674(01)00452-4. PMID 11509182. S2CID 1266814.
- ↑ Mühleip A, McComas SE, Amunts A (November 2019). "बाध्य देशी कार्डियोलिपिन के साथ माइटोकॉन्ड्रियल एटीपी सिंथेज़ की संरचना". eLife. 8: e51179. doi:10.7554/eLife.51179. PMC 6930080. PMID 31738165.
- "बाकियों से अलग". eLife. December 24, 2019.
- ↑ Matzke NJ, Lin A, Stone M, Baker MA (July 2021). "Flagellar export apparatus and ATP synthetase: Homology evidenced by synteny predating the Last Universal Common Ancestor". BioEssays. 43 (7): e2100004. doi:10.1002/bies.202100004. PMID 33998015. S2CID 234747849.
अग्रिम पठन
- Nick Lane: The Vital Question: Energy, Evolution, and the Origins of Complex Life, Ww Norton, 2015-07-20, ISBN 978-0393088816 (Link points to Figure 10 showing model of एटीपी synthase)
बाहरी संबंध
- Boris A. Feniouk: "एटीपी synthase — a splendid molecular machine"
- Well illustrated एटीपी synthase lecture by Antony Crofts of the University of Illinois at Urbana–Champaign.
- Proton and Sodium translocating F-type, V-type and A-type एटीपेसs in OPM database
- The Nobel Prize in Chemistry 1997 to Paul D. Boyer and John E. Walker for the enzymatic mechanism of synthesis of एटीपी; and to Jens C. Skou, for discovery of an ion-transporting enzyme, Na+
, K+
-एटीपेस. - Harvard Multimedia Production Site — Videos – एटीपी synthesis animation
- David Goodsell: "एटीपी Synthase- Molecule of the Month" Archived 2015-09-05 at the Wayback Machine