हेमोसाइनिन
| Hemocyanin, copper containing domain | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
 Single oxygenated functional unit from the hemocyanin of an octopus | |||||||||||
| Identifiers | |||||||||||
| Symbol | Hemocyanin_M | ||||||||||
| Pfam | PF00372 | ||||||||||
| InterPro | IPR000896 | ||||||||||
| PROSITE | PDOC00184 | ||||||||||
| SCOP2 | 1lla / SCOPe / SUPFAM | ||||||||||
| |||||||||||
| Hemocyanin, all-alpha domain | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Crystal structure of hexameric haemocyanin from Panulirus interruptus refined at 3.2 angstroms resolution | |||||||||
| Identifiers | |||||||||
| Symbol | Hemocyanin_N | ||||||||
| Pfam | PF03722 | ||||||||
| InterPro | IPR005204 | ||||||||
| PROSITE | PDOC00184 | ||||||||
| SCOP2 | 1lla / SCOPe / SUPFAM | ||||||||
| |||||||||
| Hemocyanin, ig-like domain | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 crystallographic analysis of oxygenated and deoxygenated states of arthropod hemocyanin shows unusual differences | |||||||||
| Identifiers | |||||||||
| Symbol | Hemocyanin_C | ||||||||
| Pfam | PF03723 | ||||||||
| InterPro | IPR005203 | ||||||||
| PROSITE | PDOC00184 | ||||||||
| SCOP2 | 1lla / SCOPe / SUPFAM | ||||||||
| |||||||||
हेमोसायनिन (जिसे हेमोसायनिन और संक्षिप्त रूप में एचसी भी कहा जाता है) प्रोटीन हैं जो कुछ अकशेरुकी जानवरों के शरीर में ऑक्सीजन पहुंचाते हैं। इन मेटालोप्रोटीन में दो तांबे के परमाणु होते हैं जो एक ऑक्सीजन अणु (O.) को विपरीत रूप से बांधते हैं2). ऑक्सीजन परिवहन अणु के रूप में उपयोग की आवृत्ति में वे हीमोग्लोबिन के बाद दूसरे स्थान पर हैं। कशेरुकियों में पाए जाने वाले लाल रक्त कोशिकाओं में हीमोग्लोबिन के विपरीत, हेमोसाइनिन रक्त कोशिकाओं में सीमित नहीं होते हैं, बल्कि सीधे hemolymph में निलंबित होते हैं। ऑक्सीजनीकरण के कारण रंगहीन Cu(I) विऑक्सीजनित रूप और नीले Cu(II) ऑक्सीजनयुक्त रूप के बीच रंग बदल जाता है।[1]
प्रजाति वितरण
हेमोसाइनिन की खोज सबसे पहले 1878 में लियोन फ्रेडरिक द्वारा आम ऑक्टोपस में की गई थी। मोलस्क में तांबे की उपस्थिति का पता इससे भी पहले 1833 में बार्टोलोमियो विज़ियो द्वारा लगाया गया था।[2] हेमोसाइनिन cephalopods और क्रसटेशियन सहित मोलस्का और ऑर्थ्रोपोड में पाए जाते हैं और कुछ भूमि आर्थ्रोपोड्स जैसे टारेंटयुला यूरीपेल्मा कैलिफ़ोर्निकम द्वारा उपयोग किए जाते हैं।[3] सम्राट बिच्छू, रेफरी नाम = pmid22403673 >Jaenicke E, Pairet B, Hartmann H, Decker H (2012). "सम्राट बिच्छू (पांडिनस इम्पीरेटर) के 24-मेरिक हेमोसाइनिन के क्रिस्टल का क्रिस्टलीकरण और प्रारंभिक विश्लेषण". PLOS ONE. 7 (3): e32548. Bibcode:2012PLoSO...732548J. doi:10.1371/journal.pone.0032548. PMC 3293826. PMID 22403673.
- "सम्राट बिच्छू के नीले खून का एक्स-रे किया गया". Johannes Gutenberg-Universität Mainz. June 22, 2012.</ref> और सेंटीपीड स्कुटिगेरा कोलोप्ट्राटा। इसके अलावा, कई कीड़ों में लार्वा भंडारण प्रोटीन हीमोसायनिन से प्राप्त होते प्रतीत होते हैं। रेफरी नाम = मोल्बेवा040129 >Beintema JJ, Stam WT, Hazes B, Smidt MP (May 1994). "आर्थ्रोपोड हेमोसाइनिन और कीट भंडारण प्रोटीन (हेक्सामेरिन) का विकास". Molecular Biology and Evolution. 11 (3): 493–503. doi:10.1093/oxfordjournals.molbev.a040129. PMID 8015442.</ref>
हेमोसाइनिन सुपरफ़ैमिली
आर्थ्रोपोड हेमोसायनिन सुपरफ़ैमिली (प्रोटीन) फिनोलॉक्सीडेज, हेक्सामेरिन, स्यूडोहेमोसायनिन या क्रिप्टोसायनिन और (डिप्टेरान) हेक्सामेरिन रिसेप्टर्स से बना है।[4] फेनोलॉक्सिडेज़ तांबे युक्त टायरोसिनेस हैं। ये प्रोटीन आर्थ्रोपोड क्यूटिकल के स्क्लेरोटाइजेशन की प्रक्रिया, घाव भरने और हास्य प्रतिरक्षा रक्षा में शामिल होते हैं। फेनोलॉक्सिडेज़ को ज़ाइमोजेन द्वारा संश्लेषित किया जाता है और एN- टर्मिनस |एन-टर्मिनल पेप्टाइड को साफ़ करके सक्रिय किया जाता है।[5] हेक्सामेरिन भंडारण प्रोटीन हैं जो आमतौर पर कीड़ों में पाए जाते हैं। ये प्रोटीन लार्वा वसा शरीर द्वारा संश्लेषित होते हैं और पिघलने के चक्र या पोषण संबंधी स्थितियों से जुड़े होते हैं।[6] स्यूडोहेमोसायनिन और क्रिप्टोसायनिन आनुवंशिक अनुक्रम क्रस्टेशियंस में हेमोसायनिन से निकटता से संबंधित हैं। इन प्रोटीनों की संरचना और कार्य समान होते हैं, लेकिन तांबे को बांधने वाली साइटों की कमी होती है।[7] हेमोसाइनिन सुपरफैमिली के फाइलोजेनी के भीतर विकासवादी परिवर्तन विभिन्न प्रजातियों में इन विभिन्न प्रोटीनों के उद्भव से निकटता से संबंधित हैं। इस सुपरफैमिली के भीतर प्रोटीन की समझ को आर्थ्रोपोड्स में हेमोसाइनिन के व्यापक अध्ययन के बिना अच्छी तरह से नहीं समझा जा सकता है।[8]
संरचना और तंत्र
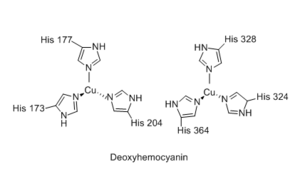
यद्यपि हीमोसायनिन का श्वसन कार्य हीमोग्लोबिन के समान है, लेकिन इसकी आणविक संरचना और तंत्र में महत्वपूर्ण अंतर हैं। जबकि हीमोग्लोबिन अपने लौह परमाणुओं को पॉरफाइरिन रिंग्स (हीम समूह) में ले जाता है, हेमोसाइनिन के तांबे के परमाणु हिस्टिडीन अवशेषों द्वारा समन्वित कृत्रिम समूहों के रूप में बंधे होते हैं। प्रत्येक हेमोसाइनिन मोनोमर छह हिस्टडीन अवशेषों के imidazole रिंगों के साथ बातचीत के माध्यम से तांबे (आई) धनायनों की एक जोड़ी रखता है।[9] यह देखा गया है कि ऑक्सीजन परिवहन के लिए हेमोसाइनिन का उपयोग करने वाली प्रजातियों में कम ऑक्सीजन दबाव वाले ठंडे वातावरण में रहने वाले क्रसटेशियन शामिल हैं। इन परिस्थितियों में हीमोग्लोबिन ऑक्सीजन परिवहन हीमोसाइनिन ऑक्सीजन परिवहन की तुलना में कम कुशल है।[10] फिर भी, हेमोसाइनिन का उपयोग करने वाले स्थलीय आर्थ्रोपोड भी हैं, विशेष रूप से मकड़ियों और बिच्छू, जो गर्म जलवायु में रहते हैं। अणु संरचनागत रूप से स्थिर है और 90 डिग्री सेल्सियस तक के तापमान पर पूरी तरह से कार्य करता है।[11] अधिकांश हीमोसायनिन ऑक्सीजन गैर-सहकारी बंधन से बंधते हैं और रक्त की प्रति मात्रा में ऑक्सीजन के परिवहन में हीमोग्लोबिन की तुलना में लगभग एक-चौथाई कुशल होते हैं। प्रोटीन कॉम्प्लेक्स में स्टेरिक प्रोटीन की तह परिवर्तनों के कारण हीमोग्लोबिन ऑक्सीजन को सहकारी रूप से बांधता है, जिससे आंशिक रूप से ऑक्सीजनित होने पर ऑक्सीजन के लिए हीमोग्लोबिन की आत्मीयता बढ़ जाती है। हॉर्सशू केकड़ों के कुछ हेमोसाइनिन और arthropods की कुछ अन्य प्रजातियों में, 1.6-3.0 के हिल गुणांक के साथ, सहकारी बंधन देखा जाता है। पहाड़ी गुणांक प्रजातियों और प्रयोगशाला माप सेटिंग्स के आधार पर भिन्न होते हैं। तुलना के लिए, हीमोग्लोबिन का हिल गुणांक आमतौर पर 2.8-3.0 होता है। सहकारी बाइंडिंग के इन मामलों में हेमोसाइनिन को 6 सबयूनिट (हेक्सामेर) के प्रोटीन उप-परिसरों में व्यवस्थित किया गया था, जिनमें से प्रत्येक में एक ऑक्सीजन बाइंडिंग साइट थी; परिसर में एक इकाई पर ऑक्सीजन बांधने से पड़ोसी इकाइयों की आत्मीयता बढ़ जाएगी। प्रत्येक हेक्सामेर कॉम्प्लेक्स को दर्जनों हेक्सामेरों का एक बड़ा कॉम्प्लेक्स बनाने के लिए एक साथ व्यवस्थित किया गया था। एक अध्ययन में, सहकारी बंधन को बड़े परिसर में एक साथ व्यवस्थित होने वाले हेक्सामर्स पर निर्भर पाया गया, जो हेक्सामर्स के बीच सहकारी बंधन का सुझाव देता है। हेमोसाइनिन ऑक्सीजन-बाध्यकारी प्रोफ़ाइल भी घुले हुए नमक आयन के स्तर और पीएच से प्रभावित होती है।[12] हेमोसायनिन कई व्यक्तिगत सबयूनिट प्रोटीन से बना होता है, जिनमें से प्रत्येक में दो तांबे के परमाणु होते हैं और एक ऑक्सीजन अणु (O) को बांध सकते हैं2). प्रत्येक सबयूनिट का वजन लगभग 75 डाल्टन (इकाई) (केडीए) होता है। प्रजातियों के आधार पर सबयूनिट्स को प्रोटीन डिमर या हेक्सामर्स में व्यवस्थित किया जा सकता है; डिमर या हेक्सामेर कॉम्प्लेक्स को इसी तरह 1500 केडीए से अधिक वजन वाली श्रृंखलाओं या समूहों में व्यवस्थित किया जाता है। उपइकाइयाँ आमतौर पर विक्षनरी: सजातीय, या दो भिन्न उपइकाई प्रकारों के साथ विषम होती हैं। हीमोसायनिन के बड़े आकार के कारण, यह आमतौर पर हीमोग्लोबिन के विपरीत, रक्त में मुक्त रूप से तैरता हुआ पाया जाता है।[13]
हेक्सामर्स आर्थ्रोपोड हेमोसाइनिन की विशेषता है।[15] टारेंटयुला यूरीपेल्मा कैलिफ़ोर्निकम का एक हेमोसाइनिन[3]4 हेक्सामर्स या 24 पेप्टाइड श्रृंखलाओं से बना है। हाउस सेंटीपीड स्कुटिगेरा कोलोप्ट्राटा से एक हेमोसाइनिन[16] 6 हेक्सामर्स या 36 श्रृंखलाओं से बना है। हॉर्सशू केकड़ों में 8-हेक्सामेर (यानी 48-श्रृंखला) हेमोसाइनिन होता है। सरल हेक्सामर्स स्पाइनी लॉबस्टर पैनुलिरस इंटरप्टस और आइसोपॉड बाथिनोमस गिगेंटस में पाए जाते हैं।[15]क्रस्टेशियंस में पेप्टाइड श्रृंखलाएं लगभग 660 अमीनो एसिड अवशेष लंबी होती हैं, और चीलीसेरेट्स में वे लगभग 625 होती हैं। बड़े परिसरों में विभिन्न प्रकार की श्रृंखलाएं होती हैं, सभी की लंबाई लगभग समान होती है; शुद्ध घटक आमतौर पर स्वयं-इकट्ठे नहीं होते हैं।[citation needed]
उत्प्रेरक गतिविधि
हेमोसाइनिन फिनोल ऑक्सीडेज (उदाहरण के लिए टायरोसिनेज़ ) का समजात है क्योंकि दोनों प्रोटीनों में हिस्टिडीन अवशेष होते हैं, जिन्हें टाइप 3 कॉपर-बाइंडिंग समन्वय केंद्र कहा जाता है, जैसे कि एंजाइम टायरोसिनेज और कैटेचोल ऑक्सीडेज होते हैं।[17] दोनों ही मामलों में एंजाइमों के निष्क्रिय अग्रदूतों (जिन्हें ज़ाइमोजेन या प्रोएंजाइम भी कहा जाता है) को पहले सक्रिय किया जाना चाहिए। यह अमीनो एसिड को हटाकर किया जाता है जो प्रोएंजाइम सक्रिय नहीं होने पर सक्रिय साइट पर प्रवेश चैनल को अवरुद्ध करता है। वर्तमान में प्रोएंजाइम को सक्रिय करने और उत्प्रेरक गतिविधि को सक्षम करने के लिए आवश्यक कोई अन्य ज्ञात संशोधन नहीं है। गठनात्मक_आइसोमेरिज्म अंतर उत्प्रेरक गतिविधि के प्रकार को निर्धारित करते हैं जो हेमोसाइनिन प्रदर्शन करने में सक्षम है।[18] हेमोसाइनिन भी फिनोल ऑक्सीडेज गतिविधि प्रदर्शित करता है, लेकिन सक्रिय स्थल पर अधिक स्टेरिक बल्क से धीमी गतिशीलता के साथ। आंशिक विकृतीकरण वास्तव में सक्रिय साइट तक अधिक पहुंच प्रदान करके हेमोसाइनिन की फिनोल ऑक्सीडेज गतिविधि में सुधार करता है।[1][17]
वर्णक्रमीय गुण

ऑक्सीहेमोसाइनिन की स्पेक्ट्रोस्कोपी कई मुख्य विशेषताएं दिखाती है:[19]# अनुनाद रमन स्पेक्ट्रोस्कोपी से पता चलता है कि O2 एक सममित वातावरण में बंधा हुआ है (ν(O-O) IR-अनुमति नहीं है)।
- ऑक्सीएचसी इलेक्ट्रॉन अनुचुंबकीय अनुनाद -साइलेंट है जो अयुग्मित इलेक्ट्रॉनों की अनुपस्थिति को दर्शाता है
- अवरक्त स्पेक्ट्रोस्कोपी 755 सेमी का ν(O-O) दिखाती है−1
हेमोसाइनिन की सक्रिय साइट के सिंथेटिक एनालॉग तैयार करने के लिए बहुत काम किया गया है।[19] ऐसा ही एक मॉडल, जिसमें पेरोक्सो लिगैंड द्वारा साइड-ऑन ब्रिज किए गए तांबे के केंद्रों की एक जोड़ी है, 741 सेमी पर ν(O-O) दिखाता है−1और 349 और 551 एनएम पर अवशोषण के साथ एक यूवी-विज़ स्पेक्ट्रम। ये दोनों माप ऑक्सीएचसी के प्रयोगात्मक अवलोकनों से सहमत हैं।[20] मॉडल कॉम्प्लेक्स में Cu-Cu पृथक्करण 3.56 Å है, ऑक्सीहेमोसायनिन का सीए है। 3.6 Å (डीऑक्सीएचसी: सीए. 4.6 Å)।[20][21][22]
कैंसररोधी प्रभाव
चिली के अबालोन, कोंचोलेपास कोंचोलेपास के रक्त में पाया जाने वाला हेमोसाइनिन, म्यूरिन मॉडल में मूत्राशय के कैंसर के खिलाफ प्रतिरक्षात्मक प्रभाव डालता है। मूत्राशय फोडा (एमबीटी-2) कोशिकाओं के आरोपण से पहले चूहों को सी. कोंचोलेपास से प्राइम किया गया। सी. कोंचोलेपास हेमोसाइनिन से उपचारित चूहों में ट्यूमररोधी प्रभाव दिखे: लंबे समय तक जीवित रहना, ट्यूमर की वृद्धि और घटना में कमी, और विषाक्त प्रभावों की कमी और सतही मूत्राशय के कैंसर के लिए भविष्य में इम्यूनोथेरेपी में इसका संभावित उपयोग हो सकता है।[23] कीहोल लिम्पेट हेमोसाइनिन (केएलएच) एक प्रतिरक्षा उत्तेजक है जो समुद्री मोलस्क मेगथुरा क्रेनुलता के ग्लाइकोप्रोटीन को प्रसारित करने से प्राप्त होता है। केएलएच को इन विट्रो में वितरित होने पर स्तन कैंसर, अग्न्याशय कैंसर और प्रोस्टेट कैंसर कोशिकाओं के प्रसार के खिलाफ एक महत्वपूर्ण उपचार के रूप में दिखाया गया है। कीहोल लिम्पेट हेमोसाइनिन कोशिका मृत्यु के एपोप्टिक और नॉनएपॉप्टिक दोनों तंत्रों के माध्यम से मानव बैरेट के एसोफैगल कैंसर के विकास को रोकता है।[24]
केस अध्ययन: हेमोसाइनिन स्तर पर पर्यावरणीय प्रभाव
2003 में सफेद झींगा लिटोपेनियस वन्नामेई के रक्त चयापचयों और हेमोसायनिन की संस्कृति स्थितियों के प्रभाव के एक अध्ययन में पाया गया कि हेमोसायनिन, विशेष रूप से ऑक्सीहेमोसायनिन का स्तर आहार से प्रभावित होता है। अध्ययन में वाणिज्यिक आहार के साथ एक इनडोर तालाब में रखे गए सफेद झींगा के रक्त में ऑक्सीहेमोसायनिन के स्तर की तुलना एक बाहरी तालाब में रखे गए सफेद झींगा के खून में अधिक आसानी से उपलब्ध प्रोटीन स्रोत (प्राकृतिक जीवित भोजन) के साथ की गई। बाहरी तालाबों में रहने वाले झींगा में ऑक्सीहेमोसाइनिन और रक्त शर्करा का स्तर अधिक था। यह भी पाया गया कि बाहरी झींगा की तुलना में केकड़ों, झींगा मछलियों और इनडोर झींगा जैसी कम गतिविधि स्तर वाली प्रजातियों में रक्त मेटाबोलाइट का स्तर कम होता है। यह सहसंबंध संभवतः क्रस्टेशियंस के रूपात्मक और शारीरिक विकास का संकेत है। इन रक्त प्रोटीनों और मेटाबोलाइट्स का स्तर उन ऊर्जा स्रोतों की ऊर्जावान मांगों और उपलब्धता पर निर्भर प्रतीत होता है।[25]
यह भी देखें
- अटलांटिक घोड़े की नाल केकड़ा#रक्त
- कीहोल लिम्पेट हेमोसाइनिन
- हीमोग्लोबिन
- Myoglobin
- श्वसन वर्णक
संदर्भ
- ↑ 1.0 1.1 Coates CJ, Nairn J (July 2014). "हेमोसाइनिन के विविध प्रतिरक्षा कार्य". Developmental and Comparative Immunology. 45 (1): 43–55. doi:10.1016/j.dci.2014.01.021. PMID 24486681.
- ↑ Ghiretti-Magaldi A, Ghiretti F (1992). "हेमोसाइनिन का पूर्व-इतिहास। मोलस्क के रक्त में तांबे की खोज". Experientia (in English). 48 (10): 971–972. doi:10.1007/BF01919143. ISSN 0014-4754. S2CID 33290596.
- ↑ 3.0 3.1 Voit R, Feldmaier-Fuchs G, Schweikardt T, Decker H, Burmester T (December 2000). "टारेंटयुला यूरीपेल्मा कैलिफ़ोर्निकम के 24-मेर हेमोसाइनिन का पूरा अनुक्रम। उपइकाइयों की संरचना और इंट्रामोल्युलर विकास". The Journal of Biological Chemistry. 275 (50): 39339–39344. doi:10.1074/jbc.M005442200. PMID 10961996.
- ↑ Burmester T (February 2002). "आर्थ्रोपॉड हेमोसाइनिन और संबंधित प्रोटीन की उत्पत्ति और विकास". Journal of Comparative Physiology B: Biochemical, Systemic, and Environmental Physiology. 172 (2): 95–107. doi:10.1007/s00360-001-0247-7. PMID 11916114. S2CID 26023927.
- ↑ Cerenius L, Söderhäll K (April 2004). "अकशेरुकी जीवों में प्रोफेनोलॉक्सीडेज-सक्रिय करने वाली प्रणाली". Immunological Reviews. 198 (1): 116–126. doi:10.1111/j.0105-2896.2004.00116.x. PMID 15199959. S2CID 10614298.
- ↑ Terwilliger NB (1999). "क्रस्टेशियंस और कीड़ों में हेमोलिम्फ प्रोटीन और मोल्टिंग". American Zoologist. 39 (3): 589–599. doi:10.1093/icb/39.3.589.
- ↑ Terwilliger NB, Dangott L, Ryan M (March 1999). "Cryptocyanin, a crustacean molting protein: evolutionary link with arthropod hemocyanins and insect hexamerins". Proceedings of the National Academy of Sciences of the United States of America. 96 (5): 2013–2018. Bibcode:1999PNAS...96.2013T. doi:10.1073/pnas.96.5.2013. PMC 26728. PMID 10051586.
- ↑ Burmester T (February 2001). "आर्थ्रोपॉड हेमोसाइनिन सुपरफैमिली का आणविक विकास". Molecular Biology and Evolution. 18 (2): 184–195. doi:10.1093/oxfordjournals.molbev.a003792. PMID 11158377.
- ↑ Rannulu NS, Rodgers MT (March 2005). "Solvation of copper ions by imidazole: structures and sequential binding energies of Cu+(imidazole)x, x = 1-4. Competition between ion solvation and hydrogen bonding". Physical Chemistry Chemical Physics. 7 (5): 1014–1025. Bibcode:2005PCCP....7.1014R. doi:10.1039/b418141g. PMID 19791394.
- ↑ Strobel A, Hu MY, Gutowska MA, Lieb B, Lucassen M, Melzner F, et al. (December 2012). "सामान्य कटलफिश सेपिया ऑफिसिनैलिस में विभिन्न हेमोसाइनिन आइसोफॉर्म की सापेक्ष अभिव्यक्ति पर तापमान, हाइपरकेनिया और विकास का प्रभाव" (PDF). Journal of Experimental Zoology. Part A, Ecological Genetics and Physiology. 317 (8): 511–523. doi:10.1002/jez.1743. PMID 22791630.
- ↑ Sterner R, Vogl T, Hinz HJ, Penz F, Hoff R, Föll R, Decker H (May 1995). "टारेंटयुला हेमोसाइनिन की अत्यधिक थर्मोस्टेबिलिटी". FEBS Letters. 364 (1): 9–12. doi:10.1016/0014-5793(95)00341-6. PMID 7750550.
- ↑ Perton FG, Beintema JJ, Decker H (May 1997). "पैनुलिरस इंटरप्टस हेमोसाइनिन के ऑक्सीजन बाइंडिंग व्यवहार पर एंटीबॉडी बाइंडिंग का प्रभाव". FEBS Letters. 408 (2): 124–126. doi:10.1016/S0014-5793(97)00269-X. PMID 9187351.
- ↑ Waxman L (May 1975). "आर्थ्रोपॉड और मोलस्क हेमोसाइनिन की संरचना". The Journal of Biological Chemistry. 250 (10): 3796–3806. doi:10.1016/S0021-9258(19)41469-5. PMID 1126935.
- ↑ Gai, Zuoqi; Matsuno, Asuka; Kato, Koji; Kato, Sanae; Khan, Md Rafiqul Islam; Shimizu, Takeshi; Yoshioka, Takeya; Kato, Yuki; Kishimura, Hideki; Kanno, Gaku; Miyabe, Yoshikatsu; Terada, Tohru; Tanaka, Yoshikazu; Yao, Min (2015). "Crystal Structure of the 3.8-MDa Respiratory Supermolecule Hemocyanin at 3.0 Å Resolution". Structure (in English). 23 (12): 2204–2212. doi:10.1016/j.str.2015.09.008.
- ↑ 15.0 15.1 van Holde KE, Miller KI (1995). "Hemocyanins". In Anfinsen CB, Richards FM, Edsall JT, Eisenberg DS (eds.). प्रोटीन रसायन विज्ञान में प्रगति. Vol. 47. Academic Press. pp. 1–81. doi:10.1016/S0065-3233(08)60545-8. ISBN 978-0-12-034247-1. PMID 8561049.
- ↑ Kusche K, Hembach A, Hagner-Holler S, Gebauer W, Burmester T (July 2003). "Complete subunit sequences, structure and evolution of the 6 x 6-mer hemocyanin from the common house centipede, Scutigera coleoptrata". European Journal of Biochemistry. 270 (13): 2860–2868. doi:10.1046/j.1432-1033.2003.03664.x. PMID 12823556.
- ↑ 17.0 17.1 Decker H, Tuczek F (August 2000). "Tyrosinase/catecholoxidase activity of hemocyanins: structural basis and molecular mechanism". Trends in Biochemical Sciences. 25 (8): 392–397. doi:10.1016/S0968-0004(00)01602-9. PMID 10916160.
- ↑ Decker H, Schweikardt T, Nillius D, Salzbrunn U, Jaenicke E, Tuczek F (August 2007). "हेमोसायनिन और टायरोसिनेस में समान एंजाइम सक्रियण और उत्प्रेरण". Gene. 398 (1–2): 183–191. doi:10.1016/j.gene.2007.02.051. PMID 17566671.
- ↑ 19.0 19.1 Elwell CE, Gagnon NL, Neisen BD, Dhar D, Spaeth AD, Yee GM, Tolman WB (February 2017). "Copper-Oxygen Complexes Revisited: Structures, Spectroscopy, and Reactivity". Chemical Reviews. 117 (3): 2059–2107. doi:10.1021/acs.chemrev.6b00636. PMC 5963733. PMID 28103018.
- ↑ 20.0 20.1 Kitajima N, Fujisawa K, Fujimoto C, Morooka Y, Hashimoto S, Kitagawa T, et al. (1992). "A new model for dioxygen binding in hemocyanin. Synthesis, characterization, and molecular structure of the μ-η2:η2 peroxo dinuclear copper(II) complexes, [Cu(BH(3,5-R2pz)3)]2(O2) (R = i-Pr and Ph)". Journal of the American Chemical Society. 114 (4): 1277–91. doi:10.1021/ja00030a025.
- ↑ Gaykema WP, Hol WG, Vereijken JM, Soeter NM, Bak HJ, Beintema JJ (1984). "3.2 Å structure of the copper-containing, oxygen-carrying protein Panulirus interruptus haemocyanin". Nature. 309 (5963): 23–9. Bibcode:1984Natur.309...23G. doi:10.1038/309023a0. S2CID 4260701.
- ↑ Kodera M, Katayama K, Tachi Y, Kano K, Hirota S, Fujinami S, et al. (1999). "Crystal Structure and Reversible O2-Binding of a Room Temperature Stable μ-η2:η2-Peroxodicopper(II) Complex of a Sterically Hindered Hexapyridine Dinucleating Ligand". Journal of the American Chemical Society. 121 (47): 11006–7. doi:10.1021/ja992295q.
- ↑ Atala A (2006). "खोजी मूत्रविज्ञान में यह महीना". The Journal of Urology. 176 (6): 2335–6. doi:10.1016/j.juro.2006.09.002.
- ↑ McFadden DW, Riggs DR, Jackson BJ, Vona-Davis L (November 2003). "कीहोल लिम्पेट हेमोसाइनिन, बैरेट के एसोफेजियल एडेनोकार्सिनोमा में आशाजनक कैंसर विरोधी गतिविधि के साथ एक नया प्रतिरक्षा उत्तेजक". American Journal of Surgery. 186 (5): 552–555. doi:10.1016/j.amjsurg.2003.08.002. PMID 14599624.
- ↑ Pascual C, Gaxiola G, Rosas C (2003). "सफेद झींगा के रक्त मेटाबोलाइट्स और हेमोसाइनिन, लिटोपेनियस वन्नामेई: संस्कृति स्थितियों का प्रभाव और अन्य क्रस्टेशियन प्रजातियों के साथ तुलना". Marine Biology. 142 (4): 735–745. doi:10.1007/s00227-002-0995-2. S2CID 82961592.
अग्रिम पठन
- Rehm P, Pick C, Borner J, Markl J, Burmester T (February 2012). "The diversity and evolution of chelicerate hemocyanins". BMC Evolutionary Biology. 12: 19. doi:10.1186/1471-2148-12-19. PMC 3306762. PMID 22333134.
- Ali SA, Abbasi A (2011). Scorpion Hemocyanin: The blue blood. Saarbrücken: VDM Verlag Dr. Müller. p. 160. ISBN 978-3-639-33725-9.
बाहरी संबंध
- 3D hemocyanin structures in the EM Data Bank (EMDB)
- Overview of all the structural information available in the PDB for UniProt: P04253 (Hemocyanin II) at the PDBe-KB.