बिजली उत्पन्न करनेवाली सेल
एक वैद्युत सेल या वोल्टाइक (वैद्युत) सेल, जिसका नाम क्रमशः वैज्ञानिक लुइगी गलवानी और अलेक्जेंडर वोल्टा के नाम पर रखा गया है, एक विद्युत रासायनिक सेल है जिसमें सहज प्रतिक्रिया ऑक्सीकरण-कमी प्रतिक्रियाओं से एक विद्युत प्रवाह उत्पन्न होता है। एक सामान्य उपकरण में सामान्यतः दो अलग-अलग धातुएं होती हैं, प्रत्येक को अलग-अलग चषक में डुबोया जाता है जिसमें उनके संबंधित धातु आयन होते हैं जो एक लवण सेतु से जुड़े होते हैं या एक संरध्र झिल्ली से असंसक्त होते हैं।[1]
वोल्टा पहली विद्युत बैटरी, वोल्टीय पुंज का आविष्कारक था। सामान्य उपयोग में, "बैटरी" शब्द में एक एकल विद्युत सेल सम्मिलित हो गया है, लेकिन एक बैटरी में कई सेल सम्मिलित हैं।[2]
इतिहास
1780 में, लुइगी गलवानी ने पता लगाया कि जब दो अलग-अलग धातुएं (जैसे, तांबा और जस्ता) संपर्क में होती हैं और फिर दोनों को एक ही समय में एक मेंढक के पैर की मांसपेशियों के दो अलग-अलग हिस्सों से स्पर्श किया जाता है, परिपथ को बंद करने के लिए, मेंढक का पैर ठेके।[3] उन्होंने इसे bioelectricity कहा। मेंढक का पैर, साथ ही विद्युत प्रवाह का एक डिटेक्टर होने के नाते, इलेक्ट्रोलाइट (आधुनिक रसायन विज्ञान की भाषा का उपयोग करने के लिए) भी था।
गलवानी द्वारा अपना काम (1790) प्रकाशित करने के एक साल बाद, एलेसेंड्रो वोल्टा ने दिखाया कि मेंढक आवश्यक नहीं था, इसके बजाय एक बल-आधारित डिटेक्टर और नमकीन-भिगोने वाले कागज (इलेक्ट्रोलाइट के रूप में) का उपयोग कर रहा था। (पहले वोल्टा ने समाई का नियम स्थापित किया था C = Q/V बल-आधारित डिटेक्टरों के साथ)। 1799 में वोल्टा ने वोल्टाइक पाइल का आविष्कार किया, जो वैद्युत कोशिकाओं का एक ढेर है, जिसमें प्रत्येक में एक धातु डिस्क, एक इलेक्ट्रोलाइट परत और एक अलग धातु की डिस्क होती है। उन्होंने गैलवानी (और बाद के प्रयोगकर्ता लियोपोल्डो नोबिली ) के पशु विद्युत सिद्धांत को अपने स्वयं के धातु-धातु संपर्क बिजली सिद्धांत के पक्ष में चुनौती देने के लिए इसे पूरी तरह से गैर-जैविक सामग्री से बनाया था।[4] वोल्टा के जवाब में कार्लो मैटटुची ने अपनी बारी में एक मेंढक बैटरी का निर्माण किया।[5] वोल्टा का संपर्क विद्युत दृश्य प्रत्येक इलेक्ट्रोड को एक संख्या के साथ चित्रित करता है जिसे अब हम इलेक्ट्रोड का कार्य कार्य कहेंगे। इस दृश्य ने इलेक्ट्रोड-इलेक्ट्रोलाइट इंटरफेस पर रासायनिक प्रतिक्रियाओं को नजरअंदाज कर दिया, जिसमें नींबू बैटरी सम्मिलित है। एच2 वोल्टा के ढेर में अधिक महान धातु पर गठन।
हालाँकि वोल्टा बैटरी या वैद्युत सेल के संचालन को नहीं समझ पाया, लेकिन इन खोजों ने विद्युत बैटरी के लिए मार्ग प्रशस्त किया; वोल्टा के सेल को 1999 में IEEE मील के पत्थर की सूची में नामित किया गया था।[6] कुछ चालीस साल बाद, फैराडे (देखें फैराडे के इलेक्ट्रोलिसिस के नियम) ने दिखाया कि वैद्युत सेल - जिसे अक्सर वोल्टाइक सेल कहा जाता है - प्रकृति में रासायनिक था। फैराडे ने रसायन विज्ञान की भाषा में नई शब्दावली पेश की: इलेक्ट्रोड (कैथोड और एनोड ), इलेक्ट्रोलाइट, और आयन (कटियन और आयन)। इस प्रकार गैलवानी ने गलत तरीके से सोचा कि बिजली का स्रोत (या वैद्युतवाहक बल (ईएमएफ) का स्रोत, या ईएमएफ की सीट) जानवर में था, वोल्टा ने गलत तरीके से सोचा कि यह पृथक इलेक्ट्रोड के भौतिक गुणों में था, लेकिन फैराडे ने ईएमएफ के स्रोत की सही पहचान की दो इलेक्ट्रोड-इलेक्ट्रोलाइट इंटरफेस पर रासायनिक प्रतिक्रियाओं के रूप में। वोल्टाइक सेल के बौद्धिक इतिहास पर आधिकारिक कार्य ओस्टवाल्ड द्वारा किया गया है।[7] 1940 में विल्हेम कोनिग द्वारा यह सुझाव दिया गया था कि बगदाद बैटरी के रूप में जानी जाने वाली वस्तु प्राचीन पार्थिया से वैद्युत सेल तकनीक का प्रतिनिधित्व कर सकती है। साइट्रिक एसिड या अंगूर के रस से भरे प्रतिकृतियों को वोल्टेज उत्पन्न करने के लिए दिखाया गया है। हालांकि, यह निश्चित नहीं है कि यह इसका उद्देश्य था - अन्य विद्वानों ने बताया है कि यह चर्मपत्र स्क्रॉल को संग्रहीत करने के लिए उपयोग किए जाने वाले बर्तनों के समान है।[8]
सिद्धांत
वैद्युत कोशिकाएं स्वतःस्फूर्त रेडॉक्स प्रतिक्रियाओं के विस्तार हैं, लेकिन केवल उक्त प्रतिक्रिया से उत्पन्न ऊर्जा का उपयोग करने के लिए अभिकल्पित की गई हैं।[1]उदाहरण के लिए, जब कोई जिंक धातु (Zn) की एक पट्टी को कॉपर सल्फेट (CuSO4) के जलीय घोल में डुबाता है।4), गहरे रंग के ठोस जमा जस्ता धातु की सतह और Cu के नीले रंग की विशेषता पर एकत्रित होंगे2+ विलयन से आयन गायब हो जाता है। जस्ता धातु की सतह पर जमाव तांबे की धातु से बना होता है, और समाधान में अब जस्ता आयन होते हैं। इस अभिक्रिया को प्रदर्शित करते हैं
- जेएन (एस) + क्यू2+ (aq) → Zn2+ (एक्यू) + सीयू (एस)
इस रेडॉक्स प्रतिक्रिया में, Zn को Zn में ऑक्सीकृत किया जाता है2+ और Cu2+ को घटाकर Cu कर दिया गया है। जब इलेक्ट्रॉनों को सीधे Zn से Cu में स्थानांतरित किया जाता है2+ , प्रतिक्रिया की तापीय धारिता गर्मी के रूप में परिवेश में खो जाती है। हालांकि, एक वैद्युत सेल में एक ही प्रतिक्रिया की जा सकती है, जिससे कुछ रासायनिक ऊर्जा को विद्युत ऊर्जा में परिवर्तित किया जा सकता है। अपने सरलतम रूप में, एक अर्ध-सेल में एक ठोस धातु (इलेक्ट्रोड कहा जाता है) होता है जो एक समाधान में डूबा हुआ होता है; समाधान में इलेक्ट्रोड धातु के धनायन (+) और धनायनों के आवेश को संतुलित करने के लिए ऋणायन (-) होते हैं।[9] पूर्ण सेल में दो अर्ध-कोशिकाएँ होती हैं, जो आमतौर पर एक अर्ध-पारगम्य झिल्ली या एक नमक पुल से जुड़ी होती हैं जो अधिक महान धातु के आयनों को दूसरे इलेक्ट्रोड पर चढ़ाने से रोकती हैं।[9]
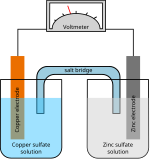
एक विशिष्ट उदाहरण डेनियल सेल (चित्र देखें) है, जिसमें जस्ता (Zn) आधा सेल है जिसमें ZnSO का घोल है।4 (जिंक सल्फेट) और एक ताँबा (Cu) आधा सेल जिसमें CuSO का घोल है4 (कॉपर सल्फेट)। विद्युत परिपथ को पूरा करने के लिए यहां एक नमक पुल का उपयोग किया जाता है।
यदि एक बाहरी विद्युत कंडक्टर तांबे और जस्ता इलेक्ट्रोड को जोड़ता है, तो जस्ता इलेक्ट्रोड से जस्ता Zn के रूप में विलयन में घुल जाता है2+ आयन (ऑक्सीकरण), बाहरी चालक में प्रवेश करने वाले इलेक्ट्रॉनों को मुक्त करना। बढ़ी हुई जस्ता आयन सांद्रता की भरपाई करने के लिए, नमक पुल के माध्यम से जस्ता आयन निकल जाते हैं और आयन जस्ता अर्ध-कोशिका में प्रवेश करते हैं। तांबे के आधे सेल में, तांबे के इलेक्ट्रोड पर तांबा आयन प्लेट (कमी), बाहरी कंडक्टर को छोड़ने वाले इलेक्ट्रॉनों को लेते हैं। क्यू के बाद से2+ आयनों (धनायनों) प्लेट को तांबे के इलेक्ट्रोड पर, बाद वाले को कैथोड कहा जाता है। इसके अनुरूप जिंक इलेक्ट्रोड एनोड है। विद्युत रासायनिक प्रतिक्रिया है
यह वही प्रतिक्रिया है जो पिछले उदाहरण में दी गई है। इसके अलावा, बाहरी कंडक्टर के माध्यम से इलेक्ट्रॉन प्रवाहित होते हैं, जो वैद्युत सेल का प्राथमिक अनुप्रयोग है।
जैसा कि सेल वोल्टेज के तहत चर्चा की गई है, सेल का इलेक्ट्रोमोटिव बल अर्ध-सेल क्षमता का अंतर है, इलेक्ट्रोलाइट में दो इलेक्ट्रोड के विघटन की सापेक्ष आसानी का एक उपाय है। ईएमएफ इलेक्ट्रोड और इलेक्ट्रोलाइट दोनों पर निर्भर करता है, यह एक संकेत है कि ईएमएफ प्रकृति में रासायनिक है।
आधी प्रतिक्रियाएँ और रूढ़ियाँ
एक अर्ध-कोशिका में एक धातु दो ऑक्सीकरण अवस्था ओं में होती है। एक पृथक अर्ध-कोशिका के अंदर, एक रेडोक्स | ऑक्सीकरण-कमी (रेडॉक्स) प्रतिक्रिया होती है जो रासायनिक संतुलन में होती है, प्रतीकात्मक रूप से निम्नानुसार लिखी गई स्थिति (यहाँ, एम एक धातु केशन का प्रतिनिधित्व करता है, एक परमाणु जिसके कारण आवेश असंतुलन होता है एन इलेक्ट्रॉनों की हानि):
- एमn+</super> (ऑक्सीडाइज़्ड प्रजाति) + नाम-</सुप> ⇌ एम (कम प्रजातियां)
एक वैद्युत सेल में दो आधे सेल होते हैं, जैसे कि एक आधे सेल का इलेक्ट्रोड धातु A से बना होता है, और दूसरे आधे सेल का इलेक्ट्रोड धातु B से बना होता है; दो अलग-अलग अर्ध-कोशिकाओं के लिए रेडॉक्स प्रतिक्रियाएं इस प्रकार हैं:
- एएन+ + नहीं-</सुप> ⇌ ए
- बीएम+ + मी-</सुप> ⇌ बी
समग्र संतुलित प्रतिक्रिया है:
- एम ए + एन बीएम+ ⇌ एन बी + एम एएन+
दूसरे शब्दों में, एक आधे सेल के धातु परमाणु ऑक्सीकृत होते हैं जबकि दूसरे आधे सेल के धातु के धनायन कम हो जाते हैं। धातुओं को दो अर्ध-कोशिकाओं में अलग करके, उनकी प्रतिक्रिया को इस तरह से नियंत्रित किया जा सकता है कि बाहरी परिपथ के माध्यम से इलेक्ट्रॉनों के हस्तांतरण को मजबूर किया जा सके जहां वे उपयोगी कार्य (भौतिकी) कर सकें।
- प्रतिक्रिया में भाग लेने वाले इलेक्ट्रॉनों का संचालन करने के लिए विद्युत चालन के क्रम में इलेक्ट्रोड धातु के तार से जुड़े होते हैं।
- एक अर्ध-सेल में, घुलित धातु-बी धनायन उन मुक्त इलेक्ट्रॉनों के साथ संयोजित होते हैं जो विलयन और धातु-बी इलेक्ट्रोड के बीच अंतरापृष्ठ पर उपलब्ध होते हैं; इस प्रकार इन धनायनों को निष्प्रभावी कर दिया जाता है, जिससे धातु-बी इलेक्ट्रोड पर जमा के रूप में विलयन से अवक्षेपण (रसायन विज्ञान) हो जाता है, एक प्रक्रिया जिसे चढ़ाना कहा जाता है।
- यह कमी प्रतिक्रिया धातु-बी इलेक्ट्रोड, तार, और धातु-ए इलेक्ट्रोड में मुक्त इलेक्ट्रॉनों को धातु-बी इलेक्ट्रोड में खींचने का कारण बनती है। नतीजतन, इलेक्ट्रॉनों को धातु-ए इलेक्ट्रोड के कुछ परमाणुओं से दूर कर दिया जाता है, जैसे कि धातु-बी केशन उनके साथ सीधे प्रतिक्रिया कर रहे थे; वे धातु-ए परमाणु धनायन बन जाते हैं जो आसपास के घोल में घुल जाते हैं।
- जैसे-जैसे यह प्रतिक्रिया जारी रहती है, धातु-A इलेक्ट्रोड के साथ अर्ध-सेल एक सकारात्मक रूप से आवेशित विलयन विकसित करता है (क्योंकि धातु-A धनायन इसमें घुल जाते हैं), जबकि अन्य अर्ध-सेल ऋणात्मक रूप से आवेशित विलयन विकसित करता है (क्योंकि धातु-B इसमें से धनायन अवक्षेपित होते हैं, ऋणायनों को पीछे छोड़ते हुए); बेरोकटोक, यह असंतुलन प्रभारी प्रतिक्रिया को रोक देगा। अर्ध-कोशिकाओं के विलयन एक लवण सेतु या झरझरा प्लेट से जुड़े होते हैं जो आयनों को एक विलयन से दूसरे विलयन में जाने की अनुमति देता है, जो विलयनों के आवेशों को संतुलित करता है और प्रतिक्रिया को जारी रखने की अनुमति देता है।
परिभाषा से:
- एनोड इलेक्ट्रोड है जहां ऑक्सीकरण (इलेक्ट्रॉनों का नुकसान) होता है (धातु-ए इलेक्ट्रोड); एक वैद्युत सेल में, यह नकारात्मक इलेक्ट्रोड है, क्योंकि जब ऑक्सीकरण होता है, तो इलेक्ट्रोड पर इलेक्ट्रॉन पीछे रह जाते हैं।[10] ये इलेक्ट्रॉन तब बाहरी परिपथ के माध्यम से कैथोड (पॉजिटिव इलेक्ट्रोड) में प्रवाहित होते हैं (जबकि इलेक्ट्रोलिसिस में, एक विद्युत धारा इलेक्ट्रॉन प्रवाह को विपरीत दिशा में चलाती है और एनोड पॉजिटिव इलेक्ट्रोड है)।
- कैथोड इलेक्ट्रोड है जहां कमी (इलेक्ट्रॉनों का लाभ) होता है (धातु-बी इलेक्ट्रोड); एक वैद्युत सेल में, यह सकारात्मक इलेक्ट्रोड है, क्योंकि इलेक्ट्रोड और प्लेट से इलेक्ट्रॉनों को लेने से आयन कम हो जाते हैं (जबकि इलेक्ट्रोलिसिस में, कैथोड नकारात्मक टर्मिनल होता है और समाधान से सकारात्मक आयनों को आकर्षित करता है)। दोनों ही मामलों में, कथन 'बिल्लीहोड बिल्लीआयनों को आकर्षित करता है' सत्य है।
वैद्युत कोशिकाएं, उनके स्वभाव से, प्रत्यक्ष धारा उत्पन्न करती हैं। वेस्टन सेल में कैडमियम मरकरी (तत्व) अमलगम (रसायन विज्ञान) से बना एनोड और शुद्ध पारा से बना कैथोड होता है। इलेक्ट्रोलाइट कैडमियम सल्फेट का (संतृप्त) घोल है। विध्रुवण मरक्यूरस सल्फेट का पेस्ट है। जब इलेक्ट्रोलाइट समाधान संतृप्त होता है, तो सेल का वोल्टेज बहुत प्रतिलिपि प्रस्तुत करने योग्य होता है; इसलिए, 1911 में, इसे वोल्टेज के लिए एक अंतरराष्ट्रीय मानक के रूप में अपनाया गया था।
एक बैटरी वैद्युत कोशिकाओं का एक समूह है जो एक साथ जुड़े हुए हैं और वोल्टेज का एक स्रोत बनाते हैं। उदाहरण के लिए, एक विशिष्ट 12V लेड-एसिड बैटरी में छह वैद्युत सेल श्रृंखला परिपथ से जुड़े होते हैं। सीरीज़ में लेड से बने एनोड और लेड डाइऑक्साइड से बने कैथोड होते हैं, दोनों सल्फ्यूरिक एसिड में डूबे होते हैं। उदाहरण के लिए, एक टेलिफ़ोन एक्सचेंज में बड़े बैटरी कक्ष , जो उपयोगकर्ता के टेलीफोन को केंद्रीय कार्यालय की शक्ति प्रदान करते हैं, में श्रृंखला और समानांतर दोनों में जुड़े सेल हो सकते हैं।
सेल वोल्टेज
वोल्टेज (इलेक्ट्रोमोटिव बल ईo) एक वैद्युत सेल द्वारा उत्पादित मानक गिब्स मुक्त ऊर्जा परिवर्तन के अनुसार विद्युत रासायनिक प्रतिक्रिया में अनुमान लगाया जा सकता है:
उदाहरण के लिए, उपरोक्त चित्र में समाधान CuSO हैं4 और ZnSO4. प्रत्येक घोल में एक धातु की पट्टी होती है, और एक नमक पुल या झरझरा डिस्क दो समाधानों को जोड़ती है और अनुमति देती है SO2−
4 आयन तांबे और जस्ता समाधान के बीच स्वतंत्र रूप से प्रवाहित होते हैं। मानक क्षमता की गणना करने के लिए कॉपर और जिंक की आधी प्रतिक्रियाओं को देखता है और पाता है:
- घन2+ + 2
e−
⇌ साथ में Eओ = +0.34 वी - टिकट2+ + 2
e−
⇌ Zn Eओ</सुप> = -0.76 वी
इस प्रकार समग्र प्रतिक्रिया है:
- घन2+ + Zn ⇌ क्यू + जेएन2+
प्रतिक्रिया के लिए मानक क्षमता तब +0.34 वी - (−0.76 वी) = 1.10 वी है। सेल की ध्रुवीयता निम्नानुसार निर्धारित की जाती है। कॉपर धातु की तुलना में जिंक धातु अधिक मजबूती से कम हो रही है क्योंकि जिंक के लिए मानक (कमी) क्षमता तांबे की तुलना में अधिक नकारात्मक है। इस प्रकार, जस्ता धातु तांबे के आयनों को इलेक्ट्रॉनों को खो देगी और एक सकारात्मक विद्युत आवेश विकसित करेगी। सेल के लिए संतुलन स्थिरांक, K, द्वारा दिया गया है:
2.303 का मानR/F है 1.9845×10−4 V/K, इसलिए 25 °C (298.15 K) पर अर्ध-सेल क्षमता केवल 0.05918 V/ν से बदल जाएगीe यदि किसी धातु आयन की सान्द्रता को 10 के गुणक से बढ़ाया या घटाया जाता है।
बिजली उत्पन्न करनेवाली जंग
वैद्युत जंग धातुओं का विद्युत रासायनिक क्षरण है। संक्षारण तब होता है जब दो अलग-अलग धातुएँ एक इलेक्ट्रोलाइट की उपस्थिति में एक दूसरे के संपर्क में होती हैं, जैसे कि नमक का पानी। यह एक वैद्युत सेल बनाता है, जिसमें अधिक उत्कृष्ट (कम सक्रिय) धातु पर हाइड्रोजन गैस बनती है। परिणामी विद्युत रासायनिक क्षमता तब एक विद्युत प्रवाह विकसित करती है जो इलेक्ट्रोलाइटिक रूप से कम महान सामग्री को भंग कर देती है। एक ही धातु इलेक्ट्रोलाइट के दो अलग-अलग सांद्रता के संपर्क में आने पर एक सांद्रता सेल का गठन किया जा सकता है।
प्रकार
- एकाग्रता सेल
- इलेक्ट्रोलाइटिक सेल
- इलेक्ट्रोकेमिकल सेल
- नींबू की बैटरी
- थर्मोवैद्युत सेल
यह भी देखें
- बायोइलेक्ट्रॉनिक रिएक्टर
- विराम विभव
- जैव-नैनो जनरेटर
- सेल नोटेशन
- डीसल्फेशन
- इलेक्ट्रोकेमिकल इंजीनियरिंग
- इलेक्ट्रोड क्षमता
- इलेक्ट्रोहाइड्रोजेनेसिस
- इलेक्ट्रोसिंथेसिस
- एंजाइमैटिक बायोफ्यूल सेल
- बिजली उत्पन्न करनेवाली श्रृंखला
- आइसोटोप इलेक्ट्रोकैमिस्ट्री
- बैटरी प्रकारों की सूची
- बलिदान एनोड
संदर्भ
- ↑ 1.0 1.1 McMurry, John; Fay, Robert C.; Robinson, Jill K. (2015). रसायन विज्ञान (7th ed.). Boston: Pearson. p. 762. ISBN 978-0-321-94317-0. OCLC 889577526.
- ↑ "battery" (def. 4b), Merriam-Webster Online Dictionary (2008). Retrieved 6 August 2008.
- ↑ Keithley, Joseph F (1999). Daniell Cell. John Wiley and Sons. pp. 49–51. ISBN 978-0-7803-1193-0.
- ↑ Kipnis, Nahum (2003) "Changing a theory: the case of Volta's contact electricity", Nuova Voltiana, Vol. 5. Università degli studi di Pavia, 2003 ISBN 88-203-3273-6. pp. 144–146
- ↑ Clarke, Edwin; Jacyna, L. S. (1992) Nineteenth-Century Origins of Neuroscientific Concepts, University of California Press. ISBN 0-520-07879-9. p. 199
- ↑ "Milestones:Volta's Electrical Battery Invention, 1799". IEEE Global History Network. IEEE. Retrieved 26 July 2011.
- ↑ Ostwald, Wilhelm (1980). Electrochemistry: History and Theory.
- ↑ Haughton, Brian (2007) Hidden History: Lost Civilizations, Secret Knowledge, and Ancient Mysteries. Career Press. ISBN 1564148971. pp. 129–132
- ↑ 9.0 9.1 Petrucci, Ralph H.; Herring, F. Geoffrey; Madura, Jeffry D.; Bissonnette, Carey (2017). General chemistry: principles and modern applications (11th ed.). Toronto: Pearson. p. 869. ISBN 978-0-13-293128-1. OCLC 951078429.
- ↑ "An introduction to redox equilibria". Chemguide. Retrieved 20 July 2014.
- ↑ Atkins, P.; de Paula, J. (2006). Physical Chemistry (8th ed.). Oxford University Press. ISBN 978-0-19-870072-2. Chapter 7, sections on "Equilibrium electrochemistry"
- ↑ Atkins, P.; de Paula, J. (2006). Physical Chemistry (8th ed.). Oxford University Press. ISBN 978-0-19-870072-2. Section 25.12 "Working Galvanic cells"
बाहरी कड़ियाँ
- How to build a galvanic cell battery from MiniScience.com
- Galvanic Cell, an animation
- Interactive animation of Galvanic Cell. Chemical Education Research Group, Iowa State University.
- Electron transfer reactions and redox potentials in GALVANIc cells - what happens to the ions at the phase boundary (NERNST, FARADAY) (Video by SciFox on TIB AV-Portal)