न्यूक्लियोसाइड फॉस्फोरैमिडाइट
न्यूक्लीओसाइड फॉस्फोरामाइडाइट प्राकृतिक या सिंथेटिक न्यूक्लियोसाइड के डेरिवेटिव हैं। फॉस्फोरामिडाइट्स प्राकृतिक या सिंथेटिक न्यूक्लियोसाइड के व्युत्पन्न हैं। उनका उपयोग ऑलिगोन्यूक्लियोटाइड्स, न्यूक्लिक एसिड के अपेक्षाकृत छोटे टुकड़े और उनके एनालॉग्स को संश्लेषित करने के लिए किया जाता है। न्यूक्लियोसाइड फॉस्फोरामिडाइट्स को पहली बार 1981 में ब्यूकेज और कारुथर्स द्वारा पेश किया गया था।[1] अवांछित साइड प्रतिक्रियाओं से बचने के लिए, प्राकृतिक या सिंथेटिक न्यूक्लियोसाइड में उपस्थित प्रतिक्रियाशील हाइड्रॉक्सी और एक्सोसाइक्लिक अमीनो समूहों को उचित रूप से संरक्षित किया जाता है। जब तक न्यूक्लियोसाइड एनालॉग में कम से कम एक हाइड्रॉक्सी समूह होता है, उचित सुरक्षा रणनीति का उपयोग किसी को संबंधित फॉस्फोरामिडाइट में परिवर्तित करने और बाद वाले को सिंथेटिक न्यूक्लिक एसिड में सम्मिलित करने की अनुमति देता है। फॉस्फोरामिडाइट रणनीति का उपयोग करके ऑलिगोन्यूक्लियोटाइड श्रृंखला के बीच में सम्मिलित होने के लिए, न्यूक्लियोसाइड एनालॉग में दो हाइड्रॉक्सी समूह या, कम प्रायः एक हाइड्रॉक्सी समूह और एक अन्य न्यूक्लियोफिलिक समूह (एमिनो या मर्कैप्टो) होना चाहिए। उदाहरणों में वैकल्पिक न्यूक्लियोटाइड, एलएनए, मॉर्फोलिनो, 2'-स्थिति (OMe, संरक्षित NH2, F) में संशोधित न्यूक्लियोसाइड, गैर-विहित आधार वाले न्यूक्लियोसाइड (प्राकृतिक न्यूक्लियोसाइड इनोसिन और ज़ैंथोसिन में निहित हाइपोक्सैन्थिन और ज़ैन्थिन) सम्मिलित हैं, लेकिन इन्हीं तक सीमित नहीं हैं। , क्रमशः ट्राइसाइक्लिक बेस जैसे G-क्लैंप, आदि)[2] या फ्लोरोसेंट समूह या लिंकर आर्म के साथ व्युत्पन्न आधार है।
तैयारी
न्यूक्लियोसाइड फॉस्फोरामिडाइट्स की तैयारी के लिए तीन मुख्य विधियाँ हैं।
- सामान्य विधि में एक कमजोर एसिड की उत्प्रेरक क्रिया के तहत फॉस्फोरामिडाइट के साथ एक एकल मुक्त हाइड्रॉक्सी समूह वाले संरक्षित न्यूक्लियोसाइड का उपचार सम्मिलित होता है।[3][4] हालाँकि कुछ बिसामिडाइट्स को थर्मल रूप से अस्थिर यौगिकों के रूप में रिपोर्ट किया गया था,[5] 2-साइनोइथाइल N,N,N',N'-टेट्राइसोप्रोपाइलफॉस्फोरोडायमिडाइट, वाणिज्यिक न्यूक्लियोसाइड फॉस्फोरामिडाइट्स तैयार करने के लिए इस्तेमाल किया जाने वाला एमिडाइट अपेक्षाकृत स्थिर है। इसे दो-चरण, एक-पॉट प्रक्रिया का उपयोग करके संश्लेषित किया जा सकता है और वैक्यूम आसवन द्वारा शुद्ध किया जा सकता है।[6] एक उत्कृष्ट समीक्षा में न्यूक्लियोसाइड और गैर-न्यूक्लियोसाइड फॉस्फोरामिडाइट्स की तैयारी में बाद वाले अभिकर्मक के उपयोग की विस्तृत जानकारी दी गई है।[7]
- दूसरी विधि में, संरक्षित न्यूक्लियोसाइड को कार्बनिक आधार की उपस्थिति में फॉस्फोरोक्लोराइड के साथ इलाज किया जाता है, जो साधारणतया N-एथिल-N, N-डायसोप्रोपाइलामाइन (हुनिग का आधार) होता है।[8]
- तीसरी विधि में,[9] संरक्षित न्यूक्लियोसाइड को पहले कार्बनिक आधार की उपस्थिति में क्लोरो N,N,N',N'-टेट्राइसोप्रोपाइल फॉस्फोरोडायमिडाइट के साथ इलाज किया जाता है, साधारणतया N-एथिल-N, N-डायसोप्रोपाइलामाइन (हुनिग का आधार) ) एक संरक्षित न्यूक्लियोसाइड डायमिडाइट बनाने के लिए। उत्तरार्द्ध को कमजोर एसिड की उपस्थिति में वांछित फॉस्फाइट सुरक्षा समूह से संबंधित अल्कोहल के साथ इलाज किया जाता है, उदाहरण के लिए, 2-साइनोएथेनॉल है।
न्यूक्लियोसाइड फॉस्फोरामिडाइट्स को सिलिका जेल पर कॉलम क्रोमैटोग्राफी द्वारा शुद्ध किया जाता है। फॉस्फोरामिडाइट भाग की स्थिरता की गारंटी के लिए, स्तंभ को 3 से 5% ट्राइथाइलमाइन युक्त एलुएंट के साथ संतुलित करने और पृथक्करण के पूरे पाठ्यक्रम के दौरान एलुएंट में इस एकाग्रता को बनाए रखने की सलाह दी जाती है। फॉस्फोरामिडाइट की शुद्धता का आकलन 31P एनएमआर स्पेक्ट्रोस्कोपी द्वारा किया जा सकता है। चूंकि न्यूक्लियोसाइड फॉस्फोरामिडाइट में पी (III) परमाणु चिरल है, यह यौगिक के दो डायस्टेरोमर्स के अनुरूप लगभग 149 पीपीएम पर दो शिखर प्रदर्शित करता है। संभावित रूप से उपस्थित फॉस्फाइट ट्राइस्टर अशुद्धता 138-140 पीपीएम पर चरम पर प्रदर्शित होती है। एच-फ़ॉस्फ़ोनेट अशुद्धियाँ 8 और 10 पीपीएम पर शिखर पर प्रदर्शित होती हैं।
फॉस्फोरैमिडाइट मोइटी के रासायनिक गुण
न्यूक्लियोसाइड फ़ॉस्फ़ोरमिडाइट्स लंबे समय तक शेल्फ-जीवन के साथ अपेक्षाकृत स्थिर यौगिक होते हैं जब उन्हें 4 डिग्री सेल्सियस से नीचे के तापमान पर हवा की अनुपस्थिति में निर्जल परिस्थितियों में पाउडर के रूप में संग्रहित किया जाता है। एमिडाइट्स हल्के बुनियादी परिस्थितियों का सामना करते हैं। इसके विपरीत, हल्के एसिड की उपस्थिति में भी, फॉस्फोरामिडाइट लगभग तुरंत ही नष्ट हो जाते हैं। फॉस्फोरामिडाइट्स तटस्थ परिस्थितियों में हाइड्रोलिसिस के लिए अपेक्षाकृत स्थिर होते हैं। उदाहरण के लिए, 25 डिग्री सेल्सियस पर 95% जलीय एसीटोनिट्राइल में 2-साइनोइथाइल 5'-O-(4,4'-डाइमेथोक्सीट्रिटिल) थाइमिडीन-3'-O-(N,N-डायसोप्रोपाइलमाइन) फॉस्फाइट का आधा जीवन 200 घंटे है।.[10]
- फॉस्फोरामिडाइट्स की सबसे महत्वपूर्ण विशेषता फॉस्फोरामिडाइट युग्मन प्रतिक्रिया से गुजरने की उनकी क्षमता है, जो कि एक अम्लीय एजोल उत्प्रेरक, 1 एच-टेट्राजोल, 2-एथिलथियोटेट्राजोल[11] 2-बेंज़िलथियोटेट्राजोल,[12][13] की उपस्थिति में न्यूक्लियोफिलिक समूहों के साथ प्रतिक्रिया करने की क्षमता है। 4,5-डिसियानोइमिडाज़ोल,[14] या इसी तरह के कई यौगिक। प्रतिक्रिया अत्यंत तीव्र गति से होती है। यही विशेषता ऑलिगोन्यूक्लियोटाइड संश्लेषण में न्यूक्लियोसाइड फ़ॉस्फ़ोरमिडाइट्स को उपयोगी मध्यवर्ती बनाती है। स्टीरियोकेमिकल रूप से, फॉस्फोरामिडाइट युग्मन पी (III) चिरल केंद्र पर एपिमेराइजेशन (डायस्टेरेमर्स का निर्माण) की ओर ले जाता है।
जब पानी को न्यूक्लियोफाइल के रूप में परोसा जाता है, तो उत्पाद एक एच-फॉस्फोनेट डायस्टर होता है जैसा कि ऊपर दी गई योजना में दिखाया गया है। सॉल्वैंट्स और अभिकर्मकों में अवशिष्ट पानी की उपस्थिति के कारण, बाद वाले यौगिक का निर्माण फॉस्फोरामिडाइट्स के प्रारंभिक उपयोग में सबसे आम जटिलता है, विशेष रूप से ऑलिगोन्यूक्लियोटाइड संश्लेषण में है।
- फॉस्फोरामाइड्स कमजोर ऑक्सीडेटिंग अभिकर्मकों के साथ आसानी से ऑक्सीकृत होते हैं, उदाहरण के लिए, कमजोर आधारों की उपस्थिति में या हाइड्रोजन पेरोक्साइड के साथ जलीय आयोडीन के साथ[15] संबंधित फॉस्फोरामिडेट बनाने के लिए है।
इसी तरह, फॉस्फोरामाइडाइट्स अन्य काल्कोजन के साथ प्रतिक्रिया करते हैं। जब सल्फर के घोल के संपर्क में लाया जाता है[15][16] या कई यौगिकों को सामूहिक रूप से ओलिगोन्यूक्लियोटाइड संश्लेषण सल्फराइजेशन एजेंट के रूप में संदर्भित किया जाता है,[17][18] फॉस्फोरामाइडाइट्स मात्रात्मक रूप से फॉस्फोरोथियोएमिडेट्स बनाते हैं। सेलेनियम के साथ प्रतिक्रिया[15][16]या सेलेनियम डेरिवेटिव[19] फॉस्फोरोसेलेनोमाइडेट्स का उत्पादन करता है। इस प्रकार की सभी अभिक्रियाओं में फॉस्फोरस परमाणु का विन्यास बना रहता है।
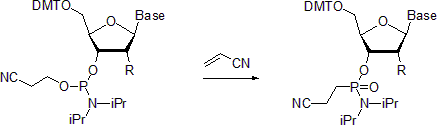
न्यूक्लियोसाइड फ़ॉस्फ़ोरमिडाइट्स संबंधित फ़ॉस्फ़ोनैमिडेट्स बनाने के लिए माइकलिस-आर्बुज़ोव प्रतिक्रिया से गुजरते हैं। एक उदाहरण में एक्रिलोनिट्राइल की उपस्थिति में फॉस्फोनामाइडेट की तैयारी का वर्णन किया गया है।[20] कथित तौर पर, कमरे के तापमान पर प्रतिक्रिया फॉस्फोरस केंद्र पर विन्यास के प्रतिधारण के साथ स्टीरियोसेलेक्टिव होती है। इसके विपरीत, जब 55 डिग्री सेल्सियस पर किया जाता है, तो प्रतिक्रिया रेसमाइज्ड उत्पादों की ओर ले जाती है।
- इसी तरह फॉस्फीन और तृतीयक फॉस्फेट के लिए, फॉस्फोरामाइडाइट आसानी से स्टुडिंगर प्रतिक्रिया से गुजरते हैं।
(RO)2P-N(R1)2 + R2-N3 + H2O ---- (RO)2P(=O)-N(R1)2 + R2-NH2 + N2;
सुरक्षा रणनीति
स्वाभाविक रूप से पाए जाने वाले न्यूक्लियोटाइड्स (न्यूक्लियोसाइड-3'- या 5'-फॉस्फेट) और उनके फॉस्फोडिएस्टर एनालॉग्स उच्च पैदावार में ऑलिगोन्यूक्लियोटाइड्स की एक त्वरित सिंथेटिक तैयारी को वहन करने के लिए अपर्याप्त रूप से प्रतिक्रियाशील हैं। न्यूक्लियोसाइड्स (न्यूक्लियोसाइड फॉस्फोरामाइडाइट्स) के 3'-O-(N,N-डायसोप्रोपाइल फॉस्फोरामिडाइट) डेरिवेटिव का उपयोग करके इंटरन्यूक्लियोसिडिक लिंकेज के गठन की चयनात्मकता और दर में नाटकीय रूप से सुधार किया जाता है जो फॉस्फेट ट्राइस्टर पद्धति में बिल्डिंग ब्लॉक के रूप में काम करता है। अवांछित पक्ष प्रतिक्रियाओं को रोकने के लिए, न्यूक्लियोसाइड्स में उपस्थित अन्य सभी कार्यात्मक समूहों को सुरक्षात्मक समूहों को जोड़कर अप्राप्य (संरक्षित) प्रदान किया जाना चाहिए। ऑलिगोन्यूक्लियोटाइड श्रृंखला असेंबली के पूरा होने पर, सभी सुरक्षा समूहों को वांछित ऑलिगोन्यूक्लियोटाइड्स प्राप्त करने के लिए हटा दिया जाता है। नीचे, व्यावसायिक रूप से उपलब्ध वर्तमान में उपयोग किए जाने वाले सुरक्षा समूह[21][22][23][24][25] और सबसे आम न्यूक्लियोसाइड फॉस्फोरैमिडाइट बिल्डिंग ब्लॉक्स की संक्षिप्त समीक्षा की गई है:
- 5'-हाइड्रॉक्सिल समूह एक एसिड-लेबाइल डीएमटी (4,4'-डाइमेथोक्सीट्रिटील) समूह द्वारा संरक्षित है।
- थाइमिन और यूरैसिल, क्रमशः थाइमिडीन और यूरिडीन के न्यूक्लिक बेस, में एक्सोसायक्लिक अमीनो समूह नहीं होते हैं और इसलिए उन्हें किसी सुरक्षा की आवश्यकता नहीं होती है। इसके विपरीत, न्यूक्लिक बेस एडीनाइन, साइटोसिन और गुआनिन एक्सोसायक्लिक अमीनो समूहों को सहन करते हैं, जो युग्मन प्रतिक्रिया की शर्तों के तहत सक्रिय फॉस्फोरामाइडाइट्स के साथ प्रतिक्रियाशील होते हैं। हालांकि, सिंथेटिक चक्र में अतिरिक्त चरणों की कीमत पर, असुरक्षित अमीनो समूहों के साथ फॉस्फोरामाइडाइट्स का उपयोग करके ऑलिगोन्यूक्लियोटाइड श्रृंखला असेंबली की जा सकती है,[26] प्रायः इन्हें ऑलिगोन्यूक्लियोटाइड श्रृंखला असेंबली की पूरी लंबाई में स्थायी रूप से संरक्षित रखा जाता है। एक्सोसायक्लिक अमीनो समूहों की सुरक्षा 5'-हाइड्रॉक्सी समूह की ओर्थोगोनल होनी चाहिए क्योंकि बाद वाले को प्रत्येक सिंथेटिक चक्र के अंत में हटा दिया जाता है। लागू करने के लिए सबसे सरल और इसलिए सबसे व्यापक रूप से स्वीकृत वह रणनीति है जहां एक्सोसाइक्लिक अमीनो समूह एक बेस-लेबाइल सुरक्षा धारण करते हैं। सबसे अधिक बार, दो सुरक्षा योजनाओं का उपयोग किया जाता है।
- पहले में, मानक और अधिक मजबूत योजना (चित्र), A, dA, C, dC, G, और dG के लिए किया जाता है, जो आइसोब्यूटिरिल समूह से संरक्षित हैं। हाल ही में, एसी (एसिटाइल) समूह का उपयोग प्रायः सी और डीसी की सुरक्षा के लिए किया जाता है जैसा कि चित्र में दिखाया गया है।[27]
- दूसरे में, हल्की सुरक्षा योजना, A और dA आइसोब्यूटिरिल से सुरक्षित हैं[28] या फेनोक्सीसेटाइल समूह (PAC)।[29] सी और डीसी एसिटाइल सुरक्षा प्रदान करते हैं,[27] और जी और डीजी 4-आइसोप्रोपाइलफेनोक्सीएसिटाइल (आई-पीआर-पीएसी) [30] या डाइमिथाइलफॉर्मामिडिनो (डीएमएफ)[31] समूहों से संरक्षित हैं। हल्के सुरक्षा समूहों को मानक सुरक्षा समूहों की तुलना में अधिक आसानी से हटा दिया जाता है। हालाँकि, इन समूहों वाले फॉस्फोरामिडाइट्स घोल में संग्रहीत होने पर कम स्थिर होते हैं।
- फ़ॉस्फाइट समूह को बेस-लेबाइल 2-सायनोइथाइल समूह द्वारा संरक्षित किया जाता है।[32] एक बार जब फॉस्फोरामिडाइट को ठोस समर्थन-बाउंड ऑलिगोन्यूक्लियोटाइड के साथ जोड़ दिया जाता है और फॉस्फेट अंशों को पी (वी) प्रजातियों में बदल दिया जाता है, तो आगे युग्मन प्रतिक्रियाओं के सफल संचालन के लिए फॉस्फेट संरक्षण की उपस्थिति अनिवार्य नहीं होती है।[33]
- आरएनए संश्लेषण में, 2'-हाइड्रॉक्सी समूह को टीबीडीएमएस (टी-ब्यूटिल्डिमिथाइलसिलिल) समूह द्वारा संरक्षित किया जाता है।[34][35][36][37] या टीओएम (ट्राई-आइसो-प्रोपाइलसिलोक्सीमिथाइल) समूह के साथ,[38][39] दोनों को फ्लोराइड आयन के साथ उपचार द्वारा हटाया जा सकता है।
- फ़ॉस्फाइट अंश अम्लीय परिस्थितियों में प्रतिक्रियाशील डायसोप्रोपाइलामिनो (iPr2N) समूह को भी धारण करता है। सक्रियण पर, डायसोप्रोपाइलामिनो समूह निकल जाता है, जिसे समर्थन-बाउंड ऑलिगोन्यूक्लियोटाइड के 5'-हाइड्रॉक्सी समूह द्वारा प्रतिस्थापित किया जाता है।
यह भी देखें
- डीएनए संश्लेषण
- न्यूक्लिक एसिड एनालॉग्स
- ओलिगोन्यूक्लियोटाइड संश्लेषण
संदर्भ
- ↑ Beaucage, S.L.; Caruthers M.H. (1981). "Deoxynucleoside phosphoramidites—A new class of key intermediates for deoxypolynucleotide synthesis". Tetrahedron Letters. 22 (20): 1859–1862. doi:10.1016/S0040-4039(01)90461-7.
- ↑ Lin, K.-Y., Matteucci, M. D. (1998). "A cytosine analog capable of clamp-like binding to a guanine in helical nucleic acids". J. Am. Chem. Soc. 120 (33): 8531–8532. doi:10.1021/ja981286z.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Nielsen, J.; Marugg, J. E.; Taagaard, M.; Van Boom, J. H.; Dahl, O. (1986). "Polymer-supported synthesis of deoxyoligonucleotides using in situ prepared deoxynucleoside 2-cyanoethyl phosphoramidites". Recl. Trav. Chim. Pays-Bas. 105 (1): 33–34. doi:10.1002/recl.19861050106.
- ↑ Nielsen, J.; Taagaard, M.; Marugg, J. E.; Van Boom, J. H.; Dahl, O. (1986). "Application of 2-cyanoethyl N,N,N',N'-tetraisopropylphosphorodiamidite for in situ preparation of deoxyribonucleoside phosphoramidites and their use in polymer-supported synthesis of oligodeoxyribonucleotides". Nucleic Acids Res. 14 (18): 7391–7403. doi:10.1093/nar/14.18.7391. PMC 311758. PMID 3763407.
- ↑ Nielsen, J.; Marugg, J. E.; Van Boom, J. H.; Honnens, J.; Taagaard, M.; Dahl, O. (1986). "Thermal instability of some alkyl phosphorodiamidites". J. Chem Res. Synopses (1): 26–27.
- ↑ Nielsen, J.; Dahl, O. (1987). "Improved synthesis of 2-cyanoethyl N,N,N',N'-tetraisopropylphosphorodiamidite (iPr2N)2POCH2CH2CN)". Nucleic Acids Res. 15 (8): 3626. doi:10.1093/nar/15.8.3626. PMC 340760. PMID 3575107.
- ↑ Beaucage, S. L. (2001). "2-Cyanoethyl Tetraisopropylphosphorodiamidite". E-EROS Encyclopedia of Reagents for Organic Synthesis. doi:10.1002/047084289X.rn00312. ISBN 0471936235.
- ↑ Sinha, N. D.; Biernat, J.; Koester, H. (1983). "β-Cyanoethyl N,N-dialkylamino/N-morpholinomonochloro phosphoamidites, new phosphitylating agents facilitating ease of deprotection and work-up of synthesized oligonucleotides". Tetrahedron Lett. 24 (52): 5843–5846. doi:10.1016/S0040-4039(00)94216-3.
- ↑ Marugg, J. E.; Burik, A.; Tromp, M.; Van der Marel, G. A. & Van Boom, J. H. (1986). "A new and versatile approach to the preparation of valuable deoxynucleoside 3'-phosphite intermediates". Tetrahedron Lett. 24 (20): 2271–22274. doi:10.1016/S0040-4039(00)84506-2.
- ↑ Guzaev, A. P.; Manoharan, M. (2001). "2-Benzamidoethyl group - a novel type of phosphate protecting group for oligonucleotide synthesis". J. Am. Chem. Soc. 123 (5): 783–793. doi:10.1021/ja0016396. PMID 11456611.
- ↑ Sproat, B.; Colonna, F.; Mullah, B.; Tsou, D.; Andrus, A.; Hampel, A.; Vinayak, R. (Feb 1995). "ओलिगोरिबोन्यूक्लियोटाइड्स के अलगाव और शुद्धिकरण के लिए एक कुशल विधि". Nucleosides & Nucleotides. 14 (1&2): 255–273. doi:10.1080/15257779508014668. ISSN 0261-3166.
- ↑ Stutz, A.; Hobartner, C.; Pitsch, S. (Sep 2000). "Novel fluoride-labile nucleobase-protecting groups for the synthesis of 3'(2')-O-amino-acylated RNA sequences". Helv. Chim. Acta. 83 (9): 2477–2503. doi:10.1002/1522-2675(20000906)83:9<2477::aid-hlca2477>3.0.co;2-9. ISSN 0018-019X.
- ↑ Welz, R.; Muller, S. (Jan 2002). "5-(Benzylmercapto)-1H-tetrazole as activator for 2'-O-TBDMS phosphoramidite building blocks in RNA synthesis". Tetrahedron Letters. 43 (5): 795–797. doi:10.1016/S0040-4039(01)02274-2. ISSN 0040-4039.
- ↑ Vargeese, C.; Carter, J.; Yegge, J.; Krivjansky, S.; Settle, A.; Kropp, E.; Peterson, K.; Pieken, W. (1998). "Efficient activation of nucleoside phosphoramidites with 4,5-dicyanoimidazole during oligonucleotide synthesis". Nucleic Acids Res. 26 (4): 1046–1050. doi:10.1093/nar/26.4.1046. ISSN 0305-1048. PMC 147346. PMID 9461466.
- ↑ Jump up to: 15.0 15.1 15.2 Gacs-Baitz, E.; Sipos, F.; Egyed, O.; Sagi, G. (2009). "Synthesis and structural study of variously oxidized diastereomeric 5'-dimethoxytrityl-thymidine-3'-O-[O-(2-cyanoethyl)-N,N-diisopropyl]-phosphoramidite derivatives. Comparison of the effects of the P=O, P=S, and P=Se functions on the NMR spectral and chromatographic properties". Chirality. 21 (7): 663–673. doi:10.1002/chir.20653. PMID 18937288.
- ↑ Jump up to: 16.0 16.1 Nemer, M. J.; Ogilvie, K. K. (1980). "Phosphoramidate analogs of diribonucleoside monophosphates". Tetrahedron Lett. 21 (43): 4153–4154. doi:10.1016/s0040-4039(00)93675-x.
- ↑ Wilk, A.; Uznanski, B.; Stec, W. J. (1991). "Assignment of absolute configuration at phosphorus in dithymidylyl(3',5')phosphormorpholidates and -phosphormorpholidothioates". Nucleosides & Nucleotides. 10 (1–3): 319–322. doi:10.1080/07328319108046469.
- ↑ Guzaev, A. P. (2011). "Reactivity of 3H-1,2,4-dithiazole-3-thiones and 3H-1,2-dithiole-3-thiones as sulfurizing agents for oligonucleotide synthesis". Tetrahedron Letters. 52 (3): 434–437. doi:10.1016/j.tetlet.2010.11.086.
- ↑ Holloway, G. A.; Pavot, C.; Scaringe, S. A.; Lu, Y.; Rauchfuss, T. B. (2002). "फॉस्फोरोसेलेनोएट युक्त ऑलिगोन्यूक्लियोटाइड्स के लिए एक ऑर्गोनोमेटेलिक मार्ग।". ChemBioChem. 3 (11): 1061–1065. doi:10.1002/1439-7633(20021104)3:11<1061::aid-cbic1061>3.0.co;2-9. PMID 12404630. S2CID 18797616.
- ↑ Ravikumar, V. T.; Kumar, R. K. (2004). "Stereoselective Synthesis of Alkylphosphonates: A Facile Rearrangement of Cyanoethyl-Protected Nucleoside Phosphoramidites". Org. Process Res. Dev. 8 (4): 603–608. doi:10.1021/op030035u.
- ↑ "बीटा-साइनोइथाइल फॉस्फोरामाइड्स". Products.appliedbiosystems.com. Retrieved 2009-05-12.
- ↑ "बायोसर्च टेक्नोलॉजीज". Biosearchtech.com. Retrieved 2009-05-12.
- ↑ "केमजीन कॉर्पोरेशन, एक बायोटेक्नोलॉजी कंपनी". Chemgenes.com. Retrieved 2009-05-12.
- ↑ M. Powell (2008-01-17). "एप्लाइड बायोसिस्टम्स इंस्ट्रूमेंट्स". Glenresearch.com. Retrieved 2009-05-12.
- ↑ "न्यूक्लिक एसिड संश्लेषण और लेबलिंग". Thermo.com. 2008-08-16. Archived from the original on February 28, 2009. Retrieved 2009-05-12.
- ↑ Gryaznov, S. M.; Letsinger, R. L. (1991). "Synthesis of oligonucleotides via monomers with unprotected bases". J. Am. Chem. Soc. 113 (15): 5876–5877. doi:10.1021/ja00015a059.
- ↑ Jump up to: 27.0 27.1 Reddy, M. P.; Hanna, N. B.; Farooqui, F. (1997). "Ultrafast Cleavage and Deprotection of Oligonucleotides Synthesis and Use of CAc Derivatives". Nucleosides & Nucleotides. 16 (7–9): 1589–1598. doi:10.1080/07328319708006236.
- ↑ McMinn, D. (1997). "Synthesis of oligonucleotides containing 3'-alkyl amines using N-isobutyryl protected deoxyadenosine phosphoramidite". Tetrahedron Lett. 38 (18): 3123. doi:10.1016/S0040-4039(97)00568-6.
- ↑ Schulhof, J. C.; Molko, D.; Teoule, R. (1987). "ऑलिगोन्यूक्लियोटाइड संश्लेषण में अंतिम डीप्रोटेक्शन चरण को लेबिल बेस-प्रोटेक्टिंग समूहों का उपयोग करके हल्के और तेजी से अमोनिया उपचार में कम किया जाता है।". Nucleic Acids Res. 15 (2): 397–416. doi:10.1093/nar/15.2.397. PMC 340442. PMID 3822812.
- ↑ Zhu, Q. (2001). "फास्ट-डीप्रोटेक्टिंग फॉस्फोरामाइडाइट्स और अल्ट्रा-माइल्ड डीप्रोटेक्शन का उपयोग करके तैयार किए गए ऑलिगोन्यूक्लियोटाइड्स के एन-एसिटिलेशन का निरीक्षण और उन्मूलन". Bioorg. Med. Chem. Lett. 11 (9): 1105–7. doi:10.1016/S0960-894X(01)00161-5. PMID 11354354.
- ↑ McBride, L. J.; Kierzek, R.; Beaucage, S. L.; Caruthers, M. H. (1986). "Nucleotide chemistry. 16. Amidine protecting groups for oligonucleotide synthesis". J. Am. Chem. Soc. 108 (8): 2040. doi:10.1021/ja00268a052.
- ↑ Sinha, N. D.; Biernat, J.; McManus, J.; Koester, H. (1984). "Polymer support oligonucleotide synthesis. XVIII: use of β-cyanoethyl-N,N-dialkylamino-/N-morpholino phosphoramidite of deoxynucleosides for the synthesis of DNA fragments simplifying deprotection and isolation of the final product". Nucleic Acids Res. 12 (11): 4539–4557. doi:10.1093/nar/12.11.4539. PMC 318857. PMID 6547529.
- ↑ Guzaev, A. P.; Manoharan, M. (2001). "असुरक्षित इंटरन्यूक्लिओसिडिक फॉस्फेट मोएटीज़ को प्रभावित करने वाले ऑलिगोन्यूक्लियोटाइड्स के लिए फॉस्फोरामाइडाइट युग्मन". J. Org. Chem. 66 (5): 1798–1804. doi:10.1021/jo001591e. PMID 11262130.
- ↑ Ogilvie, K. K.; Theriault, N.; Sadana, K. L. (1977). "ऑलिगोरिबोन्यूक्लियोटाइड्स का संश्लेषण". J. Am. Chem. Soc. 99 (23): 7741–7743. doi:10.1021/ja00465a073. PMID 915168.
- ↑ Usman, N.; Ogilvie, K. K.; Jiang, M. Y.; Cedergren, R. J. (1987). "The automated chemical synthesis of long oligoribuncleotides using 2'-O-silylated ribonucleoside 3'-O-phosphoramidites on a controlled-pore glass support: synthesis of a 43-nucleotide sequence similar to the 3'-half molecule of an Escherichia coli formylmethionine tRNA". J. Am. Chem. Soc. 109 (25): 7845–7854. doi:10.1021/ja00259a037.
- ↑ Usman, N.; Pon, R. T.; Ogilvie, K. K. (1985). "Preparation of ribonucleoside 3'-O-phosphoramidites and their application to the automated solid phase synthesis of oligonucleotides". Tetrahedron Lett. 26 (38): 4567–4570. doi:10.1016/S0040-4039(00)98753-7.
- ↑ Scaringe, S. A.; Francklyn, C.; Usman, N. (1990). "Chemical synthesis of biologically active oligoribonucleotides using β-cyanoethyl protected ribonucleoside phosphoramidites". Nucleic Acids Res. 18 (18): 5433–5441. doi:10.1093/nar/18.18.5433. PMC 332221. PMID 2216717.
- ↑ Pitsch, S.; Weiss, P. A.; Wu, X.; Ackermann, D.; Honegger, T. (1999). "Fast and reliable automated synthesis of RNA and partially 2'-O-protected precursors ("caged RNA") based on two novel, orthogonal 2'-O-protecting groups". Helv. Chim. Acta. 82 (10): 1753–1761. doi:10.1002/(SICI)1522-2675(19991006)82:10<1753::AID-HLCA1753>3.0.CO;2-Y.
- ↑ Pitsch, S.; Weiss, P. A.; Jenny, L.; Stutz, A.; Wu, X. (2001). "Reliable chemical synthesis of oligoribonucleotides (RNA) with 2'-O-[(triisopropylsilyl)oxy]methyl(2'-O-tom)-protected phosphoramidites". Helv. Chim. Acta. 84 (12): 3773–3795. doi:10.1002/1522-2675(20011219)84:12<3773::AID-HLCA3773>3.0.CO;2-E.
अग्रिम पठन
- Comprehensive Natural Products Chemistry, Volume 7: DNA and Aspects of Molecular Biology. Kool, Eric T.; Editor. Neth. (1999), 733 pp. Publisher: (Elsevier, Amsterdam, Neth.)
- Beaucage S. L., Iyer R. P. (1992). "Advances in the synthesis of oligonucleotides by the phosphoramidite approach". Tetrahedron. 48 (12): 2223–2311. doi:10.1016/s0040-4020(01)88752-4.
- Beaucage S. L., Iyer R. P. (1993). "The functionalization of oligonucleotides via phosphoramidite derivatives". Tetrahedron. 49 (10): 1925–1963. doi:10.1016/s0040-4020(01)86295-5.
- Beaucage S. L., Iyer R. P. (1993). "The synthesis of modified oligonucleotides by the phosphoramidite approach and their applications". Tetrahedron. 49 (28): 6123–6194. doi:10.1016/s0040-4020(01)87958-8.
- Beaucage, S L. "Oligodeoxyribonucleotides synthesis. Phosphoramidite approach. Methods in Molecular Biology (Totowa, NJ, United States) (1993), 20 (Protocols for Oligonucleotides and Analogs), 33–61.
- Reese C. B. (2002). "The chemical synthesis of oligo- and poly-nucleotides: a personal commentary". Tetrahedron. 58 (44): 8893–8920. doi:10.1016/s0040-4020(02)01084-0.
- Brown T., Brown D. J. S. 1991. In Oligonucleotides and Analogues. A Practical Approach, ed. F Eckstein, pp. 1 – 24. Oxford: IRL