पित्त अम्ल
पित्त अम्ल मुख्य रूप से स्तनधारियों और अन्य कशेरुकियों के पित्त में पाए जाने वाले स्टेरॉयड अम्ल होते हैं। विविध पित्त अम्लों का संश्लेषण यकृत में होता है।[1] पित्त अम्ल टॉरिन या ग्लाइसिन अवशेषों के साथ संयुग्मित होकर पित्त लवण नामक आयन देते हैं।[2][3][4]
प्राथमिक पित्त अम्ल यकृत द्वारा संश्लेषित होते हैं। द्वितीयक पित्त अम्ल बृहदान्त्र (शरीर रचना) में जीवाणु क्रियाओं से उत्पन्न होते हैं। मनुष्यों में, टॉरोचोलिक अम्ल और ग्लाइकोकोलिक अम्ल (कोलिक अम्ल के डेरिवेटिव) और टॉरोकेनोडॉक्सिकोलिक अम्ल और ग्लाइकोचेनोडॉक्सिकोलिक अम्ल (चेनोडॉक्सिकोलिक अम्ल के डेरिवेटिव) प्रमुख पित्त लवण हैं। वे सघनता में लगभग बराबर हैं।[5] उनके 7-अल्फा-डिहाइड्रॉक्सिलेटेड डेरिवेटिव्स, डीऑक्सीकोलिक अम्ल और लिथोकोलिक अम्ल के लवण भी पाए जाते हैं, जिसमें मानव पित्त पित्त अम्ल के 90% से अधिक के लिए चोलिक, चेनोडॉक्सिकोलिक और डीऑक्सीकोलिक अम्ल के डेरिवेटिव होते हैं।[5]
पित्त अम्ल में पित्त में लगभग 80% कार्बनिक यौगिक होते हैं (अन्य फॉस्फोलिपिड और कोलेस्ट्रॉल हैं)।[5] पित्त अम्लों के स्राव में वृद्धि से पित्त प्रवाह में वृद्धि होती है। पित्त अम्ल आहार वसा और तेलों के पाचन की सुविधा प्रदान करते हैं। वे मिसेल बनाने वाले पृष्ठसक्रियकारक के रूप में कार्य करते हैं, जो पोषक तत्वों को समाहित करते हैं, उनके अवशोषण की सुविधा प्रदान करते हैं।[6] ये मिसेल आगे की प्रक्रिया से पहले चाइम में निलंबित कर दिए जाते हैं। विशेष रूप से फ़ार्नेसॉइड एक्स ग्राही और जीपीबीएआर1 (जिसे टीजीआर5 भी कहा जाता है) के माध्यम से पित्त अम्लों में भी पूरे शरीर में हार्मोनल क्रियाएं होती हैं।[7]
उत्पादन
प्राथमिक पित्त अम्ल
पित्त अम्ल संश्लेषण यकृतकोशिका में होता है, जो बहु-चरणीय प्रक्रिया में कोलेस्ट्रॉल के साइटोक्रोम पी450-मध्यस्थता ऑक्सीकरण के माध्यम से प्राथमिक पित्त अम्ल (मनुष्यों में चोलिक अम्ल और चेनोडॉक्सिकोलिक अम्ल) को संश्लेषित करता है। मल में खो जाने वाले पित्त अम्लों को परिवर्तित करने के लिए प्रतिदिन लगभग 600 mg पित्त लवण प्रतिदिन संश्लेषित किए जाते हैं, चूँकि, जैसा कि नीचे बताया गया है, बहुत बड़ी मात्रा में स्रावित होता है, आंत में पुन: अवशोषित और पुनर्नवीनीकरण किया जाता है।
संश्लेषण में दर-सीमित चरण एंजाइम कोलेस्ट्रॉल 7 अल्फा-हाइड्रॉक्सिलेज़ द्वारा स्टेरॉयड नाभिक की 7 वीं स्थिति के हाइड्रॉक्सिल समूह को जोड़ना है। इस एंजाइम को चोलिक एसिड द्वारा डाउन-रेगुलेट किया जाता है, कोलेस्ट्रॉल द्वारा अप-रेगुलेट किया जाता है और इलियल हार्मोन एफजीएफ15/19 की क्रियाओं द्वारा बाधित होता है।[2][3]
किसी भी पित्त अम्ल (प्राथमिक या द्वितीयक, नीचे देखें) को स्रावित करने से पहले, यकृत कोशिकाएं कुल 8 संभावित संयुग्मित पित्त अम्ल बनाने के लिए उन्हें ग्लाइसिन या टॉरिन के साथ संयुग्मित करती हैं। इन संयुग्मित पित्त अम्लों को अधिकांशतः पित्त लवण कहा जाता है। असंबद्ध पित्त अम्लों का अम्ल पृथक्करण स्थिरांक 5 और 6.5 के बीच होता है,[4] और ग्रहणी का pH 3 और 5 के बीच होता है, इसलिए जब अपराजित पित्त अम्ल ग्रहणी में होते हैं, तो वे लगभग सदैव प्रोटोनेटेड (एचए फॉर्म) होते हैं, जो उन्हें पानी में अपेक्षाकृत अघुलनशील बनाता है। पित्त अम्ल को अमीनो अम्ल के साथ संयुग्मित करने से पित्त-अम्ल/एमिनो-अम्ल संयुग्म के pKa को 1 और 4 के बीच कम कर देता है। इस प्रकार संयुग्मित पित्त अम्ल ग्रहणी में लगभग सदैव अपने अवक्षेपित (A-) रूप में होते हैं, जो उन्हें पानी में घुलनशील बनाता है और पायसीकारी वसा के उनके शारीरिक कार्य को पूरा करने में सक्षम होता है।[8][9]
माध्यमिक पित्त अम्ल
एक बार आंत के लुमेन में स्रावित होने के बाद, पित्त लवण को आंत के जीवाणुओं द्वारा संशोधित किया जाता है। वे आंशिक रूप से निर्जलित हैं। उनके ग्लाइसिन और टॉरिन समूहों को द्वितीयक पित्त अम्ल, डीऑक्सीकोलिक अम्ल और लिथोकोलिक अम्ल देने के लिए हटा दिया जाता है। चोलिक अम्ल को डीऑक्सीकोलिक अम्ल और चेनोडॉक्सिकोलिक अम्ल को लिथोकोलिक अम्ल में परिवर्तित कर दिया जाता है। इन चारों पित्त अम्लों को एंटरोहेपेटिक परिसंचरण के रूप में जाने वाली प्रक्रिया में पुनर्नवीनीकरण किया जाता है।[2][3]
कार्य
लिपिड पाचन
जल विरोधी और हाइड्रोफिलिक क्षेत्रों वाले अणुओं के रूप में, संयुग्मित पित्त लवण लिपिड/जल इंटरफेस पर बैठते हैं और, सही सांद्रता से ऊपर, मिसेल बनाते हैं।[9] संयुग्मित पित्त लवण की अतिरिक्त घुलनशीलता छोटी आंत में निष्क्रिय पुन: अवशोषण को रोककर उनके कार्य में सहायता करती है। परिणामस्वरूप, छोटी आंत में पित्त अम्ल/लवण की सांद्रता मिसेल बनाने और लिपिड को घोलने के लिए पर्याप्त होती है। क्रिटिकल माइक्रेलर कंसंट्रेशन पित्त अम्ल की आंतरिक संपत्ति और मिसेल के सहज और गतिशील गठन में कार्य करने के लिए आवश्यक पित्त अम्ल की मात्रा दोनों को संदर्भित करता है।[9] पित्त अम्ल युक्त मिसेल लिपिड को पचाने में सहायता करता है और उन्हें आंतों की ब्रश सीमा झिल्ली के पास लाता है, जिसके परिणामस्वरूप वसा का अवशोषण होता है।[6]
मनुष्यों के अतिरिक्त अधिकांश प्रजातियों में पित्त अम्लों का संश्लेषण कोलेस्ट्रॉल उपापचयी का प्रमुख मार्ग है। शरीर प्रति दिन लगभग 800 मिलीग्राम कोलेस्ट्रॉल का उत्पादन करता है और इसका लगभग आधा दैनिक 400-600 मिलीग्राम पित्त अम्ल संश्लेषण के लिए उपयोग किया जाता है। मानव वयस्क प्रत्येक दिन आंतों में 12 से 18 ग्राम पित्त अम्ल स्रावित करते हैं, अधिकतर भोजन के बाद स्रावित करते हैं। पित्त अम्ल पूल का आकार 4–6 g के बीच होता है, जिसका अर्थ है कि पित्त अम्लों को प्रत्येक दिन कई बार पुनर्नवीनीकरण किया जाता है। लगभग 95% पित्त अम्लों को लघ्वान्त्र में सक्रिय परिवहन द्वारा पुन: अवशोषित किया जाता है और पित्त प्रणाली और पित्ताशय की थैली में आगे के स्राव के लिए यकृत में वापस पुनर्नवीनीकरण किया जाता है। पित्त अम्लों का यह एंटरोहेपेटिक संचलन संश्लेषण की कम दर की अनुमति देता है, केवल लगभग 0.3 ग्राम/दिन, लेकिन बड़ी मात्रा में आंत में स्रावित होता है।[5]
पित्त अम्ल के अन्य कार्य हैं, जिनमें शरीर से कोलेस्ट्रॉल को समाप्त करना, कुछ कैटाबोलाइट्स (बिलीरुबिन सहित) को समाप्त करने के लिए पित्त के प्रवाह को चलाना, उनके अवशोषण को सक्षम करने के लिए वसा में घुलनशील विटामिनों का उत्सर्जन करना और गतिशीलता में सहायता करना और जीवाणुओं वनस्पतियों को छोटी आंत और पित्त मार्ग में कम करना सम्मिलित है।[5]
सेल सिग्नलिंग
पित्त अम्लों की शरीर में उपापचयी क्रियाएं हार्मोन जैसी होती हैं, जो दो विशिष्ट ग्राहियों, फार्नेसॉइड एक्स ग्राही और जी प्रोटीन-युग्मित पित्त अम्ल ग्राही / टीजीआर5 ग्राही के माध्यम से कार्य करती हैं।[7][10] वे विशेष रूप से कुछ अन्य ग्राहियों को बांधते हैं और कुछ एंजाइमों[11] और आयन चैनलों[12] की गतिविधि को विनियमित करने और अंतर्जात फैटी अम्ल इथेनॉलमाइड्स सहित विविध पदार्थों का संश्लेषण की सूचना देते है।[13][14]
संरचना और संश्लेषण
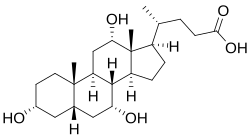
- The structures of the principal human bile acids
- फ़ाइल: Glycocholsä
- Ure.svg
ग्लाइकोकोलिक एसिड
पित्त लवण अणुओं के बड़े परिवार का गठन करते हैं, जो चार रिंगों के साथ स्टेरॉयड संरचना से बना होता है, कार्बोक्जिलिक अम्ल में समाप्त होने वाली पांच- या आठ-कार्बन साइड-चेन, और कई हाइड्रॉक्सिल समूह, जिनकी संख्या और अभिविन्यास विशिष्ट के बीच भिन्न होता है। पित्त लवण[1] में चार रिंगों को A, B, C, और D लेबल किया जाता है, जो कार्बोक्सिल समूह के साथ साइड चेन के सबसे दूर से निकटतम तक होता है। डी-रिंग अन्य तीन की तुलना में कार्बन से छोटा है। संरचना सामान्यतः बाईं ओर A और दाईं ओर D के साथ खींची जाती है। हाइड्रॉक्सिल समूह दो विन्यासों में से किसी एक में हो सकते हैं: या तो ऊपर (या बाहर), जिसे बीटा कहा जाता है (β; अधिकांशतः ठोस रेखा के रूप में सम्मेलन द्वारा खींचा जाता है), या नीचे, अल्फा (α; धराशायी रेखा के रूप में प्रदर्शित) कहा जाता है। सभी पित्त अम्लों में 3-हाइड्रॉक्सिल समूह होता है, जो मूल अणु, कोलेस्ट्रॉल से प्राप्त होता है, जिसमें 3-हाइड्रॉक्सिल बीटा होता है।[1]

पित्त अम्लों के यकृत संश्लेषण के शास्त्रीय मार्ग में प्रारंभिक चरण कोलेस्ट्रॉल 7α-हाइड्रॉक्सिल समूह द्वारा 7α-हाइड्रॉक्सिल समूह (सीवाईपी7ए1) का एंजाइमेटिक जोड़ है जो 7α-हाइड्रॉक्सीकोलेस्ट्रोल बनाता है। यह तब 7α-हाइड्रॉक्सी-4-कोलेस्टेन-3-वन के लिए मेटाबोलाइज़ किया जाता है। पित्त अम्ल संश्लेषण में कई चरण होते हैं जिनमें सभी में 14 एंजाइमों की आवश्यकता होती है।[3] इसके परिणामस्वरूप पहले दो स्टेरॉयड रिंग (A और B) के बीच के जोड़ को परिवर्तित कर दिया जाता है, जिससे अणु मुड़ जाता है; इस प्रक्रिया में, 3-हाइड्रॉक्सिल α अभिविन्यास में परिवर्तित हो जाता है। सरलतम 24-कार्बन पित्त अम्ल में 3α और 7α की स्थिति में दो हाइड्रॉक्सिल समूह होते हैं। यह 3α, 7α-डायहाइड्रॉक्सी-5β-चोलन-24-oic अम्ल है, या, जैसा कि सामान्यतः जाना जाता है, चेनोडॉक्सिकोलिक अम्ल। यह पित्त अम्ल पहले घरेलू हंस से अलग किया गया था, जिससे नाम का चेनो भाग प्राप्त हुआ था (ग्रीक: χήν = हंस)। नाम में 5β स्टेरॉयड नाभिक के छल्ले A और B के बीच जोड़ के उन्मुखीकरण को दर्शाता है (इस स्थिति में, वे मुड़े हुए हैं)। चोलन शब्द 24 कार्बन की विशेष स्टेरॉयड संरचना को दर्शाता है, और 24-ओइक अम्ल इंगित करता है कि साइड-चेन के अंत में कार्बोक्जिलिक अम्ल 24 की स्थिति में पाया जाता है। चेनोडॉक्सिकोलिक अम्ल कई प्रजातियों द्वारा बनाया जाता है, और प्रोटोटाइप कार्यात्मक पित्त अम्ल होता है।[2][3]
पित्त अम्ल संश्लेषण का वैकल्पिक (अम्लीय) मार्ग माइटोकॉन्ड्रियल स्टेरोल 27-हाइड्रॉक्सिलेज़ (सीवाईपी27ए1) द्वारा प्रारंभ किया जाता है, जो यकृत में व्यक्त होता है, और मैक्रोफेज और अन्य ऊतकों में भी होता है। सीवाईपी27ए1 स्टेरोल साइड चेन ऑक्सीकरण को उत्प्रेरित करके कुल पित्त अम्ल संश्लेषण में महत्वपूर्ण योगदान देता है, जिसके बाद पेरोक्सीसोम्स में तीन कार्बन इकाई के विदलन से C24 पित्त अम्ल का निर्माण होता है। यकृत में 25-हाइड्रॉक्सिलेज़ और मस्तिष्क में 24-हाइड्रॉक्सिलेज़ द्वारा प्रारंभ किए गए छोटे रास्ते भी पित्त अम्ल संश्लेषण में योगदान कर सकते हैं। 7α-हाइड्रॉक्सिलेज़ (सीवाईपी7बी1) ऑक्सीस्टेरोल उत्पन्न करता है, जिसे बाद में यकृत में सीडीसीए में परिवर्तित किया जा सकता है।[2][3]
चोलिक अम्ल, 3α, 7α, 12α-ट्राइहाइड्रॉक्सी-5β-चोलन-24-ओइक अम्ल, मनुष्यों और कई अन्य प्रजातियों में सबसे प्रचुर मात्रा में पित्त अम्ल, चेनोडॉक्सिकोलिक अम्ल से पहले खोजा गया था। यह 3 हाइड्रॉक्सिल समूहों (3α, 7α और 12α) के साथ त्रि-हाइड्रॉक्सी-पित्त अम्ल है। यकृत में इसके संश्लेषण में, सीवाईपी8बी1 की अतिरिक्त क्रिया द्वारा 12α हाइड्रॉक्सिलेशन किया जाता है। जैसा कि पहले ही वर्णित किया जा चुका है, चेनोडॉक्सिकोलिक अम्ल (2 हाइड्रॉक्सिल समूहों के साथ) की खोज ने इस नए पित्त अम्ल को डीऑक्सीकोलिक अम्ल बना दिया, जिसमें चोलिक अम्ल की तुलना में कम हाइड्रॉक्सिल समूह था।[2][3]
डीओक्सीकोलिक अम्ल 7-डीहाइड्रॉक्सिलेशन द्वारा चोलिक अम्ल से बनता है, जिसके परिणामस्वरूप 2 हाइड्रॉक्सिल समूह (3α और 12α) होते हैं। चेनोडॉक्सिकोलिक अम्ल के साथ इस प्रक्रिया के परिणामस्वरूप केवल 3α हाइड्रॉक्सिल समूह के साथ पित्त अम्ल होता है, जिसे लिथोकोलिक अम्ल (लिथो = स्टोन) कहा जाता है, जिसे पहले बछड़े से पित्त पथरी में पहचाना जाता है। यह खराब पानी में घुलनशील है और कोशिकाओं के लिए विषैला है।[2][3]
विभिन्न कशेरुकी परिवारों ने पित्त अम्ल संरचना के स्टेरॉयड नाभिक और साइड-चेन पर अधिकांश पदों के संशोधनों का उपयोग करने के लिए विकसित किया है। लिथोकोलिक अम्ल के उत्पादन से जुड़ी समस्याओं से बचने के लिए, अधिकांश प्रजातियाँ चेनोडॉक्सिकोलिक अम्ल में तीसरा हाइड्रॉक्सिल समूह जोड़ती हैं। आंतों के जीवाणुओं द्वारा 7α हाइड्रॉक्सिल समूह के बाद के निष्कासन के परिणामस्वरूप कम विषाक्त लेकिन अभी भी कार्यात्मक डायहाइड्रॉक्सी पित्त अम्ल होगा। कशेरुक विकास के समय, तीसरे हाइड्रॉक्सिल समूह की नियुक्ति के लिए कई पदों को चुना गया है। प्रारंभ में, 16α स्थिति विशेष रूप से पक्षियों में पसंद की गई थी। बाद में, 12α स्थिति का चयन करने वाली बड़ी संख्या में प्रजातियों में इस स्थिति को हटा दिया गया। प्राइमेट्स (मनुष्यों सहित) अपने तीसरे हाइड्रॉक्सिल समूह की स्थिति के लिए 12α का उपयोग करते हैं, चोलिक अम्ल का उत्पादन करते हैं। चूहों और अन्य कृन्तकों में, 6β हाइड्रॉक्सिलेशन म्यूरिचोलिक अम्ल (7 हाइड्रॉक्सिल स्थिति के आधार पर α या β) बनाता है। सूअरों में हाइकोलिक अम्ल (3α,6α,7α-ट्राइहाइड्रॉक्सी-5β-कोलेनोइक अम्ल) में 6α हाइड्रॉक्सिलेशन होता है, और अन्य प्रजातियों में साइड-चेन की स्थिति 23 पर हाइड्रॉक्सिल समूह होता है।
कई अन्य पित्त अम्लों का वर्णन, अधिकांशतः छोटी मात्रा में, जीवाणु एंजाइमेटिक या अन्य संशोधनों के परिणामस्वरूप किया गया है। आइसो-एपिमर में β स्थिति में 3-हाइड्रॉक्सिल समूह होता है। एलो-एपिमर्स में 5α विन्यास होता है, जो A और B रिंगों की सापेक्ष स्थिति को परिवर्तित करता है।[1]
उर्सोडॉक्सिकोलिक अम्ल को सबसे पहले भालू के पित्त से अलग किया गया था, जिसका उपयोग सदियों से औषधीय रूप से किया जाता रहा है। इसकी संरचना β स्थिति में 7-हाइड्रॉक्सिल ग्रुप के साथ चेनोडॉक्सिकोलिक अम्ल जैसी दिखती है।[1]
ओबेटीकोलिक अम्ल, 6α-एथिल-चेनोडॉक्सिकोलिक अम्ल, अर्ध-सिंथेटिक पित्त अम्ल है जिसमें एफएक्सआर एगोनिस्ट के रूप में अधिक गतिविधि होती है, जिसे कुछ यकृत रोगों में दवा एजेंट के रूप में विकसित किया गया है।[15]
हार्मोनल क्रियाएं
पित्त अम्ल स्टेरॉयड हार्मोन के रूप में भी कार्य करता है, यकृत से स्रावित होता है, आंत से अवशोषित होता है और शरीर में विभिन्न प्रत्यक्ष उपापचयी क्रियाओं को परमाणु ग्राही फ़ार्नेसॉइड X ग्राही (एफएक्सआर) के माध्यम से करता है, जिसे इसके जीन नाम एनआर1एच4 से भी जाना जाता है।[16][17][18] अन्य पित्त अम्ल ग्राही कोशिका झिल्ली ग्राही है जिसे जी प्रोटीन-युग्मित पित्त अम्ल ग्राही 1 या जी प्रोटीन-युग्मित पित्त अम्ल ग्राही के रूप में जाना जाता है। यकृत और आंतों में सिग्नलिंग अणुओं के रूप में उनके कई कार्य एफएक्सआर को सक्रिय करके होते हैं, जबकि टीजीआर5 उपापचयी, अंतःस्रावी और न्यूरोलॉजिकल कार्यों में सम्मिलित हो सकता है।[7][19]
संश्लेषण का विनियमन
सर्फ़ेक्टेंट्स या डिटर्जेंट के रूप में, पित्त अम्ल कोशिकाओं के लिए संभावित रूप से विषाक्त होते हैं, और इसलिए उनकी सांद्रता को कड़ाई से नियंत्रित किया जाता है। यकृत में एफएक्सआर की सक्रियता पित्त अम्ल के संश्लेषण को रोकती है, और जब पित्त अम्ल का स्तर बहुत अधिक होता है तो प्रतिक्रिया नियंत्रण का तंत्र होता है। दूसरे, आंत में अवशोषण के समय पित्त अम्लों द्वारा एफएक्सआर सक्रियण एफजीएफ19 के प्रतिलेखन और संश्लेषण को बढ़ाता है, जो तब यकृत में पित्त अम्ल संश्लेषण को रोकता है।[20]
मेटाबोलिक कार्य
उभरते सबूत एफएक्सआर सक्रियण को ट्राइग्लिसराइड उपापचयी, ग्लूकोज उपापचयी और यकृत वृद्धि में परिवर्तन के साथ जोड़ते हैं।[7][21][19]
अन्य इंटरैक्शन
पित्त अम्ल उनके हार्मोन ग्राहियों (एफएक्सआर और TGR5) और उनके ट्रांसपोर्टरों के अतिरिक्त कुछ अन्य प्रोटीनों से जुड़ते हैं। इन प्रोटीन लक्ष्यों में, एंजाइम एन-एसिल फॉस्फेटिडाइलेथेनॉलमाइन-विशिष्ट फॉस्फोलिपेज़ डी (एनएपीई-पीएलडी) बायोएक्टिव लिपिड एमाइड्स उत्पन्न करता है (उदाहरण के लिए अंतर्जात भांग एनैनामाइड) जो तनाव और दर्द प्रतिक्रियाओं, भूख और जीवन काल सहित कई शारीरिक मार्गों में महत्वपूर्ण भूमिका निभाते हैं। एनएपीई-पीएलडी लिपिड एमाइड सिग्नल और पित्त अम्ल फिजियोलॉजी के बीच सीधा क्रॉस-टॉक ऑर्केस्ट्रेट करता है।[13][14]
नैदानिक महत्व
हाइपरलिपिडिमिया
चूंकि पित्त अम्ल अंतर्जात कोलेस्ट्रॉल से बने होते हैं, पित्त अम्लों के एंटरोहेपेटिक संचलन में व्यवधान कोलेस्ट्रॉल को कम करेगा। पित्त अम्ल अनुक्रमक पित्त अम्लों को आंत में बांधते हैं, पुन: अवशोषण को रोकते हैं। ऐसा करने में, अधिक अंतर्जात कोलेस्ट्रॉल को पित्त अम्लों के उत्पादन में धकेल दिया जाता है, जिससे कोलेस्ट्रॉल का स्तर कम हो जाता है। अनुक्रमित पित्त अम्ल तब मल में उत्सर्जित होते हैं।[22]
पित्तस्थिरता
पित्त अम्ल के लिए परीक्षण मानव और पशु चिकित्सा दोनों में उपयोगी होते हैं, क्योंकि वे कई स्थितियों के निदान में सहायता करते हैं, जिसमें गर्भावस्था के इंट्राहेपेटिक कोलेस्टेसिस, पोर्टोसिस्टमिक शंट, और कुत्तों में यकृत माइक्रोवास्कुलर डिसप्लेसिया जैसे कोलेस्टेसिस के प्रकार सम्मिलित हैं।[23] पित्त प्रणाली की संरचनात्मक या कार्यात्मक असामान्यताओं के परिणामस्वरूप रक्त में बिलीरुबिन (पीलिया) और पित्त अम्ल में वृद्धि होती है। पित्त अम्ल खुजली (प्रुरिटस) से संबंधित होते हैं जो कोलेस्टेटिक स्थितियों जैसे प्राथमिक पित्त सिरोसिस (पीबीसी), प्राइमरी स्केलेरोसिंग कोलिन्जाइटिस या गर्भावस्था के इंट्राहेपेटिक कोलेस्टेसिस में सामान्य है।[24] इन कोलेस्टेटिक विकारों में कई वर्षों से उर्सोडॉक्सिकोलिक अम्ल के साथ उपचार का उपयोग किया गया है।[25][26]
पित्त पथरी
पित्त अम्लों का पित्त में कोलेस्ट्रॉल की संतृप्ति और पित्त पथरी के उत्पादन के लिए कोलेस्ट्रॉल की वर्षा का बड़े पैमाने पर अध्ययन किया गया है। पित्त पथरी कोलेस्ट्रॉल या बिलीरुबिन की बढ़ी हुई संतृप्ति या पित्त ठहराव से हो सकती है। पित्त अम्ल या पित्त में फास्फोलिपिड्स की कम सांद्रता कोलेस्ट्रॉल घुलनशीलता को कम करती है और माइक्रोक्रिस्टल गठन की ओर ले जाती है। चेनोडॉक्सिकोलिक अम्ल और/या उर्सोडॉक्सिकोलिक अम्ल के साथ ओरल थेरेपी का उपयोग कोलेस्ट्रॉल पित्त पथरी को भंग करने के लिए किया गया है।[27][28][29] उपचार बंद करने पर पथरी पुनः हो सकती है। कुछ परिस्थितियों में पथरी को रोकने के लिए बाइल अम्ल थेरेपी महत्वपूर्ण हो सकती है, जैसे कि बेरिएट्रिक सर्जरी के बाद।[30]
पित्त अम्ल अतिसार
कोलन में पित्त अम्ल की अत्यधिक सांद्रता जीर्ण दस्त का कारण है। यह सामान्यतः पाया जाता है जब इलियम असामान्य होता है या शल्यचिकित्सा से हटा दिया जाता है, जैसा कि क्रोहन रोग में होता है, या ऐसी स्थिति उत्पन्न होती है जो अतिसार-प्रमुख चिड़चिड़ा आंत्र सिंड्रोम (आईबीएस-डी) जैसी होती है। पित्त अम्ल दस्त/पित्त अम्ल कुअवशोषण की इस स्थिति का सेएचसीएटी परीक्षण द्वारा निदान किया जा सकता है और पित्त अम्ल अनुक्रमक के साथ उपचार किया जा सकता है।[31]
पित्त अम्ल और पेट का कैंसर
कोलोरेक्टल कैंसर के विकास में पित्त अम्लों का कुछ महत्व हो सकता है।[32] उच्च वसा वाले आहार के जवाब में मनुष्यों की कोलोनिक सामग्री में डीऑक्सीकोलिक अम्ल (डीसीए) बढ़ जाता है।[33] कोलोरेक्टल कैंसर की उच्च घटनाओं वाली जनसंख्या में, पित्त अम्लों की मल सांद्रता अधिक होती है,[34][35] और इस संघ से पता चलता है कि पित्त अम्लों के संपर्क में वृद्धि कैंसर के विकास में भूमिका निभा सकती है। विशेष तुलना में, अफ्रीकी अमेरिकियों (जो उच्च वसा वाले आहार खाते हैं) की तुलना में दक्षिण अफ्रीका में मूल निवासी अफ्रीकियों (जो कम वसा वाले आहार खाते हैं) में मल डीसीए सांद्रता 7.30 के विपरीत 37.51 एनएमओएल/जी गीला वजन मल था।[36] दक्षिण अफ्रीका में मूल निवासी अफ्रीकियों में पेट के कैंसर की घटना दर, 72:100,000 पुरुष अफ्रीकी अमेरिकियों के लिए उच्च घटना दर की तुलना में 1:100,000 से कम है।[37][38]
प्रायोगिक अध्ययन भी पेट के कैंसर में पित्त अम्लों के तंत्र का सुझाव देते हैं। उच्च डीसीए सांद्रता के लिए कॉलोनिक कोशिकाओं का एक्सपोजर प्रतिक्रियाशील ऑक्सीजन प्रजातियों के गठन में वृद्धि करता है, जिससे ऑक्सीडेटिव तनाव होता है, और डीएनए क्षति भी बढ़ जाती है।[39] चूहे ने उच्च वसा वाले आहार पर मनुष्यों में कोलोनिक डीसीए के स्तर की नकल करने वाले अतिरिक्त डीसीए के साथ आहार खिलाया, ग्रंथ्यर्बुद स और ग्रंथिकर्कटता (कैंसर) सहित कोलोनिक सूजन विकसित किया, चूहों के विपरीत नियंत्रित आहार का उत्पादन किया जो कॉलोनिक डीसीए के स्तर का दसवां हिस्सा था, जिसमें कोई कोलोनिक नियोप्लासिया नहीं था।[40][41]
कोलोरेक्टल कैंसर के संकट को संशोधित करने में उर्सोडॉक्सिकोलिक अम्ल (यूडीसीए) के प्रभावों को कई अध्ययनों में देखा गया है, विशेष रूप से प्राइमरी स्क्लेरोसिंग चोलैगिटिस और सूजा आंत्र रोग में, आंशिक रूप से खुराक से संबंधित अलग-अलग परिणामों के साथ देखा गया है।[42][43] प्रमुख पित्त अम्ल संश्लेषण एंजाइम, सीवाईपी7ए1 में आनुवंशिक भिन्नता ने बड़े परीक्षण में कोलोरेक्टल एडेनोमा की रोकथाम में यूडीसीए की प्रभावशीलता को प्रभावित किया।[44]
त्वचाविज्ञान
अवांछित वसा को हटाने के लिए चमड़े के नीचे के इंजेक्शन में पित्त अम्ल का उपयोग किया जा सकता है (मेसोथेरेपी देखें)। इंजेक्शन के रूप में डीऑक्सीकोलिक अम्ल को सबमेंटल फैट को भंग करने के लिए एफडीए की स्वीकृति मिली है।[45] तीसरे चरण के परीक्षणों ने महत्वपूर्ण प्रतिक्रियाएँ दिखाईं, चूँकि कई विषयों में उपचारित क्षेत्र के आसपास चोट, सूजन, दर्द, सुन्नता, एरिथेमा और दृढ़ता की हल्की प्रतिकूल प्रतिक्रियाएँ थीं।[46][47]
संदर्भ
- ↑ Jump up to: 1.0 1.1 1.2 1.3 1.4 Hofmann AF, Hagey LR, Krasowski MD (February 2010). "Bile salts of vertebrates: structural variation and possible evolutionary significance". J. Lipid Res. 51 (2): 226–46. doi:10.1194/jlr.R000042. PMC 2803226. PMID 19638645.
- ↑ Jump up to: 2.0 2.1 2.2 2.3 2.4 2.5 2.6 Russell DW (2003). "पित्त अम्ल संश्लेषण के एंजाइम, विनियमन और आनुवंशिकी". Annu. Rev. Biochem. 72: 137–74. doi:10.1146/annurev.biochem.72.121801.161712. PMID 12543708.
- ↑ Jump up to: 3.0 3.1 3.2 3.3 3.4 3.5 3.6 3.7 Chiang JY (October 2009). "Bile acids: regulation of synthesis". J. Lipid Res. 50 (10): 1955–66. doi:10.1194/jlr.R900010-JLR200. PMC 2739756. PMID 19346330.
- ↑ Jump up to: 4.0 4.1 Carey, MC.; Small, DM. (Oct 1972). "पित्त लवण द्वारा मिसेल का निर्माण। भौतिक-रासायनिक और थर्मोडायनामिक विचार।". Arch Intern Med. 130 (4): 506–27. doi:10.1001/archinte.1972.03650040040005. PMID 4562149.
- ↑ Jump up to: 5.0 5.1 5.2 5.3 5.4 Hofmann AF (1999). "जिगर और आंतों के रोग में पित्त अम्लों का निरंतर महत्व". Arch. Intern. Med. 159 (22): 2647–58. doi:10.1001/archinte.159.22.2647. PMID 10597755.
- ↑ Jump up to: 6.0 6.1 Hofmann AF, Borgström B (February 1964). "The intraluminal phase of fat digestion in man: the lipid content of the micellar and oil phases of intestinal content obtained during fat digestion and absorption". J. Clin. Invest. 43 (2): 247–57. doi:10.1172/JCI104909. PMC 289518. PMID 14162533.
- ↑ Jump up to: 7.0 7.1 7.2 7.3 Fiorucci S, Mencarelli A, Palladino G, Cipriani S (November 2009). "Bile-acid-activated receptors: targeting TGR5 and farnesoid-X-receptor in lipid and glucose disorders". Trends Pharmacol. Sci. 30 (11): 570–80. doi:10.1016/j.tips.2009.08.001. PMID 19758712.
- ↑ 'Essentials of Medical Biochemistry, Lieberman, Marks and Smith, eds, p432, 2007'
- ↑ Jump up to: 9.0 9.1 9.2 Hofmann AF (October 1963). "वसा के अवशोषण में पित्त लवण का कार्य। संयुग्मित पित्त लवणों के तनु मिकेलर विलयनों के विलायक गुण". Biochem. J. 89 (1): 57–68. doi:10.1042/bj0890057. PMC 1202272. PMID 14097367.
- ↑ Li T, Chiang JY (2014). "चयापचय रोग और ड्रग थेरेपी में पित्त अम्ल संकेतन". Pharmacol. Rev. 66 (4): 948–83. doi:10.1124/pr.113.008201. PMC 4180336. PMID 25073467.
- ↑ Nagahashi M, Takabe K, Liu R, Peng K, Wang X, Wang Y, Hait NC, Wang X, Allegood JC, Yamada A, Aoyagi T, Liang J, Pandak WM, Spiegel S, Hylemon PB, Zhou H (2015). "Conjugated bile acid-activated S1P receptor 2 is a key regulator of sphingosine kinase 2 and hepatic gene expression". Hepatology. 61 (4): 1216–26. doi:10.1002/hep.27592. PMC 4376566. PMID 25363242.
- ↑ Wiemuth D, Sahin H, Falkenburger BH, Lefevre CM, Wasmuth HE, Grunder S (2012). "बेसिक - एक पित्त एसिड-संवेदनशील आयन चैनल पित्त नलिकाओं में अत्यधिक अभिव्यक्त होता है". FASEB J. 26 (10): 4122–30. doi:10.1096/fj.12-207043. PMID 22735174. S2CID 205369332.
- ↑ Jump up to: 13.0 13.1 Magotti P, Bauer I, Igarashi M, Babagoli M, Marotta R, Piomelli D, Garau G (2015). "Structure of Human N-Acylphosphatidylethanolamine-Hydrolyzing Phospholipase D: Regulation of Fatty Acid Ethanolamide Biosynthesis by Bile Acids". Structure. 23 (3): 598–604. doi:10.1016/j.str.2014.12.018. PMC 4351732. PMID 25684574.
- ↑ Jump up to: 14.0 14.1 Margheritis, E, Castellani B, Magotti P, Peruzzi S, Romeo E, Natali F, Mostarda S, Gioiello A, Piomelli D, Garau G (2016). "एनएपीई-पीएलडी द्वारा पित्त अम्ल की पहचान". ACS Chemical Biology. 11 (10): 2908–2914. doi:10.1021/acschembio.6b00624. PMC 5074845. PMID 27571266.
- ↑ Kulkarni AV, Tevethia HV, Arab JP, Candia R, Premkumar M, Kumar P, Sharma M, Reddy DN, Padaki NR (May 2021). "यकृत रोग में ओबेसिटोलिक एसिड की प्रभावकारिता और सुरक्षा-एक व्यवस्थित समीक्षा और मेटा-विश्लेषण". Clinics and Research in Hepatology and Gastroenterology. 45 (3): 101675. doi:10.1016/j.clinre.2021.101675. PMID 33722778. S2CID 232242410.
- ↑ Makishima M, Okamoto AY, Repa JJ, et al. (May 1999). "पित्त अम्लों के लिए एक परमाणु रिसेप्टर की पहचान". Science. 284 (5418): 1362–5. Bibcode:1999Sci...284.1362M. doi:10.1126/science.284.5418.1362. PMID 10334992.
- ↑ Parks DJ, Blanchard SG, Bledsoe RK, et al. (May 1999). "Bile acids: natural ligands for an orphan nuclear receptor". Science. 284 (5418): 1365–8. Bibcode:1999Sci...284.1365P. doi:10.1126/science.284.5418.1365. PMID 10334993.
- ↑ Wang H, Chen J, Hollister K, Sowers LC, Forman BM (May 1999). "Endogenous bile acids are ligands for the nuclear receptor FXR/BAR". Mol. Cell. 3 (5): 543–53. doi:10.1016/s1097-2765(00)80348-2. PMID 10360171.
- ↑ Jump up to: 19.0 19.1 Chiang JY, Ferrell JM (March 2020). "Bile acid receptors FXR and TGR5 signaling in fatty liver diseases and therapy". American Journal of Physiology. Gastrointestinal and Liver Physiology. 318 (3): G554–G573. doi:10.1152/ajpgi.00223.2019. PMC 7099488. PMID 31984784.
- ↑ Kim, I; Ahn, SH; Inagaki, T; Choi, M; Ito, S; Guo, GL; Kliewer, SA; Gonzalez, FJ (2007). "लिवर और आंत में फ़ार्नेसॉइड एक्स रिसेप्टर द्वारा पित्त एसिड होमियोस्टेसिस का विभेदक विनियमन". Journal of Lipid Research. 48 (12): 2664–72. doi:10.1194/jlr.M700330-JLR200. PMID 17720959.
- ↑ Shapiro, Hagit; Kolodziejczyk, Aleksandra A.; Halstuch, Daniel; Elinav, Eran (2018-01-16). "स्वास्थ्य और रोग में ग्लूकोज चयापचय में पित्त अम्ल". Journal of Experimental Medicine (in English). 215 (2): 383–396. doi:10.1084/jem.20171965. ISSN 0022-1007. PMC 5789421. PMID 29339445.
- ↑ Davidson MH (2011). "फैमिलियल हाइपरकोलेस्ट्रोलेमिया वाले बच्चों में पित्त एसिड सिक्वेस्ट्रेंट थेरेपी की एक व्यवस्थित समीक्षा". J Clin Lipidol. 5 (2): 76–81. doi:10.1016/j.jacl.2011.01.005. PMID 21392720.
- ↑ Allen L, Stobie D, Mauldin GN, Baer KE (January 1999). "Clinicopathologic features of dogs with hepatic microvascular dysplasia with and without portosystemic shunts: 42 cases (1991-1996)". J. Am. Vet. Med. Assoc. 214 (2): 218–20. PMID 9926012.
- ↑ Pusl T, Beuers U (2007). "गर्भावस्था के इंट्राहेपेटिक कोलेस्टेसिस". Orphanet J Rare Dis. 2: 26. doi:10.1186/1750-1172-2-26. PMC 1891276. PMID 17535422.
- ↑ Poupon RE, Balkau B, Eschwège E, Poupon R (May 1991). "प्राथमिक पित्त सिरोसिस के उपचार के लिए ursodiol का एक बहुकेंद्र, नियंत्रित परीक्षण। यूडीसीए-पीबीसी स्टडी ग्रुप". N. Engl. J. Med. 324 (22): 1548–54. doi:10.1056/NEJM199105303242204. PMID 1674105.
- ↑ Glantz A, Marschall HU, Lammert F, Mattsson LA (December 2005). "Intrahepatic cholestasis of pregnancy: a randomized controlled trial comparing dexamethasone and ursodeoxycholic acid". Hepatology. 42 (6): 1399–405. doi:10.1002/hep.20952. PMID 16317669. S2CID 19147632.
- ↑ Danzinger RG, Hofmann AF, Schoenfield LJ, Thistle JL (January 1972). "चेनोडॉक्सिकोलिक एसिड द्वारा कोलेस्ट्रॉल पित्त पथरी का विघटन". N. Engl. J. Med. 286 (1): 1–8. doi:10.1056/NEJM197201062860101. PMID 5006919.
- ↑ Thistle JL, Hofmann AF (September 1973). "पित्त पथरी को भंग करने के लिए चेनोडॉक्सिकोलिक एसिड थेरेपी की प्रभावकारिता और विशिष्टता". N. Engl. J. Med. 289 (13): 655–9. doi:10.1056/NEJM197309272891303. PMID 4580472.
- ↑ Petroni ML, Jazrawi RP, Pazzi P, et al. (January 2001). "Ursodeoxycholic acid alone or with chenodeoxycholic acid for dissolution of cholesterol gallstones: a randomized multicentre trial. The British-Italian Gallstone Study group". Aliment. Pharmacol. Ther. 15 (1): 123–8. doi:10.1046/j.1365-2036.2001.00853.x. PMID 11136285.
- ↑ Uy MC, Talingdan-Te MC, Espinosa WZ, Daez ML, Ong JP (December 2008). "Ursodeoxycholic acid in the prevention of gallstone formation after bariatric surgery: a meta-analysis". Obes Surg. 18 (12): 1532–8. doi:10.1007/s11695-008-9587-7. PMID 18574646. S2CID 207302960.
- ↑ Pattni, S; Walters, JR (2009). "पित्त अम्ल malabsorption की समझ में हालिया प्रगति". British Medical Bulletin. 92: 79–93. doi:10.1093/bmb/ldp032. PMID 19900947.
- ↑ Degirolamo C, Modica S, Palasciano G, Moschetta A (2011). "Bile acids and colon cancer: Solving the puzzle with nuclear receptors". Trends Mol Med. 17 (10): 564–72. doi:10.1016/j.molmed.2011.05.010. PMID 21724466.
- ↑ Reddy BS, Hanson D, Mangat S, et al. (September 1980). "फेकल बैक्टीरियल एंजाइम और फेकल पित्त एसिड और न्यूट्रल स्टेरोल्स पर उच्च वसा, उच्च बीफ आहार और आहार में बीफ पकाने की विधि का प्रभाव". J. Nutr. 110 (9): 1880–7. doi:10.1093/jn/110.9.1880. PMID 7411244.
- ↑ Hill MJ (May 1990). "पित्त प्रवाह और पेट का कैंसर". Mutat. Res. 238 (3): 313–20. doi:10.1016/0165-1110(90)90023-5. PMID 2188127.
- ↑ Cheah PY (1990). "कोलोरेक्टल कैंसर के एटियलजि के लिए परिकल्पना - एक सिंहावलोकन". Nutr Cancer. 14 (1): 5–13. doi:10.1080/01635589009514073. PMID 2195469.
- ↑ Ou J, DeLany JP, Zhang M, Sharma S, O'Keefe SJ (2012). "उच्च कोलन कैंसर जोखिम आबादी में कम कॉलोनिक शॉर्ट-चेन फैटी एसिड और उच्च पित्त एसिड के बीच संबंध". Nutr Cancer. 64 (1): 34–40. doi:10.1080/01635581.2012.630164. PMC 6844083. PMID 22136517.
- ↑ O'Keefe SJ, Kidd M, Espitalier-Noel G, Owira P (May 1999). "अफ्रीकियों में पेट के कैंसर की दुर्लभता कम पशु उत्पाद की खपत से जुड़ी है, फाइबर की नहीं". Am. J. Gastroenterol. 94 (5): 1373–80. doi:10.1111/j.1572-0241.1999.01089.x. PMID 10235221. S2CID 6402410.
- ↑ American Cancer Society. Cancer Facts and Figures 2009. http://www.cancer.org/Research/CancerFactsFigures/cancer-facts-figures-2009
- ↑ Bernstein H, Bernstein C, Payne CM, Dvorak K (July 2009). "गैस्ट्रोइंटेस्टाइनल कैंसर में अंतर्जात एटिऑलॉजिक एजेंट के रूप में पित्त अम्ल". World J. Gastroenterol. 15 (27): 3329–40. doi:10.3748/wjg.15.3329. PMC 2712893. PMID 19610133.
- ↑ Bernstein C, Holubec H, Bhattacharyya AK, et al. (August 2011). "डीऑक्सीकोलेट की कैंसरजन्यता, एक द्वितीयक पित्त अम्ल". Arch. Toxicol. 85 (8): 863–71. doi:10.1007/s00204-011-0648-7. PMC 3149672. PMID 21267546.
- ↑ Prasad AR, Prasad S, Nguyen H, Facista A, Lewis C, Zaitlin B, Bernstein H, Bernstein C (Jul 2014). "कोलन कैंसर का उपन्यास आहार-संबंधी माउस मॉडल मानव कोलन कैंसर के समानांतर है". World J Gastrointest Oncol. 6 (7): 225–43. doi:10.4251/wjgo.v6.i7.225. PMC 4092339. PMID 25024814.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Singh S, Khanna S, Pardi DS, Loftus EV, Talwalkar JA (2013). "Effect of ursodeoxycholic acid use on the risk of colorectal neoplasia in patients with primary sclerosing cholangitis and inflammatory bowel disease: a systematic review and meta-analysis". Inflamm. Bowel Dis. 19 (8): 1631–8. doi:10.1097/MIB.0b013e318286fa61. PMID 23665966. S2CID 39918727.
- ↑ Eaton JE, Silveira MG, Pardi DS, Sinakos E, Kowdley KV, Luketic VA, Harrison ME, McCashland T, Befeler AS, Harnois D, Jorgensen R, Petz J, Lindor KD (2011). "उच्च खुराक ursodeoxycholic एसिड अल्सरेटिव कोलाइटिस और प्राथमिक स्क्लेरोसिंग कोलांगिटिस वाले मरीजों में कोलोरेक्टल नियोप्लासिया के विकास से जुड़ा हुआ है". Am. J. Gastroenterol. 106 (9): 1638–45. doi:10.1038/ajg.2011.156. PMC 3168684. PMID 21556038.
- ↑ Wertheim BC, Smith JW, Fang C, Alberts DS, Lance P, Thompson PA (2012). "Risk modification of colorectal adenoma by CYP7A1 polymorphisms and the role of bile acid metabolism in carcinogenesis". Cancer Prev Res (Phila). 5 (2): 197–204. doi:10.1158/1940-6207.CAPR-11-0320. PMC 3400261. PMID 22058145.
- ↑ "डीऑक्सीकोलिक एसिड इंजेक्शन". Medline plus. Retrieved 26 August 2015.
- ↑ Ascher B, Hoffmann K, Walker P, Lippert S, Wollina U, Havlickova B (2014). "Efficacy, patient-reported outcomes and safety profile of ATX-101 (deoxycholic acid), an injectable drug for the reduction of unwanted submental fat: results from a phase III, randomized, placebo-controlled study". J Eur Acad Dermatol Venereol. 28 (12): 1707–15. doi:10.1111/jdv.12377. PMC 4263247. PMID 24605812.
- ↑ Wollina U, Goldman A (2015). "सबमेंटल फैट को कम करने के लिए ATX-101।". Expert Opin Pharmacother. 16 (5): 755–62. doi:10.1517/14656566.2015.1019465. PMID 25724831. S2CID 23094631.
बाहरी संबंध
- Bile Acids and Salts at the US National Library of Medicine Medical Subject Headings (MeSH)
- Special Issue on "Bile Acids"