रूथेनियम (IV) ऑक्साइड
| |
| Names | |
|---|---|
| IUPAC name
Ruthenium(IV) oxide
| |
| Other names
Ruthenium dioxide
| |
| Identifiers | |
3D model (JSmol)
|
|
| EC Number |
|
PubChem CID
|
|
| Properties | |
| RuO2 | |
| Molar mass | 133.0688 g/mol |
| Appearance | blue-black solid |
| Density | 6.97 g/cm3 |
| Boiling point | 1,200 °C (2,190 °F; 1,470 K) sublimates |
| insoluble | |
| +162.0·10−6 cm3/mol | |
| Structure | |
| Rutile (tetragonal), tP6 | |
| P42/mnm, No. 136 | |
| Octahedral (RuIV); trigonal planar (O2−) | |
| Hazards | |
| Flash point | Non-flammable |
| Related compounds | |
Other anions
|
Ruthenium disulfide |
Other cations
|
Osmium(IV) oxide |
| Ruthenium tetroxide | |
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
| |
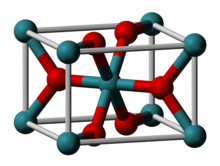
रूथेनियम (IV) ऑक्साइड RuO2 सूत्र वाला एक अकार्बनिक यौगिक है। यह काला ठोस रूथेनियम का सबसे सामान्य ऑक्साइड है। इसका व्यापक रूप से क्लोरीन, क्लोरीन ऑक्साइड और O2 के उत्पादन के लिए विद्युत उत्प्रेरक के रूप में उपयोग किया जाता है। [1] कई डाइऑक्साइड की तरह, RuO2 रूटाइल संरचना को अपनाता है। [2][3]
तैयारी
यह सामान्यतः रूथेनियम ट्राइक्लोराइड के ऑक्सीकरण द्वारा तैयार किया जाता है। अभिगमन कर्ता के रूप में O2 का उपयोग करके, RuO2 के लगभग तत्वानुपातकीय एकल स्फटिक रासायनिक वाष्प अभिगमन द्वारा प्राप्त किए जा सकते हैं: [4][5]
- RuO2 + O2 ⇌ RuO4
RuO2 की परत वाष्पशील रूथेनियम यौगिकों से रासायनिक वाष्प जमाव (सीवीडी) द्वारा तैयार किया जा सकता है। [6] RuO2 रूथेनियम ट्राइक्लोराइड के घोल से विद्युत आवरण के माध्यम से भी तैयार किया जा सकता है। [7]
जलीय घोल में रूथेनियम टेट्रोक्साइड की स्व उत्प्रेरक कमी का उपयोग करके प्राचीन रूथेनियम डाइऑक्साइड हाइड्रेट के स्थिर वैद्युत भंडारण रूप से स्थिर जलविलय तैयार किए गए हैं। परिणामी कण आबादी को 40 एनएम - 160 एनएम की सीमा में व्यास वाले काफी हद तक समकणपरिक्षेपी, समान क्षेत्रों को सम्मिलित करने के लिए नियंत्रित किया जा सकता है। [8]
उपयोग
रूथेनियम (IV) ऑक्साइड का उपयोग सुमितोमो-डीकॉन प्रक्रिया के उत्प्रेरक में मुख्य घटक के रूप में किया जा रहा है जो हाइड्रोजन क्लोराइड के ऑक्सीकरण द्वारा क्लोरीन का उत्पादन करता है।[9][10]
RuO2 कई अन्य स्थितियों में उत्प्रेरक के रूप में उपयोग किया जा सकता है। उल्लेखनीय प्रतिक्रियाएँ फिशर-ट्रॉप्स प्रक्रिया, हैबर-बॉश प्रक्रिया और ईंधन कोशिकाओं की विभिन्न अभिव्यक्तियाँ हैं।
आकांक्षापूर्ण और विशिष्ट अनुप्रयोग
RuO2 क्लोरीन के इलेक्ट्रोलाइटिक उत्पादन और प्रतिरोधों या संबद्ध परिपथ की तैयारी के लिए टाइटेनियम एनोड की कोटिंग के लिए बड़े मापक्रम पर उपयोग किया जाता है। [11][12] रूथेनियम ऑक्साइड प्रतिरोधकों का उपयोग तापमान सीमा .02 < T < 4 K में संवेदनशील थर्मामीटर के रूप में किया जा सकता है। इसका उपयोग सुपरकैपेसिटर में सक्रिय सामग्री के रूप में भी किया जा सकता है क्योंकि इसमें आवेश स्थानान्तरण क्षमता बहुत अधिक है। जलीय घोल में उपयोग किए जाने पर रूथेनियम ऑक्साइड में आवेश जमा करने की बड़ी क्षमता होती है। [13] H2SO4 विलयन में होने पर रूथेनियम (IV) ऑक्साइड की औसत क्षमता 650 एफ/जी तक पहुंच गई है और 200°C से कम तापमान पर तापानुशीतित किया जाता है। [14] इसके कैपेसिटिव गुणों को अनुकूलित करने के प्रयासों में, पूर्व कार्य में रूथेनियम ऑक्साइड के जलयोजन, इसकी स्फटिकता और कण आकार पर ध्यान दिया गया है।
संदर्भ
- ↑ Mills, Andrew (1989). "ऑक्सीजन और क्लोरीन विकास के लिए विषम रेडॉक्स उत्प्रेरक". Chemical Society Reviews. Royal Society of Chemistry (RSC). 18: 285. doi:10.1039/cs9891800285. ISSN 0306-0012.
- ↑ Wyckoff, R.W.G.. Crystal Structures, Vol. 1. Interscience, John Wiley & Sons: 1963.
- ↑ Wells, A. F. (1975), Structural Inorganic Chemistry (4th ed.), Oxford: Clarendon Press
- ↑ Schäfer, Harald; Schneidereit, Gerd; Gerhardt, Wilfried (1963). "Zur Chemie der Platinmetalle. RuO2 Chemischer Transport, Eigenschaften, thermischer Zerfall". Zeitschrift für anorganische und allgemeine Chemie (in Deutsch). Wiley. 319 (5–6): 327–336. doi:10.1002/zaac.19633190514. ISSN 0044-2313.
- ↑ Rogers, D. B.; Butler, S. R.; Shannon, R. D. (1972). "Single Crystals of Transition-Metal Dioxides". अकार्बनिक संश्लेषण. अकार्बनिक संश्लेषण. Vol. XIII. pp. 135–145. doi:10.1002/9780470132449.ch27. ISBN 9780470132449.
- ↑ Pizzini, S.; Buzzanca, G.; Mari, C.; Rossi, L.; Torchio, S. (1972). "मोटी रूथेनियम डाइऑक्साइड फिल्मों की तैयारी, संरचना और विद्युत गुण". Materials Research Bulletin. Elsevier BV. 7 (5): 449–462. doi:10.1016/0025-5408(72)90147-x. ISSN 0025-5408.
- ↑ Lee, S. (2003). "अनाकार रूथेनियम ऑक्साइड पतली फिल्मों का इलेक्ट्रोक्रोमिज्म". Solid State Ionics. 165 (1–4): 217–221. doi:10.1016/j.ssi.2003.08.035.
- ↑ McMurray, H. N. (1993). "रूथेनियम टेट्रोक्साइड की सतह-उत्प्रेरित कमी से रूथेनियम डाइऑक्साइड हाइड्रेट के समान कोलाइड विकसित हुए". The Journal of Physical Chemistry. 97 (30): 8039–8045. doi:10.1021/j100132a038.
- ↑ Vogt, Helmut; Balej, Jan; Bennett, John E.; Wintzer, Peter; Sheikh, Saeed Akbar; Gallone, Patrizio (2000-06-15), "Chlorine Oxides and Chlorine Oxygen Acids", Ullmann's Encyclopedia of Industrial Chemistry, Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA, doi:10.1002/14356007.a06_483, ISBN 3527306730
- ↑ Seki, Kohei (2010-05-29). "Development of RuO2/Rutile-TiO2 Catalyst for Industrial HCl Oxidation Process". Catalysis Surveys from Asia. Springer Science and Business Media LLC. 14 (3–4): 168–175. doi:10.1007/s10563-010-9091-7. ISSN 1571-1013. S2CID 93115959.
- ↑ De Nora, O. (1970). "Anwendung maßbeständiger aktivierter Titan-Anoden bei der Chloralkali-Elektrolyse". Chemie Ingenieur Technik. Wiley. 42 (4): 222–226. doi:10.1002/cite.330420417. ISSN 0009-286X.
- ↑ Iles, G.S. (1967). "रूथेनियम ऑक्साइड ग्लेज़ प्रतिरोधी". Platinum Metals Review. 11 (4): 126.
- ↑ Matthey, Johnson (2002). "Nanocrystalline Ruthenium Supercapacitor Material". Platinum Metals Review. 46 (3): 105.
- ↑ Kim,Il-Hwan; Kim, Kwang-Bum; Electrochem. Solid-State Lett., 2001, 4, 5,A62-A64