वैद्युत-रासायनिक सेल
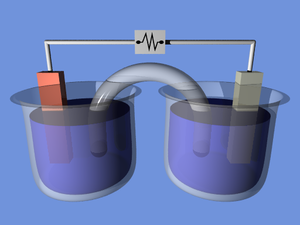
वैद्युत-रासायनिक सेल (इलेक्ट्रोकेमिकल सेल) एक उपकरण है जो या तो रासायनिक प्रतिक्रियाओं से विद्युत ऊर्जा उत्पन्न करने में या रासायनिक प्रतिक्रियाओं के कारण विद्युत ऊर्जा का उपयोग करने में सक्षम है। इलेक्ट्रोकेमिकल सेल जो विद्युत प्रवाह उत्पन्न करते हैं उन्हें वोल्टाइक या बिजली उत्पन्न करनेवाली सेल कहा जाता है और जो रासायनिक प्रतिक्रिया उत्पन्न करते हैं, उदाहरण के लिए इलेक्ट्रोलीज़ के माध्यम से, इलेक्ट्रोलाइटिक सेल कहलाते हैं। [1][2][better source needed] गैल्वेनिक सेल का सामान्य उदाहरण एक मानक 1.5 वोल्ट सेल है[3] उपभोक्ता उपयोग के लिए अभिप्रेत है। बैटरी (बिजली) में एक या एक से अधिक सेल होते हैं, जो श्रृंखला और समानांतर सर्किट में जुड़े होते हैं | समानांतर, श्रृंखला या श्रृंखला-और-समानांतर पैटर्न।
इलेक्ट्रोलाइटिक सेल

इलेक्ट्रोलाइटिक सेल एक इलेक्ट्रोकेमिकल सेल है जो विद्युत ऊर्जा के अनुप्रयोग के माध्यम से गैर-सहज रेडोक्स प्रतिक्रिया को चलाता है। वे अधिकांशतः इलेक्ट्रोलिसिस नामक प्रक्रिया में रासायनिक यौगिकों को विघटित करने के लिए उपयोग किए जाते हैं - ग्रीक शब्द लिसिस का अर्थ है टूटना।
इलेक्ट्रोलिसिस के महत्वपूर्ण उदाहरण पानी का हाइड्रोजन और ऑक्सीजन में अपघटन, और बाक्साइट का अल्युमीनियम और अन्य रसायनों में अपघटन है। इलेक्ट्रोप्लेटिंग (जैसे तांबा, चांदी, निकल या क्रोमियम) इलेक्ट्रोलाइटिक सेल का उपयोग करके किया जाता है। इलेक्ट्रोलिसिस, ऐसी तकनीक है जो प्रत्यक्ष विद्युत प्रवाह (डीसी) का उपयोग करती है।
इलेक्ट्रोलाइटिक सेल में तीन घटक भाग होते हैं: इलेक्ट्रोलाइट और इलेक्ट्रोड ( कैथोड और एनोड)। इलेक्ट्रोलाइट सामान्यतः पानी या अन्य विलायक का मिश्रण (रसायन विज्ञान) होता है जिसमें आयन घुल जाते हैं। पिघला हुआ नमक जैसे सोडियम क्लोराइड भी इलेक्ट्रोलाइट्स होते हैं। जब इलेक्ट्रोड पर लगाए गए बाहरी वोल्टेज द्वारा संचालित होता है, तो इलेक्ट्रोलाइट में आयन विपरीत चार्ज वाले इलेक्ट्रोड की ओर आकर्षित होते हैं, जहां चार्ज-ट्रांसफरिंग (जिसे फैराडिक या रेडॉक्स भी कहा जाता है) प्रतिक्रियाएं हो सकती हैं। केवल सही ध्रुवता और पर्याप्त परिमाण की बाहरी विद्युत क्षमता (यानी वोल्टेज) के साथ इलेक्ट्रोलाइटिक सेल समाधान में सामान्य रूप से स्थिर, या रासायनिक रूप से निष्क्रिय रासायनिक यौगिक को विघटित कर सकता है। प्रदान की गई विद्युत ऊर्जा रासायनिक प्रतिक्रिया उत्पन्न कर सकती है जो व्यर्थ नहीं होगी।
गैल्वेनिक सेल या वोल्टाइक सेल
गैल्वेनिक सेल, या वोल्टाइक सेल, जिसका नाम क्रमशः लुइगी गलवानी या अलेक्जेंडर वोल्टा के नाम पर रखा गया है, इलेक्ट्रोकेमिकल सेल है जो सेल के अंदर होने वाली सहज रेडॉक्स प्रतिक्रियाओं से विद्युत ऊर्जा प्राप्त करता है। यह सामान्यतः एक साल्ट ब्रिज से जुड़े दो अलग-अलग धातु होते हैं, या झरझरा झिल्ली से अलग-अलग अर्ध-कोशिकाएं होती हैं।
वोल्टा वोल्टाइक ढेर, पहली बैटरी (बिजली) का आविष्कारक था। सामान्य उपयोग में, बैटरी शब्द में एकल गैल्वेनिक सेल सम्मिलित हो गया है, लेकिन एक बैटरी में ठीक से कई सेल होते हैं।[4]
प्राथमिक सेल
प्राथमिक सेल एक गैल्वेनिक बैटरी (बिजली) है जिसे एक बार उपयोग करने और त्यागने के लिए डिज़ाइन किया गया है, द्वितीयक सेल (रिचार्जेबल बैटरी) के विपरीत, जिसे बिजली से रिचार्ज किया जा सकता है और पुन: उपयोग किया जा सकता है। सामान्यतः, सेल में होने वाली इलेक्ट्रोकैमिस्ट्री रासायनिक प्रतिक्रिया उत्क्रमणीय नहीं होती है, जिससे सेल अपरिवर्तनीय हो जाती है। प्राथमिक सेल के रूप में उपयोग किया जाता है, बैटरी में रासायनिक प्रतिक्रियाएं शक्ति उत्पन्न करने वाले रसायनों का उपयोग करती हैं; जब वे चले जाते हैं, तो बैटरी बिजली पैदा करना बंद कर देती है और व्यर्थ हो जाती है। इसके विपरीत, द्वितीयक सेल में, रासायनिक अभिकारकों को पुन: उत्पन्न करने के लिए बैटरी चार्जर के साथ सेल में करंट चलाकर प्रतिक्रिया को उल्टा किया जा सकता है। छोटे घरेलू उपकरणों जैसे टॉर्च और पोर्टेबल रेडियो को बिजली देने के लिए प्राथमिक सेल को कई मानक आकारों में बनाया जाता है।
प्राथमिक बैटरियां $50 बिलियन के बैटरी बाजार का लगभग 90% हिस्सा बनाती हैं, लेकिन द्वितीयक बैटरियां बाजार में हिस्सेदारी प्राप्त कर रही हैं। दुनिया भर में हर साल लगभग 15 अरब प्राथमिक बैटरियां फेंक दी जाती हैं, वस्तुतः सभी लैंडफिल में समाप्त हो जाती हैं। जहरीले भारी धातु (रसायन) और मजबूत एसिड या क्षार के कारण बैटरी भयानक अपशिष्ट हैं। अधिकांश नगरपालिकाएं उन्हें इस प्रकार वर्गीकृत करती हैं और अलग निपटान की आवश्यकता होती है। बैटरी बनाने के लिए आवश्यक ऊर्जा उसमें निहित ऊर्जा से लगभग 50 गुना अधिक होती है।[5][6][7][8][better source needed] उनकी छोटी ऊर्जा सामग्री की तुलना में उनकी उच्च प्रदूषक सामग्री के कारण, प्राथमिक बैटरी को बेकार, पर्यावरण की दृष्टि से अमित्र तकनीक माना जाता है। मुख्य रूप से वायरलेस उपकरणों और ताररहित की बढ़ती बिक्री के कारण, जो प्राथमिक बैटरी द्वारा आर्थिक रूप से संचालित नहीं हो सकते हैं और इंटीग्रल रिचार्जेबल बैटरी के साथ आते हैं, माध्यमिक बैटरी उद्योग में उच्च वृद्धि हुई है और धीरे-धीरे प्राथमिक बैटरी को उच्च अंत उत्पादों में बदल रहा है।
द्वितीयक सेल
द्वितीयक सेल, जिसे सामान्यतः रिचार्जेबल बैटरी कहा जाता है, इलेक्ट्रोकेमिकल सेल है जिसे गैल्वेनिक सेल और इलेक्ट्रोलाइटिक सेल दोनों के रूप में चलाया जा सकता है। इसका उपयोग बिजली को स्टोर करने के सुविधाजनक तरीके के रूप में किया जाता है: जब धारा एक तरफ बहती है, तो एक या अधिक रसायनों का स्तर जमा हो जाता है (चार्जिंग); जबकि यह डिस्चार्ज हो रहा है, वे कम हो जाते हैं और परिणामी इलेक्ट्रोमोटिव बल काम कर सकता है।
एक सामान्य द्वितीयक सेल लेड-एसिड बैटरी है। यह सामान्यतः कार बैटरी के रूप में पाया जा सकता है। उनका उपयोग उनके उच्च वोल्टेज, कम क्रयमुल्या, विश्वसनीयता और लंबे जीवनकाल के लिए किया जाता है। लेड-एसिड बैटरी का उपयोग ऑटोमोबाइल में इंजन को चालू करने और इंजन के न चलने पर कार के विद्युत उपकरणों को संचालित करने के लिए किया जाता है। अल्टरनेटर, कार के चलने के बाद, बैटरी को रिचार्ज करता है।
ईंधन सेल
ईंधन सेल एक इलेक्ट्रोकेमिकल सेल है जो ऑक्सीजन या किसी अन्य ऑक्सीकरण एजेंट के साथ हाइड्रोजन ईंधन की इलेक्ट्रोकैमिस्ट्री प्रतिक्रिया के माध्यम से रासायनिक ऊर्जा को ईंधन से बिजली में परिवर्तित करता है।[9] रासायनिक प्रतिक्रिया को बनाए रखने के लिए ईंधन और ऑक्सीजन (सामान्यतः हवा से) के निरंतर स्रोत की आवश्यकता में ईंधन सेल बैटरी (बिजली) से अलग होते हैं, जबकि बैटरी में रासायनिक ऊर्जा बैटरी में पहले से उपस्थित रसायनों से आती है। जब तक ईंधन और ऑक्सीजन की आपूर्ति की जाती है तब तक ईंधन सेल लगातार बिजली का उत्पादन कर सकते हैं।
पहली ईंधन सेल का आविष्कार 1838 में किया गया था। ईंधन सेल का पहला व्यावसायिक उपयोग एक सदी से भी अधिक समय बाद नासा के अंतरिक्ष कार्यक्रमों में उपग्रहों और अंतरिक्ष कैप्सूल के लिए शक्ति उत्पन्न करने के लिए किया गया था। तब से, कई अन्य अनुप्रयोगों में ईंधन सेल का उपयोग किया गया है। वाणिज्यिक, औद्योगिक और आवासीय भवनों और दूरस्थ या दुर्गम क्षेत्रों में प्राथमिक और बैकअप शक्ति के लिए ईंधन सेल का उपयोग किया जाता है। उनका उपयोग फोर्कलिफ्ट, ऑटोमोबाइल, बसों, नावों, मोटरसाइकिलों और पनडुब्बियों सहित ईंधन सेल वाहनों को बिजली देने के लिए भी किया जाता है।
ईंधन सेल कई प्रकार के होते हैं, लेकिन उन सभी में एनोड, कैथोड और इलेक्ट्रोलाइट होता है जो सकारात्मक रूप से आवेशित हाइड्रोजन आयनों (प्रोटॉन) को ईंधन सेल के दोनों किनारों के बीच स्थानांतरित करने की अनुमति देता है। एनोड पर एक उत्प्रेरक ईंधन को ऑक्सीकरण प्रतिक्रियाओं से गुजरने का कारण बनता है जो प्रोटॉन (सकारात्मक रूप से आवेशित हाइड्रोजन आयन) और इलेक्ट्रॉन उत्पन्न करते हैं। प्रतिक्रिया के बाद प्रोटॉन इलेक्ट्रोलाइट के माध्यम से एनोड से कैथोड तक प्रवाहित होते हैं। उसी समय, इलेक्ट्रॉनों को बाहरी सर्किट के माध्यम से एनोड से कैथोड तक खींचा जाता है, जो प्रत्यक्ष वर्तमान बिजली का उत्पादन करता है। कैथोड पर, एक अन्य उत्प्रेरक प्रतिक्रिया करने के लिए हाइड्रोजन आयनों, इलेक्ट्रॉनों और ऑक्सीजन का कारण बनता है, जिससे पानी बनता है। ईंधन सेल को उनके द्वारा उपयोग किए जाने वाले इलेक्ट्रोलाइट के प्रकार और स्टार्टअप समय में अंतर के आधार पर वर्गीकृत किया जाता है, जो प्रोटॉन-एक्सचेंज झिल्ली ईंधन सेल (PEM ईंधन सेल, या PEMFC) के लिए 1 सेकंड से लेकर ठोस ऑक्साइड ईंधन सेल (SOFC) के लिए 10 मिनट तक होता है। संबंधित तकनीक फ्लो बैटरी है, जिसमें ईंधन को रिचार्ज करके पुन: उत्पन्न किया जा सकता है। व्यक्तिगत ईंधन सेल अपेक्षाकृत कम विद्युत क्षमता उत्पन्न करते हैं, लगभग 0.7 वोल्ट, इसलिए किसी अनुप्रयोग की आवश्यकताओं को पूरा करने के लिए पर्याप्त वोल्टेज बनाने के लिए सेल को स्टैक किया जाता है, या श्रृंखला में रखा जाता है।[10] बिजली के अतिरिक्त, ईंधन सेल पानी, गर्मी और ईंधन स्रोत के आधार पर बहुत कम मात्रा में नाइट्रोजन डाइऑक्साइड और अन्य उत्सर्जन पैदा करते हैं। ईंधन सेल की ऊर्जा दक्षता सामान्यतः 40 और 60% के बीच होती है; चूंकि, यदि अपशिष्ट ऊष्मा को सह-उत्पादन स्कीम में कैप्चर किया जाता है, तो 85% तक की दक्षता प्राप्त की जा सकती है।
ईंधन सेल व्यापार बढ़ रहा है, और 2013 में पाइक रिसर्च ने अनुमान लगाया था कि स्थिर ईंधन सेल व्यापार 2020 तक 50 GW तक पहुंच जाएगा।[11]
अर्ध-सेल
इलेक्ट्रोकेमिकल सेल में दो अर्ध सेल होते हैं। प्रत्येक अर्ध-सेल में इलेक्ट्रोड और इलेक्ट्रोलाइट होता है। दो अर्ध सेल एक ही इलेक्ट्रोलाइट का उपयोग कर सकते हैं, या वे अलग-अलग इलेक्ट्रोलाइट्स का उपयोग कर सकते हैं। सेल में रासायनिक प्रतिक्रियाओं में इलेक्ट्रोलाइट, इलेक्ट्रोड, या बाहरी पदार्थ सम्मिलित हो सकता है (जैसे कि ईंधन सेल में जो हाइड्रोजन गैस को अभिकारक के रूप में उपयोग कर सकते हैं)। एक पूर्ण इलेक्ट्रोकेमिकल सेल में, अर्ध सेल की प्रजातियां अपने इलेक्ट्रोड से इलेक्ट्रॉनों (रेडॉक्स) को खो देती हैं जबकि अन्य अर्ध सेल की प्रजातियां अपने इलेक्ट्रोड से इलेक्ट्रॉनों (रेडॉक्स) प्राप्त करती हैं।
एक साल्ट ब्रिज (उदाहरण के लिए, फ़िल्टर पेपर KNO3, NaCl, या कुछ अन्य इलेक्ट्रोलाइट) को अक्सर अलग-अलग इलेक्ट्रोलाइट्स के साथ दो अर्ध-सेल के बीच आयनिक संपर्क प्रदान करने के लिए नियोजित किया जाता है, फिर भी समाधानों को मिश्रित होने और अवांछित पक्ष प्रतिक्रियाओं के कारण रोकता है। साल्ट ब्रिज का एक विकल्प दो अर्ध-सेल के बीच सीधे संपर्क (और मिश्रण) की अनुमति देना है, उदाहरण के लिए पानी के सरल इलेक्ट्रोलिसिस में।
जैसे ही बाहरी सर्किट के माध्यम से इलेक्ट्रॉन एक अर्ध सेल से दूसरे में प्रवाहित होते हैं, आवेश में अंतर स्थापित हो जाता है। यदि कोई आयनिक संपर्क प्रदान नहीं किया गया था, तो यह आवेश अंतर इलेक्ट्रॉनों के आगे के प्रवाह को शीघ्रता से रोक देगा। साल्ट ब्रिज नकारात्मक या सकारात्मक आयनों के प्रवाह को सामग्री को अन्यथा अलग रखते हुए ऑक्सीकरण और कमी जहाजों के बीच स्थिर-राज्य चार्ज वितरण को बनाए रखने की अनुमति देता है। समाधान के पृथक्करण को प्राप्त करने के लिए अन्य उपकरण झरझरा बर्तन और गेल समाधान हैं। बन्सेन सेल (दाएं) में झरझरा बर्तन का उपयोग किया जाता है।
संतुलन प्रतिक्रिया
प्रत्येक अर्ध सेल में एक विशिष्ट वोल्टेज होता है। प्रत्येक अर्ध-सेल के लिए पदार्थों के विभिन्न विकल्प विभिन्न संभावित अंतर देते हैं। प्रत्येक प्रतिक्रिया आयनों के विभिन्न ऑक्सीकरण अवस्थाओं के बीच रासायनिक संतुलन प्रतिक्रिया से गुजर रही है: जब संतुलन तक पहुँच जाता है, तो सेल आगे वोल्टेज प्रदान नहीं कर सकता है। अर्ध सेल में जो ऑक्सीकरण से गुजर रहा है, जितना अधिक सकारात्मक ऑक्सीकरण राज्य के साथ आयन/परमाणु के करीब संतुलन होता है, उतनी ही अधिक क्षमता यह प्रतिक्रिया प्रदान करेगी। इसी तरह, कमी की प्रतिक्रिया में, जितना अधिक नकारात्मक ऑक्सीकरण स्थिति के साथ आयन/परमाणु के करीब संतुलन होता है, उतनी ही अधिक क्षमता होती है।
सेल क्षमता
इलेक्ट्रोड क्षमता (प्रत्येक अर्ध सेल के वोल्टेज) के उपयोग के माध्यम से सेल की क्षमता का अनुमान लगाया जा सकता है। इन अर्ध-सेल विभवों को मानक हाइड्रोजन इलेक्ट्रोड (SHE) को 0 वोल्ट के नियतन के सापेक्ष परिभाषित किया गया है। (मानक इलेक्ट्रोड क्षमता की तालिका देखें)। इलेक्ट्रोड क्षमता के बीच वोल्टेज में अंतर मापी गई क्षमता के लिए भविष्यवाणी देता है। वोल्टेज में अंतर की गणना करते समय, एक संतुलित ऑक्सीकरण-कमी समीकरण प्राप्त करने के लिए पहले अर्ध-सेल प्रतिक्रिया समीकरणों को फिर से लिखना चाहिए।
- सबसे छोटी क्षमता के साथ कमी प्रतिक्रिया को उल्टा करें (ऑक्सीकरण प्रतिक्रिया / समग्र सकारात्मक सेल क्षमता बनाने के लिए)
- इलेक्ट्रॉन संतुलन प्राप्त करने के लिए आधी प्रतिक्रियाओं को पूर्णांकों से गुणा किया जाना चाहिए।
सेल क्षमता की संभावित सीमा लगभग शून्य से 6 वोल्ट तक होती है। जल-आधारित इलेक्ट्रोलाइट्स का उपयोग करने वाली सेल सामान्यतः लगभग 2.5 वोल्ट से कम सेल क्षमता तक सीमित होती हैं, क्योंकि उच्च वोल्टेज उत्पन्न करने के लिए आवश्यक पानी के साथ शक्तिशाली ऑक्सीकरण और कम करने वाले एजेंटों की उच्च प्रतिक्रियाशीलता होती है। पानी के अतिरिक्त अन्य सॉल्वैंट्स का उपयोग करने वाली सेल के साथ उच्च सेल क्षमता संभव है। उदाहरण के लिए, 3 वोल्ट के वोल्टेज वाली लिथियम बैटरी सामान्यतः उपलब्ध होती है।
सेल की क्षमता अभिकारकों की एकाग्रता, साथ ही साथ उनके प्रकार पर निर्भर करती है। जैसे-जैसे सेल डिस्चार्ज होता है, अभिकारकों की सांद्रता कम होती जाती है और सेल की क्षमता भी घटती जाती है।
यह भी देखें
- गतिविधि (रसायन विज्ञान)
- सेल नोटेशन
- विद्युत रासायनिक क्षमता
- इलेक्ट्रोकेमिकल इंजीनियरिंग
- बैटरी (बिजली)
- रिचार्जेबल बैटरी
- ईंधन सेल
- फ्लो बैटरी
संदर्भ
- ↑ "इलेक्ट्रोलाइटिक सेल". Georgia State University. Retrieved 2018-05-17.
- ↑ "इलेक्ट्रोकेमिकल सेल". Georgia State University. Retrieved 2018-05-17.
- ↑ "इलेक्ट्रोकेमिकल सेल". BYJU'S. Retrieved October 28, 2020.
- ↑ Gove, Philip Babcock, ed. (2002) [1961]. "बैटरी". Webster's Third New International Dictionary, Unabridged. Merriam-Webster Inc. p. 187. ISBN 978-0-87779-201-7.
6 a: डायनेमोs b (1) का एकल विद्युत प्रभाव उत्पन्न करने के लिए उपकरण का एक संयोजन: विद्युत प्रवाह प्रदान करने के लिए एक साथ जुड़े दो या दो से अधिक सेलों का समूह (2): एक एकल वोल्टाइक सेल
- ↑ Hill, Marquita K. (2004). Understanding Environmental Pollution: A Primer. Cambridge University Press. p. 274. ISBN 978-0-521-82024-0.
Manufacturing a disposable battery takes about 50 times more energy than the battery provides when used.
- ↑ Watts, John (2006). Gcse Edexcel Science. Letts and Lonsdale. p. 63. ISBN 978-1-905129-63-8.
- ↑ Wastebusters Ltd. (2013). The Green Office Manual: A Guide to Responsible Practice. Routledge. p. 96. ISBN 978-1-134-19798-9.
- ↑ Danaher, Kevin; Biggs, Shannon; Mark, Jason (2016). Building the Green Economy: Success Stories from the Grassroots. Routledge. p. 199. ISBN 978-1-317-26292-3.
- ↑ Khurmi, R. S.; Sedha, R. S. (2008). पदार्थ विज्ञान. ISBN 978-81-219-0146-8.
- ↑ Nice, Karim; Strickland, Jonathan (September 18, 2000). "ईंधन सेल कैसे काम करते हैं". HowStuffWorks. Retrieved 4 August 2011.
- ↑ Prabhu, Rahul R. (13 January 2013). "2022 तक 350,000 शिपमेंट तक पहुंचने के लिए स्थिर ईंधन सेल बाजार का आकार". Renew India Campaign. Archived from the original on January 19, 2013. Retrieved 2013-01-14.
{{cite web}}: CS1 maint: unfit URL (link)



