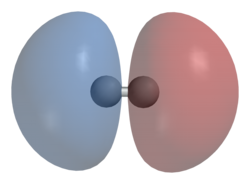
सिग्मा बंध

रसायन विज्ञान में, सिग्मा बंध (σ बंध) सबसे मजबूत प्रकार के सहसंयोजक रासायनिक बंध हैं।[1] ये परमाणु कक्षकों के बीच परस्पर अतिव्यापन द्वारा बनते हैं। समरूपता समूह की भाषा और उपकरणों का उपयोग करके द्विपरमाणुक अणुओं के लिए सिग्मा बंध को सबसे सरल रूप में परिभाषित किया गया है। इस औपचारिक दृष्टिकोण में, एक - बंध अक्ष के परितः घूर्णन के संबंध में सममित होता है। इस परिभाषा के अनुसार, सिग्मा बंध के सामान्य रूप हैं s+s, pz+p, s+pz और dz2+dz2 (जहाँ z को आबंध की धुरी या अंतःनाभिकीय अक्ष के रूप में परिभाषित किया गया है)।[2]
क्वांटम सिद्धांत यह भी इंगित करता है कि समान समरूपता के आणविक ऑर्बिटल् (MO) वास्तव में मिश्रित या कक्षीय संकरण हैं। द्विपरमाणुक अणुओं के इस मिश्रण के व्यावहारिक परिणाम के रूप में, तरंग कार्य s+s और pz+pz आणविक कक्षक मिश्रित हो जाते हैं। मिश्रण (या संकरण या सम्मिश्रण) की सीमा समरूपता के आणविक ऑर्बिटल् की सापेक्ष ऊर्जा पर निर्भर करती है।
(होमोडायटोमिक्स) समद्विपरमाण्विक (होमोन्यूक्लियर डायटोमिक अणु) के लिए, बंधित σ ऑर्बिटल् में कोई ऐसा नोडल प्लेन नहीं होता है, जिस पर वेवफंक्शन शून्य होता है, फिर चाहें वो बंध बने हुए परमाणुओं के बीच हो या दो परमाणुओं के बीच बने बंध से होकर गुजरता हो। संबंधित प्रतिरक्षी, या σ* ऑर्बिटल्, दो बंधित परमाणुओं के बीच एक नोडल तल की उपस्थिति से परिभाषित होता है।
ऑर्बिटल् के प्रत्यक्ष अतिव्यापन के कारण सिग्मा बंध सबसे मजबूत प्रकार के सहसंयोजक बंध हैं, और इन बंधों के इलेक्ट्रॉन को कभी-कभी सिग्मा इलेक्ट्रॉनों के रूप में जाना जाता है।[3]
प्रतीक σ ग्रीक अक्षर सिग्मा है। जब बंध अक्ष के नीचे देखा जाता है, तो σ MO में एक गोलाकार समरूपता होती है, इसलिए यह एक समान ध्वनि वाले "s" परमाणु कक्षीय जैसा दिखता है।
सामान्यतः, एक एकल बंध एक सिग्मा बंध होता है जबकि एक मल्टीपल बंध एक सिग्मा बंध से बना होता है जिसमें पाई या अन्य बंध होते हैं। एक द्विबंध में एक सिग्मा और एक पाई बंध होता है, और एक त्रिबंध में एक सिग्मा और दो पाई बंध होता है।
बहुपरमाणुक अणु
सिग्मा बंध परमाणु कक्षाओं के शीर्ष अतिव्यापन द्वारा प्राप्त किए जाते हैं। सिग्मा बंध की अवधारणा का विस्तार बन्धन परस्पर क्रिया का वर्णन करने के लिए किया जाता है जिसमें एक परमाणु कक्षा का एकल लोब दूसरे के एकल लोब के साथ अतिव्यापन करता है। उदाहरण के लिए, प्रोपेन को दस सिग्मा बंधों के रूप में वर्णित किया गया है, प्रत्येक C−C बंध के लिए एक सिग्मा बंध और एक सिग्मा बंध आठ C−H बंध के लिए।
बहु-बंधित संकुल
संक्रमण धातु संकुल जिसमें कई बंध होते हैं, जैसे कि डाइहाइड्रोजन संकुल, में कई बहु-बंधित परमाणुओं के बीच सिग्मा बंध होते हैं। ये सिग्मा बंध अन्य बंध संबंधों के पूरक होते हैं जैसे कि पाई बैकबॉन्डिंग। π-बैक डोनेशन, जैसा कि W(CO)3(PCy3)2(H2) संकुल में होता है। और यहां तक कि δ-बंध, जैसा कि क्रोमियम (II) एसीटेट संकुल में होता है।[4]
कार्बनिक अणु
कार्बनिक अणु अक्सर चक्रीय यौगिक होते हैं जिनमें एक या एक से अधिक वलय होते हैं, जैसे बेंजीन, और प्रायः पाई बंध के साथ कई सिग्मा बंधों से बने होते हैं। सिग्मा बंध नियम के अनुसार, एक अणु में सिग्मा बंधों की संख्या परमाणुओं की संख्या और वलय की संख्या को जोड़ कर जो प्राप्त होता है उसमे एक घटा कर जो संख्या प्राप्त होती है उसके बराबर होती है।
- Nσ = Natoms + Nrings − 1
यह नियम यूलर विशेषता ग्राफ का एक विशेष अनुप्रयोग है जो अणु का प्रतिनिधित्व करता है।
बिना वलय वाले अणु को एक ट्री (ग्राफ सिद्धांत) के रूप में प्रदर्शित जा सकता है, जिसमें परमाणुओं की संख्या शून्य से एक के बराबर होती है (जैसे डाइहाइड्रोजन, H2 में केवल एक सिग्मा बंध या अमोनिया, NH3 में 3 सिग्मा बंध के साथ)। किन्हीं दो परमाणुओं के बीच 1 से अधिक सिग्मा बंध नहीं होते हैं।
वलय वाले अणुओं में अतिरिक्त सिग्मा बंध होते हैं, जैसे बेंजीन के वलय, जिनमें 6 कार्बन परमाणुओं के लिए रिंग के भीतर 6 C−C सिग्मा बंध होते हैं। एंथ्रासीन अणु C14H10, में तीन वलय हैं ताकि नियम सिग्मा बंधों की संख्या के रूप में देता है जैसे 24 + 3 − 1 = 26। इस मामले में सिग्मा बंधों की संख्या 16 C−C सिग्मा बंध और 10 C−H बंध हैं।
यह नियम उन अणुओं के मामले में विफल हो जाता है, जब कागज पर फ्लैट खींचा जाता है, तो वास्तव में अणु की तुलना में वलय की एक अलग संख्या होती है - उदाहरण के लिएबकमिनस्टरफुलरीन , C60, जिसमें 32 वलय, 60 परमाणु और 90 सिग्मा बंध हैं, प्रत्येक बंधित परमाणुओं के लिए एक होता है; हालांकि, 60 + 32 - 1 = 91, यह 90 नहीं होता है। ऐसा इसलिए है क्योंकि सिग्मा नियम यूलर अभिलाक्षणिक का एक विशेष मामला है, जहां प्रत्येक वलय को एक फलक माना जाता है, प्रत्येक सिग्मा बंध एक किनारा होता है, और प्रत्येक परमाणु एक शीर्ष होता है। सामान्यतः, एक अतिरिक्त फलक स्थान के लिए निर्दिष्ट किया जाता है जो किसी भी रिंग के अंदर नहीं होता है, लेकिन जब बकमिन्स्टरफुलरीन को बिना किसी क्रॉसिंग के सपाट खींचा जाता है, तो वलय में से एक बाहरी पेंटागन बनाता है; उस वलय का भीतरी भाग ग्राफ का बाहरी भाग है। अन्य आकृतियों पर विचार करते समय यह नियम और भी विफल हो जाता है - टॉरॉयडल फुलरीन इस नियम का पालन करेंगे कि एक अणु में सिग्मा बांड की संख्या वास्तव में परमाणुओं की संख्या और वलय की संख्या है, जैसा कि नैनोट्यूब में होता है - जो, जब सपाट खींचा जाता है जैसे कि एक के माध्यम से देख रहा हो अंत से, बीच में एक फलक होगा, जो नैनोट्यूब के दूर के अंत के अनुरूप होगा, जो कि एक वलय नहीं है, और बाहर के अनुरूप एक फलक होगा।
यह भी देखें
संदर्भ
- ↑ Moore, John; Stanitski, Conrad L.; Jurs, Peter C. (2009-01-21). रसायन विज्ञान के सिद्धांत: आण्विक विज्ञान. ISBN 9780495390794.
- ↑ Clayden, Jonathan; Greeves, Nick; Warren, Stuart (March 2012) [2002]. कार्बनिक रसायन शास्त्र (2nd ed.). Oxford: OUP Oxford. pp. 101–136. ISBN 978-0199270293.
- ↑ Keeler, James; Wothers, Peter (May 2008). रासायनिक संरचना और प्रतिक्रियाशीलता (1st ed.). Oxford: OUP Oxford. pp. 27–46. ISBN 978-0199289301.
- ↑ Kubas, Gregory (2002). "मेटल डाइहाइड्रोजन और -बॉन्ड कॉम्प्लेक्स: संरचना, सिद्धांत और प्रतिक्रियाशीलता". J. Am. Chem. Soc. 124 (14): 3799–3800. doi:10.1021/ja0153417.