ऑक्सोहालाइड: Difference between revisions
No edit summary |
No edit summary |
||
| Line 73: | Line 73: | ||
{{legend|red|ऑक्सीजन}} | {{legend|red|ऑक्सीजन}} | ||
{{legend|#b8860b|टेल्यूरियम}} | {{legend|#b8860b|टेल्यूरियम}} | ||
{{legend|gray|सिल्वर (Ag)}}]]धातु के उच्च ऑक्सीकरण अवस्था इस तथ्य से निर्धारित होते हैं कि फ्लोरीन के रूप में ऑक्सीजन एक शक्तिशाली ऑक्सीकरण एजेंट है। ब्रोमीन और आयोडीन अपेक्षाकृत | {{legend|gray|सिल्वर (Ag)}}]]धातु के उच्च ऑक्सीकरण अवस्था इस तथ्य से निर्धारित होते हैं कि फ्लोरीन के रूप में ऑक्सीजन एक शक्तिशाली ऑक्सीकरण एजेंट है। ब्रोमीन और आयोडीन अपेक्षाकृत अशक्त ऑक्सीकरण एजेंट हैं, इसलिए कम ऑक्सोब्रोमाइड्स और ऑक्सियोडाइड्स ज्ञात हैं। d<sup>0</sup> के साथ यौगिकों के लिए संरचनाएं कॉन्फ़िगरेशन VSEPR सिद्धांत द्वारा अनुमानित है। इस प्रकार, {{chem2|CrO2Cl2}} [[चतुष्फलकीय]] है, {{chem2|OsO3F2}} त्रिकोणीय द्विपक्षीय है, {{chem2|XeOF4}} वर्ग पिरामिडल है और {{chem2|OsOF5}} अष्टफलकीय है।<ref>Housectroft & Sharpe, Chapters 21 and 22 illustrate many structures, including M-O and M-Cl bond lengths.</ref> d<sup>1</sup> जटिल {{chem2|ReOCl4}} वर्ग पिरामिडल है। | ||
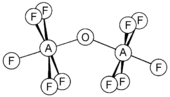
यौगिक {{chem2|[Ta2OX10](2-)}} और {{chem2|[M2OCl10](4-)}} (M = W, Ru, Os) में दो हैं {{chem2|MX5}} समूह एक ब्रिजिंग ऑक्सीजन परमाणु द्वारा जुड़े हुए हैं।<ref>{{cite journal| last1= Dewan| first1= John. C.| last2= Edwards, Anthony J.; Calves, Jean Y.; Guerchais, Jacques E.| year= 1997| title= Fluoride crystal structures. Part 28. Bis(tetraethylammonium)µ-oxo-bis[pentafluorotantalate(V)]| journal= J. Chem. Soc., Dalton Trans.| issue= 10| pages= 978–980| doi= 10.1039/DT9770000978 }}. The structure is illustrated in Housectroft & Sharpe, Figure 22.5.</ref> प्रत्येक धातु में एक अष्टफलकीय वातावरण होता है। असामान्य रैखिक {{chem2|M\sO\sM}} संरचना को [[आणविक कक्षीय]] सिद्धांत के संदर्भ में युक्तिसंगत बनाया जा सकता है, जो धातु और ऑक्सीजन परमाणुओं के बीच d<sub>π</sub> — p<sub>π</sub> बंधन की उपस्थिति का संकेत देता है।<ref>Housectroft & Sharpe, Figure 22.15.</ref> ऑक्सीजन ब्रिज {{chem2|M(cp)2(OTeF5)2}} (M = Ti, Zr, Hf, Mo या W; cp = [[cyclopentadienyl complex|साइक्लोपेंटैडिएनल यौगिक]], {{chem2|\h{5}C5H5}})<ref name=r1/> या {{chem2|[AgOTeF5\-(C6H5CH3)2]2}} जैसे अधिक जटिल विन्यासों में उपस्थित हैं।<ref name=r2/> | यौगिक {{chem2|[Ta2OX10](2-)}} और {{chem2|[M2OCl10](4-)}} (M = W, Ru, Os) में दो हैं {{chem2|MX5}} समूह एक ब्रिजिंग ऑक्सीजन परमाणु द्वारा जुड़े हुए हैं।<ref>{{cite journal| last1= Dewan| first1= John. C.| last2= Edwards, Anthony J.; Calves, Jean Y.; Guerchais, Jacques E.| year= 1997| title= Fluoride crystal structures. Part 28. Bis(tetraethylammonium)µ-oxo-bis[pentafluorotantalate(V)]| journal= J. Chem. Soc., Dalton Trans.| issue= 10| pages= 978–980| doi= 10.1039/DT9770000978 }}. The structure is illustrated in Housectroft & Sharpe, Figure 22.5.</ref> प्रत्येक धातु में एक अष्टफलकीय वातावरण होता है। असामान्य रैखिक {{chem2|M\sO\sM}} संरचना को [[आणविक कक्षीय]] सिद्धांत के संदर्भ में युक्तिसंगत बनाया जा सकता है, जो धातु और ऑक्सीजन परमाणुओं के बीच d<sub>π</sub> — p<sub>π</sub> बंधन की उपस्थिति का संकेत देता है।<ref>Housectroft & Sharpe, Figure 22.15.</ref> ऑक्सीजन ब्रिज {{chem2|M(cp)2(OTeF5)2}} (M = Ti, Zr, Hf, Mo या W; cp = [[cyclopentadienyl complex|साइक्लोपेंटैडिएनल यौगिक]], {{chem2|\h{5}C5H5}})<ref name=r1/> या {{chem2|[AgOTeF5\-(C6H5CH3)2]2}} जैसे अधिक जटिल विन्यासों में उपस्थित हैं।<ref name=r2/> | ||
Revision as of 12:31, 26 March 2023
रसायन विज्ञान में, आणविक ऑक्सोहैलाइड्स (ऑक्सीहैलाइड्स) रासायनिक यौगिकों का एक समूह है जिसमें ऑक्सीजन और हलोजन दोनों परमाणु एक अणु में एक अन्य रासायनिक तत्व A से जुड़े होते हैं। उनके पास सामान्य सूत्र AOmXn है, जहाँ X = एक अधातु तत्त्व (फ्लोरीन) (F), क्लोरीन (Cl), ब्रोमिन (Br), और/या आयोडीन (I) है। तत्व A एक मुख्य समूह तत्व, एक संक्रमण तत्व या एक्टिनाइड हो सकता है। शब्द ऑक्सोहैलाइड, या ऑक्सीहैलाइड, समान समग्र रासायनिक सूत्र वाले खनिजों और अन्य क्रिस्टलीय पदार्थों को भी संदर्भित कर सकते हैं, किन्तु एक आयनिक क्रिस्टल संरचना रखते हैं।
संश्लेषण
ऑक्सोहैलाइड्स को ऑक्साइड और हलाइड्स के बीच मध्यवर्ती यौगिकों के रूप में देखा जा सकता है। संश्लेषण के तीन सामान्य विधियां हैं:[1]
- हैलाइड का आंशिक ऑक्सीकरण:
- इस उदाहरण में, ऑक्सीकरण अवस्था दो से बढ़ जाती है और विद्युत आवेश अपरिवर्तित रहता है।
- एक ऑक्साइड का आंशिक हलोजन:
- ऑक्साइड प्रतिस्थापन:
इसके अतिरिक्त, हैलोजन विनिमय प्रतिक्रियाओं द्वारा विभिन्न ऑक्सोहैलाइड्स बनाए जा सकते हैं और इस प्रतिक्रिया से मिश्रित ऑक्सोहैलाइड्स का निर्माण भी हो सकता है जैसे POFCl2 और CrO2FCl.
गुण
ऑक्साइड या हलाइड के संबंध में, किसी तत्व A के दिए गए ऑक्सीकरण अवस्था के लिए, यदि दो हलोजन परमाणु एक ऑक्सीजन परमाणु या इसके विपरीत को प्रतिस्थापित करते हैं, तो अणु पर समग्र आवेश अपरिवर्तित होता है और केंद्रीय परमाणु की समन्वय संख्या एक से कम हो जाती है। उदाहरण के लिए, फास्फोरस ऑक्सीक्लोराइड (POCl3) और फास्फोरस पेंटाक्लोराइड, (PCl5) दोनों +5 ऑक्सीकरण अवस्था में फास्फोरस के तटस्थ सहसंयोजक यौगिक हैं। यदि एक ऑक्सीजन परमाणु को हलोजन परमाणु द्वारा प्रतिस्थापित किया जाता है तो आवेश +1 से बढ़ जाता है, किन्तु समन्वय संख्या अपरिवर्तित रहती है। यह केंद्रित सल्फ्यूरिक एसिड के साथ क्रोमेट और डाइक्रोमेट नमक और पोटेशियम क्लोराइड के मिश्रण की प्रतिक्रिया से स्पष्ट होता है।
उत्पादित क्रोमाइल क्लोराइड में कोई विद्युत आवेश नहीं होता है और यह एक वाष्पशील सहसंयोजक अणु होता है जिसे प्रतिक्रिया मिश्रण से आसवित किया जा सकता है।[2]
उच्च ऑक्सीकरण अवस्थाओं में तत्वों के ऑक्सोहैलाइड शक्तिशाली ऑक्सीकरण एजेंट होते हैं, जिनके ऑक्सीकरण शक्ति संबंधित ऑक्साइड या हैलाइड के समान होती है। अधिकांश ऑक्सोहैलाइड आसानी से हाइड्रोलिसिस होते हैं। उदाहरण के लिए, क्रोमाइल क्लोराइड को ऊपर सिंथेटिक प्रतिक्रिया के विपरीत क्रोमेट में हाइड्रोलाइज्ड किया जाता है। इस प्रतिक्रिया के लिए प्रेरक बल A-O बंध का निर्माण होता है जो A-Cl बंध से अधिक शक्तिशाली होते हैं। यह प्रतिक्रिया के लिए गिब्स मुक्त ऊर्जा परिवर्तन में अनुकूल तापीय धारिता योगदान देता है[3]
कई ऑक्सोहैलाइड लुईस एसिड के रूप में कार्य कर सकते हैं। यह विशेष रूप से समन्वय संख्या 3 या 4 के ऑक्सोहैलाइड्स के साथ होता है, जो लुईस बेस से एक या एक से अधिक इलेक्ट्रॉन जोड़े को स्वीकार करते हुए 5- या 6-निर्देशांक बन जाते हैं। [[VOCl4]2−- जैसे ऑक्सोहैलाइड आयनों को ऑक्सोहैलाइड (VOCl2) के अम्ल-क्षार यौगिक के रूप में देखा जा सकता है, जिसमें अधिक हैलाइड आयन लुईस बेस के रूप में कार्य करते हैं। एक और उदाहरण VOCl2 है जो त्रिकोणीय द्विध्रुवीय यौगिक VOCl2(N(CH3)3)2 बेस ट्राइमिथाइलमाइन के साथ बनाता है।[4]
कई ऑक्सोहैलाइड्स की कंपन स्पेक्ट्रोस्कोपी को विस्तार से सौंपा गया है। वे आपेक्षिक बंध सामर्थ्य पर उपयोगी जानकारी देते हैं। उदाहरण के लिए, में CrO2F2 में, Cr–O तनन कंपन 1006 सेमी-1 और 1016 सेमी−1 पर हैं और Cr–F तनन कंपन 727 सेमी-1 और 789 सेमी-1 पर हैं। O और F परमाणुओं के विभिन्न द्रव्यमानों के कारण यह अंतर बहुत अधिक है। किन्तु, यह दर्शाता है कि Cr-O बंध Cr-F बंध की तुलना में अधिक प्रबल है। M-O बंध को सामान्यतः दोहरा बंध माना जाता है और यह एम-ओ बंध लंबाई के मापन द्वारा समर्थित है। इसका तात्पर्य है कि तत्व A और O एक σ बंधन और एक π बंधन द्वारा एक साथ रासायनिक बंधन हैं।[5]
उच्च ऑक्सीकरण अवस्थाओं में तत्वों के ऑक्सोहैलाइड लिगैंड से धातु चार्ज-ट्रांसफर यौगिक (एलएमसीटी) संक्रमणों के कारण तीव्रता से रंगीन होते हैं।[6]
मुख्य समूह तत्व
- कार्बन समूह: कार्बन कार्बन ऑक्सोहैलाइड COX2, X = कार्बोनिल फ्लोराइड, कार्बोनिल ब्रोमाइड, और अत्यधिक विषैला एक विषैली गैस (X = Cl), जो क्लोरीन के साथ कार्बन मोनोआक्साइड की कार्बन-उत्प्रेरित प्रतिक्रिया द्वारा औद्योगिक रूप से उत्पादित होता है। कार्बोनिल यौगिकों के निर्माण के लिए कार्बनिक रसायन विज्ञान में यह एक उपयोगी अभिकर्मक है।[7] उदाहरण के लिए,
- निक्टोजन नाइट्रोजन ऑक्सीकरण अवस्थाओं 3, NOX, X = नाइट्रोसिल फ्लोराइड, नाइट्रोसिल क्लोराइड, नाइट्रोसिल ब्रोमाइड और 5 में नाइट्रोजन के साथ ऑक्सोहैलाइड्स की दो श्रृंखला बनाता है। NO2X, X = नाइट्राइल फ्लोराइड, Cl. वे नाइट्रोजन ऑक्साइड के हलोजन द्वारा बनाए जाते हैं। ध्यान दें कि NO2F नाइट्रेट आयन NO−3 के साथ समइलेक्ट्रॉनिक है। फॉस्फोरस (V) के केवल ऑक्सोहैलाइड्स ज्ञात हैं।[8]
- काल्कोजन: गंधक ऑक्सीकरण अवस्था +4 में ऑक्सोहैलाइड्स बनाता है[9], जैसे थियोनिल क्लोराइड, SOCl2 और ऑक्सीकरण अवस्था +6, जैसे सल्फ्यूरिल फ्लोराइड (SO2F2), सल्फ्यूरल क्लोराइड (SO2Cl2), और थियोनील टेट्राफ्लोराइड (SOF4)। सभी आसानी से हाइड्रोलाइज्ड हैं। परन्तु, थियोनील क्लोराइड को निर्जलीकरण एजेंट के रूप में उपयोग किया जा सकता है क्योंकि पानी के अणुओं को निर्जल ठोस क्लोराइड के पीछे छोड़कर गैसीय उत्पादों में परिवर्तित किया जाता है।[10]
- सेलेनियम और टेल्यूरियम समान यौगिक बनाते हैं और ऑक्सो-ब्रिजिड प्रजातियां भी F5AOAF5 (ए = एस, से, ते)। वे S, Se और Te के लिए क्रमशः 142.5, 142.4 और 145.5° के A-O-A कोण के साथ गैर-रैखिक हैं।[11]टेल्यूरियम आयन [TeOF5]−, जिसे टेफ्लिक एसिड के रूप में जाना जाता है, एक बड़ा और किन्तु स्थिर आयन है, जो बड़े धनायनों के साथ स्थिर लवण बनाने के लिए उपयोगी है।[10]
- हैलोजन: हैलोजन सूत्र XO2F (क्लोरिल फ्लोराइड), XO3F (पर्क्लोरिल फ्लोराइड) और XOF3 X = Cl, Br और I के साथ विभिन्न ऑक्सीफ्लोराइड्स बनाते हैं। IO2F3 और IOF5 को भी जाने जाते हैं।[12]
- नोबल गैसे: क्सीनन ऑक्सीटेट्राफ्लोराइड (XeOF4), क्सीनन डाइऑक्साइडिफ्लोराइड (XeO2F2) और क्सीनन ऑक्सीडिफ्लोराइड (XeOF2)
संक्रमण धातुएं और एक्टिनाइड्स
संक्रमण धातुओं के ज्ञात ऑक्सोहैलाइड्स का चयन नीचे दिखाया गया है, और साहित्य में अधिक विस्तृत सूचियां उपलब्ध हैं।[14] X विभिन्न हैलाइडों को सबसे अधिक बार F और Cl को इंगित करता है।
| ऑक्सीकरण अवस्था | ऑक्सोहैलाइड्स |
|---|---|
| 3 | VOCl, VOBr,[15] FeOCl |
| 4 | [TiOCl4]2−, Cl3TiOTiCl3, VOCl2, [VOCl4]2− |
| 5 | VOX3, {{chem2|VO2X, [CrOF4]−, [CrOF5]2−, MnOCl3, TcOCl3, VOF3, VOCl3, NbOCl3 |
| 6 | CrO2Cl2, [CrO3Cl]−, ReOX4, ReO2F2, OsOF4, CrO2F2, MoOCl4, MoO2Cl2, WO2Cl2, WOCl4 |
| 7 | MnO3Cl, ReOF5, ReO2F3, ReO3Cl, OsOF5 |
| 8 | OsO2F4, OsO3F2 |

धातु के उच्च ऑक्सीकरण अवस्था इस तथ्य से निर्धारित होते हैं कि फ्लोरीन के रूप में ऑक्सीजन एक शक्तिशाली ऑक्सीकरण एजेंट है। ब्रोमीन और आयोडीन अपेक्षाकृत अशक्त ऑक्सीकरण एजेंट हैं, इसलिए कम ऑक्सोब्रोमाइड्स और ऑक्सियोडाइड्स ज्ञात हैं। d0 के साथ यौगिकों के लिए संरचनाएं कॉन्फ़िगरेशन VSEPR सिद्धांत द्वारा अनुमानित है। इस प्रकार, CrO2Cl2 चतुष्फलकीय है, OsO3F2 त्रिकोणीय द्विपक्षीय है, XeOF4 वर्ग पिरामिडल है और OsOF5 अष्टफलकीय है।[17] d1 जटिल ReOCl4 वर्ग पिरामिडल है।
यौगिक [Ta2OX10]2− और [M2OCl10]4− (M = W, Ru, Os) में दो हैं MX5 समूह एक ब्रिजिंग ऑक्सीजन परमाणु द्वारा जुड़े हुए हैं।[18] प्रत्येक धातु में एक अष्टफलकीय वातावरण होता है। असामान्य रैखिक M−O−M संरचना को आणविक कक्षीय सिद्धांत के संदर्भ में युक्तिसंगत बनाया जा सकता है, जो धातु और ऑक्सीजन परमाणुओं के बीच dπ — pπ बंधन की उपस्थिति का संकेत देता है।[19] ऑक्सीजन ब्रिज M(cp)2(OTeF5)2 (M = Ti, Zr, Hf, Mo या W; cp = साइक्लोपेंटैडिएनल यौगिक, η5-C5H5)[20] या [AgOTeF5-(C6H5CH3)2]2 जैसे अधिक जटिल विन्यासों में उपस्थित हैं।[16]
एक्टिनाइड श्रृंखला में, यूरेनिल यौगिक (UO2Cl2) और [UO2Cl4]2− जैसे यूरेनिल क्लोराइड यौगिकों को अच्छी तरह से जाना जाता है और इसमें रैखिक UO2 अंश होता हैं। इसी प्रकार की प्रजातियां नेपच्यून और प्लूटोनियम के लिए उपस्थित हैं।
खनिज और आयनिक यौगिक
बिस्मथ ऑक्सीक्लोराइड (बायोसीएल, बिस्मोक्लाइट ) खनिज ऑक्सोहैलाइड का एक दुर्लभ उदाहरण है। क्रिस्टल संरचना में एक चतुष्कोणीय समरूपता होती है और इसे Cl-Bi-O-Bi-Cl-Cl-Bi-O-Bi-Cl क्रम में Cl−, Bi3+ और O2− आयनों की परतों से युक्त माना जा सकता है।। यह स्तरित, ग्रेफाइट जैसी संरचना के परिणामस्वरूप बिस्मोक्लाइट की अपेक्षाकृत कम कठोरता (खनिज कठोरता 2-2.5 का मोह पैमाने) और अधिकांश अन्य ऑक्सोहैलाइड खनिज होते हैं।[21] उन अन्य खनिजों में पारा युक्त खनिजों के अपक्षय द्वारा टेर्लिंग्वाइट Hg2OCl सम्मिलित हैं।[22] मेंडिपाइट, Pb3O2Cl2, कई चरणों में लेड (II) सल्फाइड के मूल निक्षेप से निर्मित, द्वितीयक ऑक्सोहैलाइड खनिज का एक और उदाहरण है।
लोहा, एंटीमनी, बिस्मथ और लेण्टेनियुम तत्व सामान्य सूत्र MOCl के ऑक्सोक्लोराइड बनाते हैं। MOBr और MOI को Sb और Bi के लिए भी जाना जाता है। उनकी कई क्रिस्टल संरचनाएं निर्धारित की गई हैं।[23]
यह भी देखें
संदर्भ
- ↑ Synthesis of individual compounds can be found in Housecroft & Sharpe and Greenwood & Earnshaw in sections relating to the specific element, A
- ↑ Sisler, H. H. "Chromyl Chloride" Inorganic Synthesis McGraw-Hill: New York, 1946; Vol. 2, pp. 205–207.
- ↑ Greenwood & Earnshaw, p. 1023
- ↑ Greenwood & Earnshaw, p. 996.
- ↑ K. Nakamoto Infrared and Raman spectra of inorganic and coordination compounds, 5th. edition, Part A, Wiley, 1997 ISBN 0-471-19406-9, Tables II-4c, II-6g, II-6h, II-7b, II-8c
- ↑ Shriver & Atkins, Figure 13.8, p. 447
- ↑ Shriver & Atkins, p. 358
- ↑ Housecroft & Sharpe, pp. 329–330
- ↑ Housecroft & Sharpe, pp. 365–367
- ↑ 10.0 10.1 Shriver & Atkins, p. 397
- ↑ Oberhammer, Heinz; Seppelt, Konrad (1978). "Molecular Structure of F5SOSF5, F5SeOSeF5, and F5TeOTeF5: d-Orbital Participation in Bonds between Main Group Elements". Angewandte Chemie International Edition. 17 (1): 69–70. doi:10.1002/anie.197800691.
- ↑ Housecroft & Sharpe, p. 395
- ↑ Fourati, Mohieddine; Chaabouni, Moncef; Belin, Claude Henri; Charbonnel, Monique; Pascal, Jean Louis; Potier, Jacqueline (1986). "A strongly chelating bidentate CLO4. New synthesis route and crystal structure determination of Ti(CLO4)". Inorg. Chem. 25 (9): 1386–1390. doi:10.1021/ic00229a019.
- ↑ Greenwood & Earnshaw, Chapters 22–25, section halides and oxohalides
- ↑ Greenwood & Earnshaw p. 993.
- ↑ 16.0 16.1 Strauss, Steven H.; Noirot, Mark D.; Anderson, Oren P. (1985). "Preparation and characterization of silver(I) teflate complexes: bridging OTeF5 groups in the solid state and in solution". Inorg. Chem. 24 (25): 4307–4311. doi:10.1021/ic00219a022.
- ↑ Housectroft & Sharpe, Chapters 21 and 22 illustrate many structures, including M-O and M-Cl bond lengths.
- ↑ Dewan, John. C.; Edwards, Anthony J.; Calves, Jean Y.; Guerchais, Jacques E. (1997). "Fluoride crystal structures. Part 28. Bis(tetraethylammonium)µ-oxo-bis[pentafluorotantalate(V)]". J. Chem. Soc., Dalton Trans. (10): 978–980. doi:10.1039/DT9770000978.
{{cite journal}}: CS1 maint: multiple names: authors list (link). The structure is illustrated in Housectroft & Sharpe, Figure 22.5. - ↑ Housectroft & Sharpe, Figure 22.15.
- ↑ Crossman, Martin C.; Hope, Eric G.; Saunders, Graham C. (1996). "Cyclopentadienyl metal teflate (OTeF5) complexes". J. Chem. Soc., Dalton Trans. (4): 509–511. doi:10.1039/DT9960000509.
- ↑ Anthony, John W.; Bideaux, Richard A.; Bladh, Kenneth W.; Nichols, Monte C. (eds.). "Bismoclite". Handbook of Mineralogy (PDF). Vol. III (Halides, Hydroxides, Oxides). Chantilly, VA: Mineralogical Society of America. ISBN 0-9622097-2-4. Retrieved December 5, 2011.
- ↑ Hillebrand, W. F.; W. T. Schaller (1907). "Art. XXVI. The Mercury Minerals from Terlingua, Texas: Kleinite, Terlinguaite, Eglestonite, Montroydite, Calomel, Mercury". The American Journal of Science. s4-24 (139): 259–274. doi:10.2475/ajs.s4-24.141.259. Retrieved 2009-05-21.
- ↑ Wells, pp. 390–392
ग्रन्थसूची
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- Housecroft, C. E. and Sharpe, A. G. Inorganic Chemistry, 2nd ed., Pearson Prentice-Hall 2005. ISBN 0-582-31080-6
- Shrivr, D. F. and Atkins, P. W. Inorganic Chemistry, 3rd edn. Oxford University Press, 1999. ISBN 0-19-850330-X
- Wells, A. F. (1962). Structural Inorganic Chemistry (3rd ed.). Oxford: Clarendon Press. pp. 384–392. ISBN 0-19-855125-8..