स्वतंत्र कोटि
भौतिकी और रसायन विज्ञान में, भौतिक प्रणाली की स्थिति के औपचारिक विवरण में स्वातंत्र्य कोटि एक स्वतंत्र भौतिक मापदण्ड है। प्रणाली की सभी अवस्था के सम्मुच्चय को प्रणाली के प्रावस्था समष्टि के रूप में जाना जाता है, और प्रणाली की स्वातंत्र्य कोटि प्रावस्था समष्टि के आयाम हैं।
त्रि-आयामी अंतरिक्ष में एक कण के स्थान के लिए तीन समन्वय प्रणाली की आवश्यकता होती है। इसी तरह, जिस दिशा और गति पर एक कण चलता है, प्रत्येक अंतरिक्ष के तीन आयामों के संदर्भ में उसे वेग के तीन घटकों के रूप में वर्णित किया जा सकता है। यदि प्रणाली का समय विकास नियतात्मक प्रणाली है (जहां एक पल में अवस्था विशिष्ट रूप से अपने अतीत और भविष्य की स्थिति और वेग को समय के कार्य के रूप में निर्धारित करता है) तो ऐसी प्रणाली में स्वातंत्र्य की छह कोटि होती है।[citation needed] यदि कण की गति आयामों की कम संख्या तक सीमित है - उदाहरण के लिए, कण को एक तार के साथ या एक निश्चित सतह पर चलना चाहिए - तो प्रणाली में स्वातंत्र्य की छह कोटि से कम है। दूसरी ओर, एक विस्तारित वस्तु वाली एक प्रणाली जो घूम सकती है या कंपन कर सकती है, स्वातंत्र्य की छह कोटि से अधिक हो सकती है।
शास्त्रीय यांत्रिकी में, किसी भी समय एक बिंदु कण की स्थिति को लैग्रैंगियन यांत्रिकी औपचारिकता में स्थिति और वेग निर्देशांक के साथ वर्णित किया जाता है, या हैमिल्टनियन (परिमाण यांत्रिकी) औपचारिकता में स्थिति और गति निर्देशांक के साथ वर्णित किया जाता है।
सांख्यिकीय यांत्रिकी में, स्वातंत्र्य की एक कोटि प्रणाली के सूक्ष्म अवस्था (सांख्यिकीय यांत्रिकी) का वर्णन करने वाला एक एकल अदिश (भौतिकी) संख्या है।[1] प्रणाली के सभी सूक्ष्म अवस्था का विनिर्देश प्रणाली के प्रावस्था समष्टि में एक बिंदु है।
रसायन विज्ञान में 3D आदर्श श्रृंखला प्रतिरूप में, प्रत्येक एकलक के अभिविन्यास का वर्णन करने के लिए दो कोण आवश्यक हैं।
स्वातंत्र्य की द्विघात कोटि निर्दिष्ट करना अक्सर उपयोगी होता है। ये स्वातंत्र्य कोटि हैं जो प्रणाली की ऊर्जा के द्विघात कार्य में योगदान करती हैं।
जो गिन रहा है उसके आधार पर, कई अलग-अलग तरीके हैं जिनसे स्वातंत्र्य कोटि को परिभाषित किया जा सकता है, प्रत्येक एक अलग मूल्य के साथ।[2]
गैसों के लिए स्वातंत्र्य की ऊष्मागतिक कोटि
| External images | |
|---|---|
समविभाजन प्रमेय द्वारा, गैस की प्रति मोल आंतरिक ऊर्जा cv T बराबर होती है, जहाँ T निरपेक्ष तापमान है और स्थिर आयतन पर विशिष्ट ऊष्मा cv = (f)(R/2 है। R = 8.314 J/(K mol) सार्वभौमिक गैस स्थिरांक है, और f स्वातंत्र्य की ऊष्मागतिक (द्विघात) कोटि की संख्या है, ऊर्जा उत्पन्न करने के तरीकों की संख्या की गणना करना है।
किसी भी परमाणु या अणु में x, y, और z अक्षों के संबंध में द्रव्यमान के केंद्र के स्थानांतरीय गति (गतिज ऊर्जा) से जुड़ी स्वातंत्र्य की तीन कोटि होती है। एकपरमाण्विक प्रजातियों के लिए स्वातंत्र्य की ये एकमात्र कोटि हैं, जैसे उत्कृष्ट गैस परमाणु।
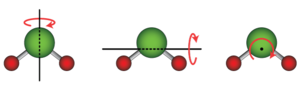
दो या दो से अधिक परमाणुओं वाली संरचना के लिए, पूरी संरचना में घूर्णी गतिज ऊर्जा भी होती है, जहाँ पूरी संरचना एक अक्ष के चारों ओर घूमती है।
एक रेखीय आणविक ज्यामिति, जहाँ सभी परमाणु एक अक्ष के साथ होते हैं, जैसे कोई द्विपरमाणुक अणु और कुछ अन्य अणु जैसे कार्बन डाईऑक्साइड (CO2), स्वातंत्र्य की दो घूर्णी कोटि होती है, क्योंकि यह आणविक अक्ष के लम्बवत दो अक्षों में से किसी एक के बारे में घूम सकती है। एक अरैखिक अणु, जहां परमाणु एक धुरी के साथ नहीं रहते हैं, जैसे पानी (H2O), स्वातंत्र्य की तीन घूर्णी कोटि है, क्योंकि यह किसी भी तीन लंबवत अक्षों के चारों ओर घूम सकती है। विशेष स्तिथियों में, जैसे अधिशोषित बड़े अणु में, स्वातंत्र्य की घूर्णी कोटि केवल एक तक सीमित हो सकती है।[3]
दो या दो से अधिक परमाणुओं वाली संरचना में कंपन ऊर्जा भी होती है, जहां व्यक्तिगत परमाणु एक दूसरे के संबंध में गति करते हैं। एक द्विपरमाणुक अणु में एक आणविक कंपन प्रणाली होता है: दो परमाणु स्प्रिंग के रूप में कार्य करने वाले रासायनिक बंधन के साथ आगे और आगे बढ़ते हैं। N परमाणुओं के साथ एक अणु में आणविक कंपन के अधिक जटिल तरीके होते हैं एक रैखिक अणु के लिए 3N − 5 कंपन प्रणाली और एक अरेखीय अणु के लिए 3N − 6 प्रणाली।[4] विशिष्ट उदाहरण के रूप में, रैखिक CO2 अणु में दोलन के 4 तरीके होते हैं,[5] और अरैखिक जल अणु में दोलन के 3 तरीके होते हैं[6] प्रत्येक कंपन प्रणाली में दो ऊर्जा शब्द होते हैं: गतिमान परमाणुओं की गतिज ऊर्जा और वसंत जैसे रासायनिक बंधों की संभावित ऊर्जा। इसलिए, कंपन ऊर्जा शर्तों की संख्या एक रैखिक अणु के लिए 2(3N − 5) है और एक अरेखीय अणु के लिए 2(3N − 6) प्रणाली है।
घूर्णी और कंपन प्रणाली दोनों को परिमाणित किया जाता है, जिसके लिए न्यूनतम तापमान को सक्रिय करने की आवश्यकता होती है।[7] कई गैसों के लिए स्वातंत्र्य की घूर्णी कोटि को सक्रिय करने के लिए घूर्णी तापमान 100 K से कम है। N2 और O2 के लिए, यह 3 K से कम है।[1] पर्याप्त कंपन के लिए आवश्यक कंपन तापमान 103 और 104 के बीच है, 3521 K N2 के लिए और 2156 K O2 के लिए हैं।[1] N2 और O2 में कंपन को सक्रिय करने के लिए विशिष्ट वायुमंडलीय तापमान पर्याप्त नहीं हैं, जिसमें अधिकांश वातावरण सम्मिलित है। (अगला आंकड़ा देखें।) हालांकि, बहुत कम प्रचुर मात्रा में ग्रीनहाउस गैस पृथ्वी की सतह से अवरक्त को अवशोषित करके क्षोभमंडल को गर्म रखती हैं, जो उनके कंपन प्रणाली को उत्तेजित करता है।[8] इस ऊर्जा का अधिकांश भाग ग्रीनहाउस प्रभाव के माध्यम से अवरक्त में सतह पर वापस आ जाता है।
क्योंकि कमरे का तापमान (≈298 K) विशिष्ट घूर्णी तापमान से अधिक है, लेकिन विशिष्ट कंपन तापमान से कम है, केवल स्वातंत्र्य के अनुवाद और घूर्णी कोटि, समान मात्रा में, ताप क्षमता अनुपात में योगदान करते हैं। इसलिए γ≈5/3 एकपरमाण्विक गैसों के लिए और γ≈7/5 कमरे के तापमान पर द्विपरमाण्विक गैसों के लिए है।[1]

चूंकि पृथ्वी के वायुमंडल में द्विपरमाणुक गैसों (नाइट्रोजन और ऑक्सीजन का योगदान लगभग 99% है) का प्रभुत्व है, इसकी दाढ़ आंतरिक ऊर्जा करीब cv T = (5/2)RT है, द्विपरमाणुक गैसों द्वारा प्रदर्शित स्वातंत्र्य की 5 कोटि द्वारा निर्धारित है।[citation needed][11][circular reference]
ग्राफ़ को दाईं ओर देखें। 140 K < T <380 K, cv (5/2) से भिन्न Rd 1% से भी कम है। केवल क्षोभमंडल और समताप मंडल में तापमान से काफी ऊपर के तापमान पर ही कुछ अणुओं में पर्याप्त ऊर्जा होती है जिससे वे N2 और O2 के कंपन प्रणाली को सक्रिय कर सकें। स्थिर आयतन पर विशिष्ट ऊष्मा, cv, धीरे-धीरे (7/2) की ओर बढ़ता है R जैसे-जैसे तापमान T = 400 K से ऊपर बढ़ता है, जहाँ cv (5/2) Rd = 717.5 जे / (के किलो) से 1.3% ऊपर है।
| एकपरमाण्विक | रैखिक अणु | अरैखिक अणु | |
|---|---|---|---|
| अनुवाद (x, y, and z) | 3 | 3 | 3 |
| क्रमावर्तन (x, y, and z) | 0 | 2 | 3 |
| कंपन (संरचनात्मक विभिन्नता) | 0 | (3N − 5) | (3N − 6) |
एक स्थिति निर्दिष्ट करने के लिए निर्देशांक की न्यूनतम संख्या की गणना
किसी स्थिति को निर्दिष्ट करने के लिए आवश्यक न्यूनतम संख्या में निर्देशांक का उपयोग करके कोई भी स्वातंत्र्य कोटि की गणना कर सकता है। यह अग्रानुसार होगा:
- एक कण के लिए हमें इसकी स्थिति निर्दिष्ट करने के लिए 2-D तल में 2 निर्देशांक और 3-D अंतरिक्ष में 3 निर्देशांक की आवश्यकता होती है। इस प्रकार 3-D अंतरिक्ष में इसकी स्वातंत्र्य कोटि 3 है।
- एक 3-D अंतरिक्ष में 2 कणों (उदाहरण के लिए एक द्विपरमाणुक अणु) से युक्त शरीर के लिए उनके बीच निरंतर दूरी के साथ (मान लें कि D) हम इसकी स्वातंत्र्य कोटि (नीचे) 5 दिखा सकते हैं।
मान लीजिए कि इस शरीर में एक कण का समन्वय (x1, y1, z1) है और दूसरे ने समन्वय (x2, y2, z2) अज्ञात z2 के साथ किया है। दो निर्देशांकों के बीच की दूरी के सूत्र का अनुप्रयोग
एक अज्ञात के साथ एक समीकरण में परिणाम, जिसमें हम z2 के लिए हल कर सकते हैं। x1, x2, y1, y2, z1, या z2 में से एक अज्ञात हो सकता है।
शास्त्रीय समविभाजन प्रमेय के विपरीत, कमरे के तापमान पर, अणुओं की कंपन गति सामान्यतः ताप क्षमता में उपेक्षणीय योगदान देती है। ऐसा इसलिए है क्योंकि स्वातंत्र्य की ये कोटि जमी हुई हैं क्योंकि ऊर्जा के बीच की दूरी परिवेश के तापमान (kBT) के अनुरूप ऊर्जा से अधिक है।[1]
स्वातंत्र्य की स्वतंत्र कोटि
स्वातंत्र्य कोटि का सम्मुच्चय {{math|X1, ..., XN} एक प्रणाली का} स्वातंत्र्य है यदि सम्मुच्चय से जुड़ी ऊर्जा को निम्नलिखित रूप में लिखा जा सकता है:
जहाँ Ei एकमात्र चर का एक कार्य Xi है।
उदाहरण: अगर X1 और X2 स्वातंत्र्य की दो कोटि हैं, और E संबंधित ऊर्जा है:
- अगर है, तो स्वातंत्र्य की दो कोटि स्वतंत्र हैं।
- अगर है, तब स्वातंत्र्य की दो कोटि स्वतंत्र नहीं हैं। X1 और X2 के उत्पाद को सम्मिलित करने वाला शब्द एक युग्मन शब्द है जो स्वातंत्र्य की दो कोटि के बीच की बातचीत का वर्णन करता है।
1 से N तक i के लिए, i का मूल्य स्वातंत्र्य कोटि Xi बोल्ट्जमैन वितरण के अनुसार वितरित किया जाता है। इसकी संभाव्यता घनत्व फलन निम्न है:
- ,
इस खंड में, और पूरे लेख में कोष्ठक उनके द्वारा संलग्न मात्रा के माध्य को निरूपित करें।
प्रणाली की आंतरिक ऊर्जा स्वातंत्र्य की प्रत्येक कोटि से जुड़ी औसत ऊर्जाओं का योग है:
स्वातंत्र्य की द्विघात कोटि
स्वातंत्र्य की एक कोटि Xi द्विघात है यदि स्वातंत्र्य की इस कोटि से जुड़ी ऊर्जा शर्तों को इस रूप में लिखा जा सकता है
- ,
जहाँ Y स्वातंत्र्य की अन्य द्विघात कोटि का एक रेखीय संयोजन है।
उदाहरण: अगर X1 और X2 स्वातंत्र्य की दो कोटि हैं, और E संबंधित ऊर्जा है:
- अगर है, तो स्वातंत्र्य की दो कोटि स्वतंत्र और गैर-द्विघात नहीं हैं।
- अगर है, तो स्वातंत्र्य की दो कोटि स्वतंत्र और गैर-द्विघात हैं।
- अगर है, तब स्वातंत्र्य की दो कोटि स्वतंत्र नहीं हैं बल्कि द्विघात हैं।
- अगर है, तो स्वातंत्र्य की दो कोटि स्वतंत्र और द्विघात हैं।
उदाहरण के लिए, न्यूटोनियन यांत्रिकी में, स्वातंत्र्य की द्विघात कोटि की एक प्रणाली की गतिशीलता (यांत्रिकी) को निरंतर गुणांक वाले सजातीय रैखिक अंतर समीकरण के एक सम्मुच्चय द्वारा नियंत्रित किया जाता है।
स्वातंत्र्य की द्विघात और स्वतंत्र कोटि
X1, ... , XN स्वातंत्र्य की द्विघात और स्वतंत्र कोटि हैं यदि उनके द्वारा प्रतिनिधित्व की जाने वाली प्रणाली के एक सूक्ष्म अवस्था से जुड़ी ऊर्जा को इस प्रकार लिखा जा सकता है:
समविभाजन प्रमेय
सांख्यिकीय यांत्रिकी की शास्त्रीय सीमा में, ऊष्मागतिक संतुलन पर, एक प्रणाली की आंतरिक ऊर्जा N स्वातंत्र्य की द्विघात और स्वतंत्र कोटि है:
यहाँ, स्वातंत्र्य कोटि से जुड़ी औसत ऊर्जा निम्न है:
चूंकि स्वातंत्र्य कोटि स्वतंत्र हैं, प्रणाली की आंतरिक ऊर्जा स्वातंत्र्य की प्रत्येक कोटि से जुड़ी औसत ऊर्जा के योग के बराबर होती है, जो परिणाम प्रदर्शित करती है।
सामान्यीकरण
अपने प्रावस्था समष्टि में बिंदु (ज्यामिति) के रूप में एक प्रणाली की स्थिति का वर्णन, हालांकि गणितीय रूप से सुविधाजनक है, परन्तु मौलिक रूप से गलत माना जाता है। परिमाण यांत्रिकी में, स्वातंत्र्य की गति की कोटि तरंग फलन की अवधारणा से अलग हो जाती है, और संचालक (भौतिकी) में बिंदु वर्णक्रम होता है जो स्वातंत्र्य की अन्य कोटि के अनुरूप होती है। उदाहरण के लिए, एक इलेक्ट्रॉन या फोटॉन के लिए कोणीय संवेग संचालिका, कक्षीय, और कुल कोणीय संवेग संचालिका (जो घूर्णी स्वातंत्र्य से मेल खाती है) में केवल दो आइगेनवैल्यू होते हैं। यह असततता तब स्पष्ट हो जाती है जब क्रिया (भौतिकी) में प्लैंक स्थिरांक के परिमाण का एक क्रम होता है, और स्वातंत्र्य की अलग-अलग कोटि को अलग किया जा सकता है।
संदर्भ
- ↑ 1.0 1.1 1.2 1.3 1.4 Reif, F. (2009). सांख्यिकीय और तापीय भौतिकी के मूल सिद्धांत. Long Grove, IL: Waveland Press, Inc. p. 51. ISBN 978-1-57766-612-7.
- ↑ "Physical chemistry - Does a diatomic gas have one or two vibrational degrees of freedom?".
- ↑ Waldmann, Thomas; Klein, Jens; Hoster, Harry E.; Behm, R. Jürgen (2013). "Stabilization of Large Adsorbates by Rotational Entropy: A Time-Resolved Variable-Temperature STM Study". ChemPhysChem. 14 (1): 162–9. doi:10.1002/cphc.201200531. PMID 23047526.
- ↑ Molecular vibration[user-generated source]
- ↑ For drawings, see http://www.colby.edu/chemistry/PChem/notes/NormalModesText.pdf
- ↑ For drawings, see https://sites.cns.utexas.edu/jones_ch431/normal-modes-vibration
- ↑ Section 12-7 (pp. 376-379) of Sears and Salinger, 1975: Thermodynamics, Kinetic Theory, and Statistical Thermodynamics. Third edition. Addison-Wesley Publishing Co.
- ↑ "अणु कंपन करते हैं". UCAR Center for Science Education. Archived from the original on 2014-10-10. Retrieved 2021-01-19.
- ↑ "Air - Specific Heat vs. Temperature at Constant Pressure".
- ↑ Gatley, D. P., S. Herrmann, H.-J. Kretzshmar, 2008: A twenty-first century molar mass for dry air. HVAC&R Research, vol. 14, pp. 655-662.
- ↑ Equipartition theorem#Diatomic gases