स्वतंत्र कोटि
This article needs additional citations for verification. (November 2009) (Learn how and when to remove this template message) |
भौतिकी और रसायन विज्ञान में, भौतिक प्रणाली की स्थिति के औपचारिक विवरण में स्वतंत्रता की डिग्री एक स्वतंत्र भौतिक पैरामीटर है। सिस्टम के सभी राज्यों के सेट को सिस्टम के चरण स्थान के रूप में जाना जाता है, और सिस्टम की स्वतंत्रता की डिग्री चरण स्थान के आयाम हैं।
त्रि-आयामी अंतरिक्ष में एक कण के स्थान के लिए तीन समन्वय प्रणाली की आवश्यकता होती है। इसी तरह, जिस दिशा और गति पर एक कण चलता है, उसे वेग के तीन घटकों के रूप में वर्णित किया जा सकता है, प्रत्येक अंतरिक्ष के तीन आयामों के संदर्भ में। यदि प्रणाली का समय विकास नियतात्मक प्रणाली है (जहां एक पल में राज्य विशिष्ट रूप से अपने अतीत और भविष्य की स्थिति और वेग को समय के कार्य के रूप में निर्धारित करता है) तो ऐसी प्रणाली में स्वतंत्रता की छह डिग्री होती है।[citation needed] यदि कण की गति आयामों की कम संख्या तक सीमित है - उदाहरण के लिए, कण को एक तार के साथ या एक निश्चित सतह पर चलना चाहिए - तो सिस्टम में स्वतंत्रता की छह डिग्री से कम है। दूसरी ओर, एक विस्तारित वस्तु वाली एक प्रणाली जो घूम सकती है या कंपन कर सकती है, स्वतंत्रता की छह डिग्री से अधिक हो सकती है।
शास्त्रीय यांत्रिकी में, किसी भी समय एक बिंदु कण की स्थिति को लैग्रैंगियन यांत्रिकी औपचारिकता में स्थिति और वेग निर्देशांक के साथ वर्णित किया जाता है, या हैमिल्टनियन (क्वांटम यांत्रिकी) औपचारिकता में स्थिति और गति निर्देशांक के साथ।
सांख्यिकीय यांत्रिकी में, स्वतंत्रता की एक डिग्री एक प्रणाली के माइक्रोस्टेट (सांख्यिकीय यांत्रिकी) का वर्णन करने वाला एक एकल अदिश (भौतिकी) संख्या है।[1] सिस्टम के सभी माइक्रोस्टेट्स का विनिर्देश सिस्टम के चरण स्थान में एक बिंदु है।
रसायन विज्ञान में 3डी आदर्श श्रृंखला मॉडल में, प्रत्येक मोनोमर के अभिविन्यास का वर्णन करने के लिए दो कोण आवश्यक हैं।
स्वतंत्रता की द्विघात कोटि निर्दिष्ट करना अक्सर उपयोगी होता है। ये स्वतंत्रता की डिग्री हैं जो सिस्टम की ऊर्जा के द्विघात कार्य में योगदान करती हैं।
कोई क्या गिन रहा है इसके आधार पर, कई अलग-अलग तरीके हैं जिनसे स्वतंत्रता की डिग्री को परिभाषित किया जा सकता है, प्रत्येक एक अलग मूल्य के साथ।[2]
गैसों के लिए स्वतंत्रता की थर्मोडायनामिक डिग्री
| External images | |
|---|---|
समविभाजन प्रमेय द्वारा, गैस की प्रति मोल आंतरिक ऊर्जा बराबर होती है cv T, कहाँ T निरपेक्ष तापमान है और स्थिर आयतन पर विशिष्ट ऊष्मा c हैv = (च)(आर/2). R = 8.314 J/(K mol) सार्वभौमिक गैस स्थिरांक है, और f स्वतंत्रता की थर्मोडायनामिक (द्विघात) डिग्री की संख्या है, उन तरीकों की संख्या की गिनती करना जिनमें ऊर्जा उत्पन्न हो सकती है।
किसी भी परमाणु या अणु में x, y, और z अक्षों के संबंध में द्रव्यमान के केंद्र के स्थानांतरीय गति (गतिज ऊर्जा) से जुड़ी स्वतंत्रता की तीन डिग्री होती है। मोनोआटोमिक प्रजातियों के लिए स्वतंत्रता की ये एकमात्र डिग्री हैं, जैसे महान गैस परमाणु।
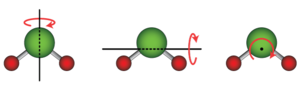
दो या दो से अधिक परमाणुओं वाली संरचना के लिए, पूरी संरचना में घूर्णी गतिज ऊर्जा भी होती है, जहाँ पूरी संरचना एक अक्ष के चारों ओर घूमती है।
एक रेखीय आणविक ज्यामिति, जहाँ सभी परमाणु एक अक्ष के साथ होते हैं, जैसे कोई द्विपरमाणुक अणु और कुछ अन्य अणु जैसे कार्बन डाईऑक्साइड (CO2), स्वतंत्रता की दो घूर्णी कोटि होती है, क्योंकि यह आणविक अक्ष के लम्बवत दो अक्षों में से किसी एक के बारे में घूम सकती है। एक अरैखिक अणु, जहां परमाणु एक धुरी के साथ नहीं रहते हैं, जैसे पानी के गुण (H2O), स्वतंत्रता की तीन घूर्णी डिग्री है, क्योंकि यह किसी भी तीन लंबवत अक्षों के चारों ओर घूम सकती है। विशेष मामलों में, जैसे अधिशोषित बड़े अणु, स्वतंत्रता की घूर्णी डिग्री केवल एक तक सीमित हो सकती है।[3] दो या दो से अधिक परमाणुओं वाली संरचना में कंपन ऊर्जा भी होती है, जहां व्यक्तिगत परमाणु एक दूसरे के संबंध में गति करते हैं। एक डायटोमिक अणु में एक आणविक कंपन मोड होता है: दो परमाणु वसंत के रूप में कार्य करने वाले रासायनिक बंधन के साथ आगे और आगे बढ़ते हैं। के साथ एक अणु N परमाणुओं में आणविक कंपन के अधिक जटिल तरीके होते हैं 3N − 5 एक रैखिक अणु के लिए कंपन मोड और 3N − 6 एक अरेखीय अणु के लिए मोड।[4] विशिष्ट उदाहरण के रूप में, रैखिक CO2 अणु में दोलन के 4 तरीके होते हैं,[5] और अरैखिक जल अणु में दोलन के 3 तरीके होते हैं[6] प्रत्येक कंपन मोड में दो ऊर्जा शब्द होते हैं: गतिमान परमाणुओं की गतिज ऊर्जा और वसंत जैसे रासायनिक बंधों की संभावित ऊर्जा। इसलिए, कंपन ऊर्जा शर्तों की संख्या 2(3N − 5) एक रैखिक अणु के लिए और 2(3N − 6) एक अरेखीय अणु के लिए मोड।
घूर्णी और कंपन मोड दोनों को परिमाणित किया जाता है, जिसके लिए न्यूनतम तापमान को सक्रिय करने की आवश्यकता होती है।[7] कई गैसों के लिए स्वतंत्रता की घूर्णी डिग्री को सक्रिय करने के लिए घूर्णी तापमान 100 K से कम है। एन के लिए2 और ओ2, यह 3 K से कम है।[1]पर्याप्त कंपन के लिए आवश्यक कंपन तापमान 10 के बीच है3 के और 104 के, 3521 के एन के लिए2 और 2156 के ओ के लिए2.[1]एन में कंपन को सक्रिय करने के लिए विशिष्ट वायुमंडलीय तापमान पर्याप्त नहीं हैं2 और ओ2, जिसमें अधिकांश वातावरण शामिल है। (अगला आंकड़ा देखें।) हालांकि, बहुत कम प्रचुर मात्रा में ग्रीनहाउस गैसें पृथ्वी की सतह से अवरक्त को अवशोषित करके क्षोभमंडल को गर्म रखती हैं, जो उनके कंपन मोड को उत्तेजित करता है।[8] इस ऊर्जा का अधिकांश भाग ग्रीनहाउस प्रभाव के माध्यम से इन्फ्रारेड में सतह पर वापस आ जाता है।
क्योंकि कमरे का तापमान (≈298 K) विशिष्ट घूर्णी तापमान से अधिक है, लेकिन विशिष्ट कंपन तापमान से कम है, केवल स्वतंत्रता के अनुवाद और घूर्णी डिग्री, समान मात्रा में, ताप क्षमता अनुपात में योगदान करते हैं। इसलिए γ≈5/3 एकपरमाण्विक गैसों के लिए और γ≈7/5 कमरे के तापमान पर दो परमाणुओंवाला गैसों के लिए।[1]

चूंकि पृथ्वी के वायुमंडल में डायटोमिक गैसों (नाइट्रोजन और ऑक्सीजन का योगदान लगभग 99% है) का प्रभुत्व है, इसकी दाढ़ आंतरिक ऊर्जा करीब है cv T = (5/2)RT, डायटोमिक गैसों द्वारा प्रदर्शित स्वतंत्रता की 5 डिग्री द्वारा निर्धारित।[citation needed][11][circular reference]
ग्राफ़ को दाईं ओर देखें। 140 के < T <380 के, सीv (5/2) से भिन्न Rd 1% से भी कम। केवल क्षोभमंडल और समताप मंडल में तापमान से काफी ऊपर के तापमान पर ही कुछ अणुओं में पर्याप्त ऊर्जा होती है जिससे वे N के कंपन मोड को सक्रिय कर सकें।2 और ओ2. स्थिर आयतन पर विशिष्ट ऊष्मा, cv, धीरे-धीरे (7/2) की ओर बढ़ता है R जैसे-जैसे तापमान T = 400 K से ऊपर बढ़ता है, जहाँ cv 1.3% ऊपर है (5/2) Rd = 717.5 जे / (के किलो)।
| Monatomic | Linear molecules | Non-linear molecules | |
|---|---|---|---|
| Translation (x, y, and z) | 3 | 3 | 3 |
| Rotation (x, y, and z) | 0 | 2 | 3 |
| Vibration (structural variations) | 0 | (3N − 5) | (3N − 6) |
एक स्थिति निर्दिष्ट करने के लिए निर्देशांक की न्यूनतम संख्या की गणना
किसी स्थिति को निर्दिष्ट करने के लिए आवश्यक न्यूनतम संख्या में निर्देशांक का उपयोग करके कोई भी स्वतंत्रता की डिग्री की गणना कर सकता है। यह अग्रानुसार होगा:
- एक कण के लिए हमें इसकी स्थिति निर्दिष्ट करने के लिए 2-डी विमान में 2 निर्देशांक और 3-डी अंतरिक्ष में 3 निर्देशांक की आवश्यकता होती है। इस प्रकार 3-डी अंतरिक्ष में इसकी स्वतंत्रता की डिग्री 3 है।
- एक 3-डी अंतरिक्ष में 2 कणों (उदाहरण के लिए एक डायटोमिक अणु) से युक्त शरीर के लिए उनके बीच निरंतर दूरी के साथ (मान लें कि डी) हम इसकी स्वतंत्रता की डिग्री (नीचे) 5 दिखा सकते हैं।
मान लीजिए कि इस शरीर में एक कण का समन्वय है (x1, y1, z1) और दूसरे ने समन्वय किया है (x2, y2, z2) साथ z2 अज्ञात। दो निर्देशांकों के बीच की दूरी के सूत्र का अनुप्रयोग
एक अज्ञात के साथ एक समीकरण में परिणाम, जिसमें हम के लिए हल कर सकते हैं z2. में से एक x1, x2, y1, y2, z1, या z2 अज्ञात हो सकता है।
क्लासिकल समविभाजन प्रमेय के विपरीत, कमरे के तापमान पर, अणुओं की कंपन गति आमतौर पर ताप क्षमता में नगण्य योगदान देती है। ऐसा इसलिए है क्योंकि स्वतंत्रता की ये डिग्री जमी हुई हैं क्योंकि ऊर्जा के बीच की दूरी परिवेश के तापमान के अनुरूप ऊर्जा से अधिक है (kBT).[1]
स्वतंत्रता की स्वतंत्र डिग्री
स्वतंत्रता की डिग्री का सेट {{math|X1, ... , XN}एक प्रणाली का } स्वतंत्र है यदि सेट से जुड़ी ऊर्जा को निम्नलिखित रूप में लिखा जा सकता है:
कहाँ Ei एकमात्र चर का एक कार्य है Xi.
उदाहरण: अगर X1 और X2 स्वतंत्रता की दो डिग्री हैं, और E संबंधित ऊर्जा है:
- अगर , तो स्वतंत्रता की दो डिग्री स्वतंत्र हैं।
- अगर , तब स्वतंत्रता की दो कोटि स्वतंत्र नहीं हैं। के उत्पाद को शामिल करने वाला शब्द X1 और X2 एक युग्मन शब्द है जो स्वतंत्रता की दो डिग्री के बीच की बातचीत का वर्णन करता है।
के लिए i 1 से N, का मूल्य i स्वतंत्रता की डिग्री Xi बोल्ट्जमैन वितरण के अनुसार वितरित किया जाता है। इसकी संभाव्यता घनत्व फ़ंक्शन निम्न है:
- ,
इस खंड में, और पूरे लेख में कोष्ठक उनके द्वारा संलग्न मात्रा के माध्य को निरूपित करें।
सिस्टम की आंतरिक ऊर्जा स्वतंत्रता की प्रत्येक डिग्री से जुड़ी औसत ऊर्जाओं का योग है:
स्वतंत्रता की द्विघात डिग्री
स्वतंत्रता की एक डिग्री Xi द्विघात है यदि स्वतंत्रता की इस डिग्री से जुड़ी ऊर्जा शर्तों को इस रूप में लिखा जा सकता है
- ,
कहाँ Y स्वतंत्रता की अन्य द्विघात कोटि का एक रेखीय संयोजन है।
उदाहरण: अगर X1 और X2 स्वतंत्रता की दो डिग्री हैं, और E संबंधित ऊर्जा है:
- अगर , तो स्वतंत्रता की दो डिग्री स्वतंत्र और गैर-द्विघात नहीं हैं।
- अगर , तो स्वतंत्रता की दो डिग्री स्वतंत्र और गैर-द्विघात हैं।
- अगर , तब स्वतंत्रता की दो कोटि स्वतंत्र नहीं हैं बल्कि द्विघात हैं।
- अगर , तो स्वतंत्रता की दो डिग्री स्वतंत्र और द्विघात हैं।
उदाहरण के लिए, न्यूटोनियन यांत्रिकी में, स्वतंत्रता की द्विघात डिग्री की एक प्रणाली की गतिशीलता (यांत्रिकी) को निरंतर गुणांक वाले सजातीय रैखिक अंतर समीकरणों के एक सेट द्वारा नियंत्रित किया जाता है।
स्वतंत्रता की द्विघात और स्वतंत्र डिग्री
X1, ... , XN स्वतंत्रता की द्विघात और स्वतंत्र डिग्री हैं यदि उनके द्वारा प्रतिनिधित्व की जाने वाली प्रणाली के एक माइक्रोस्टेट से जुड़ी ऊर्जा को इस प्रकार लिखा जा सकता है:
समविभाजन प्रमेय
सांख्यिकीय यांत्रिकी की शास्त्रीय सीमा में, थर्मोडायनामिक संतुलन पर, एक प्रणाली की आंतरिक ऊर्जा N स्वतंत्रता की द्विघात और स्वतंत्र डिग्री है:
यहाँ, स्वतंत्रता की डिग्री से जुड़ी औसत ऊर्जा है:
चूंकि स्वतंत्रता की डिग्री स्वतंत्र हैं, सिस्टम की आंतरिक ऊर्जा स्वतंत्रता की प्रत्येक डिग्री से जुड़ी औसत ऊर्जा के योग के बराबर होती है, जो परिणाम प्रदर्शित करती है।
सामान्यीकरण
अपने चरण स्थान में एक बिंदु (ज्यामिति) के रूप में एक प्रणाली की स्थिति का वर्णन, हालांकि गणितीय रूप से सुविधाजनक है, मौलिक रूप से गलत माना जाता है। क्वांटम यांत्रिकी में, स्वतंत्रता की गति की डिग्री तरंग फ़ंक्शन की अवधारणा से अलग हो जाती है, और ऑपरेटर (भौतिकी) जो स्वतंत्रता की अन्य डिग्री के अनुरूप होती है, में बिंदु स्पेक्ट्रम होता है। उदाहरण के लिए, एक इलेक्ट्रॉन या फोटॉन के लिए कोणीय संवेग संचालिका #स्पिन, कक्षीय, और कुल कोणीय संवेग संचालिका (जो घूर्णी स्वतंत्रता से मेल खाती है) में केवल दो eigenvalues होते हैं। यह असततता तब स्पष्ट हो जाती है जब क्रिया (भौतिकी) में प्लैंक स्थिरांक के परिमाण का एक क्रम होता है, और स्वतंत्रता की अलग-अलग डिग्री को अलग किया जा सकता है।
संदर्भ
- ↑ 1.0 1.1 1.2 1.3 1.4 Reif, F. (2009). सांख्यिकीय और तापीय भौतिकी के मूल सिद्धांत. Long Grove, IL: Waveland Press, Inc. p. 51. ISBN 978-1-57766-612-7.
- ↑ "Physical chemistry - Does a diatomic gas have one or two vibrational degrees of freedom?".
- ↑ Waldmann, Thomas; Klein, Jens; Hoster, Harry E.; Behm, R. Jürgen (2013). "Stabilization of Large Adsorbates by Rotational Entropy: A Time-Resolved Variable-Temperature STM Study". ChemPhysChem. 14 (1): 162–9. doi:10.1002/cphc.201200531. PMID 23047526.
- ↑ Molecular vibration[user-generated source]
- ↑ For drawings, see http://www.colby.edu/chemistry/PChem/notes/NormalModesText.pdf
- ↑ For drawings, see https://sites.cns.utexas.edu/jones_ch431/normal-modes-vibration
- ↑ Section 12-7 (pp. 376-379) of Sears and Salinger, 1975: Thermodynamics, Kinetic Theory, and Statistical Thermodynamics. Third edition. Addison-Wesley Publishing Co.
- ↑ "अणु कंपन करते हैं". UCAR Center for Science Education. Archived from the original on 2014-10-10. Retrieved 2021-01-19.
- ↑ "Air - Specific Heat vs. Temperature at Constant Pressure".
- ↑ Gatley, D. P., S. Herrmann, H.-J. Kretzshmar, 2008: A twenty-first century molar mass for dry air. HVAC&R Research, vol. 14, pp. 655-662.
- ↑ Equipartition theorem#Diatomic gases