रासायनिक यौगिक
एक रासायनिक यौगिक एक रासायनिक पदार्थ है जो कई समान अणु ओं (या आणविक इकाई ) से बना होता है जिसमें रासायनिक बंध ों द्वारा एक से अधिक रासायनिक तत्व ों के परमाणु होते हैं। इसलिए एक होमोन्यूक्लियर अणु एक यौगिक नहीं है। एक रासायनिक प्रतिक्रिया द्वारा एक यौगिक को एक अलग पदार्थ में परिवर्तित किया जा सकता है, जिसमें अन्य पदार्थों के साथ बातचीत शामिल हो सकती है। इस प्रक्रिया में, परमाणुओं के बीच के बंधन टूट सकते हैं और/या नए बंधन बन सकते हैं।
चार प्रमुख प्रकार के यौगिक हैं, जो इस बात से अलग हैं कि घटक परमाणु एक साथ कैसे बंधे हैं। आणविक यौगिक ों को सहसंयोजक बंधों द्वारा एक साथ रखा जाता है; आयनिक यौगिक ों को आयोनिक बंध द्वारा एक साथ रखा जाता है; इंटरमेटेलिक यौगिक ों को धात्विक बंधों द्वारा एक साथ रखा जाता है; समन्वय परिसर ों को समन्वय सहसंयोजक बंधों द्वारा एक साथ रखा जाता है। गैर-स्टोइकोमेट्रिक यौगिक एक विवादित सीमांत मामला बनाते हैं।
एक रासायनिक सूत्र संख्यात्मक सबस्क्रिप्ट के साथ मानक रासायनिक प्रतीक ों का उपयोग करते हुए, एक यौगिक अणु में प्रत्येक तत्व के परमाणुओं की संख्या निर्दिष्ट करता है। कई रासायनिक यौगिकों में रासायनिक सार सेवा द्वारा निर्दिष्ट एक अद्वितीय सीएएस संख्या पहचानकर्ता होता है। विश्व स्तर पर, 350,000 से अधिक रासायनिक यौगिकों (रसायनों के मिश्रण सहित) को उत्पादन और उपयोग के लिए पंजीकृत किया गया है।[1]
परिभाषाएं
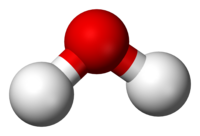
एक निश्चित स्टोइकोमेट्रिक अनुपात में दो या दो से अधिक विभिन्न प्रकार के परमाणुओं (रासायनिक तत्वों) से युक्त किसी भी पदार्थ को रासायनिक यौगिक कहा जा सकता है; शुद्ध रासायनिक पदार्थों पर विचार करते समय अवधारणा को सबसे आसानी से समझा जाता है।[2]: 15 [3][4] यह उनके दो या दो से अधिक प्रकार के परमाणुओं के निश्चित अनुपात से बना होने के कारण होता है कि रासायनिक यौगिकों को रासायनिक प्रतिक्रिया के माध्यम से यौगिकों या पदार्थों में परिवर्तित किया जा सकता है जिनमें से प्रत्येक में कम परमाणु होते हैं।[5] एक रासायनिक सूत्र परमाणुओं के अनुपात के बारे में जानकारी व्यक्त करने का एक तरीका है जो एक विशेष रासायनिक यौगिक का गठन करता है, रासायनिक तत्वों के लिए रासायनिक प्रतीकों का उपयोग करता है, और शामिल परमाणुओं की संख्या को इंगित करने के लिए सबस्क्रिप्ट करता है। उदाहरण के लिए, पानी एक ऑक्सीजन परमाणु से बंधे दो हाइड्रोजन परमाणु ओं से बना होता है: रासायनिक सूत्र H . है2ओ। गैर-स्टोइकोमेट्रिक यौगिकों के मामले में, अनुपात उनकी तैयारी के संबंध में पुन: उत्पन्न हो सकते हैं, और उनके घटक तत्वों के निश्चित अनुपात दे सकते हैं, लेकिन अनुपात जो अभिन्न नहीं हैं [उदाहरण के लिए, पैलेडियम हाइड्राइड , पीडीएच के लिएx (0.02 <एक्स < 0.58)]।[6] रासायनिक यौगिकों में एक अद्वितीय और परिभाषित रासायनिक संरचना होती है जो रासायनिक बंधों द्वारा परिभाषित स्थानिक व्यवस्था में एक साथ होती है। रासायनिक यौगिक सहसंयोजक बंधों द्वारा एक साथ रखे गए अणु यौगिक हो सकते हैं, आयनिक बंधों द्वारा एक साथ रखे गए नमक (रसायन विज्ञान) , धात्विक बंधों द्वारा एक साथ रखे गए इंटरमेटेलिक यौगिक, या समन्वय परिसर के उपसमुच्चय जो समन्वय सहसंयोजक बंधों द्वारा एक साथ रखे जाते हैं।[7] शुद्ध रासायनिक तत्वों को आम तौर पर रासायनिक यौगिक नहीं माना जाता है, दो या दो से अधिक परमाणु आवश्यकता को विफल करते हुए, हालांकि वे अक्सर कई परमाणुओं (जैसे डायटोमिक अणु एच में) से बने अणुओं से मिलकर बने होते हैं।2, या बहुपरमाणुक अणु S8, आदि।)।[7]कई रसायन विज्ञान यौगिकों में रासायनिक सार सेवा (सीएएस) द्वारा निर्दिष्ट एक अद्वितीय संख्यात्मक पहचानकर्ता होता है: इसकी सीएएस संख्या।
अलग-अलग और कभी-कभी असंगत नामकरण विभेदक पदार्थ होते हैं, जिनमें रासायनिक यौगिकों से वास्तव में गैर-स्टोइकोमेट्रिक उदाहरण शामिल होते हैं, जिन्हें निश्चित अनुपात की आवश्यकता होती है। कई ठोस रासायनिक पदार्थ-उदाहरण के लिए कई सिलिकेट खनिज -रासायनिक पदार्थ हैं, लेकिन उनके पास निश्चित अनुपात में तत्वों के रासायनिक रूप से एक दूसरे से बंधन को दर्शाने वाले सरल सूत्र नहीं होते हैं; फिर भी, इन क्रिस्टल संरचना वाले पदार्थों को अक्सर गैर-स्टोइकोमेट्रिक यौगिक कहा जाता है। यह तर्क दिया जा सकता है कि वे रासायनिक यौगिकों के बजाय संबंधित हैं, क्योंकि उनकी रचनाओं में परिवर्तनशीलता अक्सर या तो किसी अन्य ज्ञात सच्चे रासायनिक यौगिक के क्रिस्टल संरचना के भीतर फंसे विदेशी तत्वों की उपस्थिति के कारण होती है, या गड़बड़ी के कारण होती है। ज्ञात यौगिक के सापेक्ष संरचना में जो इसकी संरचना में स्थानों पर घटक तत्वों की अधिकता के कारण उत्पन्न होता है; इस तरह के गैर-स्टोइकोमेट्रिक पदार्थ पृथ्वी के अधिकांश क्रस्ट (भूविज्ञान) और मेंटल (भूविज्ञान) का निर्माण करते हैं। रासायनिक रूप से समान माने जाने वाले अन्य यौगिकों में घटक तत्वों के भारी या हल्के समस्थानिकों की मात्रा भिन्न हो सकती है, जो तत्वों के अनुपात को द्रव्यमान से थोड़ा बदल देता है।
प्रकार
अणु
एक अणु दो या दो से अधिक परमाणुओं का एक विद्युत रूप से तटस्थ समूह है जो रासायनिक बंधों द्वारा एक साथ रखा जाता है।[8][9][10] एक अणु होमोन्यूक्लियर हो सकता है, अर्थात इसमें एक रासायनिक तत्व के परमाणु होते हैं, जैसे ऑक्सीजन अणु में दो परमाणु होते हैं (O2); या यह हेटेरोन्यूक्लियर हो सकता है, एक रासायनिक यौगिक जो एक से अधिक तत्वों से बना होता है, जैसे कि पानी (अणु) (दो हाइड्रोजन परमाणु और एक ऑक्सीजन परमाणु; एच)2ओ)। अणु किसी पदार्थ की सबसे छोटी इकाई है जो अभी भी उस पदार्थ के सभी भौतिक और रासायनिक गुणों को वहन करता है।[11]
आयनिक यौगिक
एक आयन िक यौगिक एक रासायनिक यौगिक है जो आयनों से बना होता है जिसे कूलम्ब के नियम द्वारा आयनिक बंध न कहा जाता है। यौगिक समग्र रूप से तटस्थ है, लेकिन इसमें धनावेशित आयन होते हैं जिन्हें धनायन कहा जाता है और ऋणात्मक रूप से आवेशित आयन कहा जाता है। ये साधारण आयन हो सकते हैं जैसे सोडियम (Na .)+) और क्लोराइड (Cl .)−) सोडियम क्लोराइड , या पॉलीऐटोमिक आयन प्रजातियों जैसे अमोनियम में (NH+
4) और कार्बोनेट (CO2−
3) अमोनियम कार्बोनेट में आयन। एक आयनिक यौगिक के भीतर व्यक्तिगत आयनों में आमतौर पर कई निकटतम पड़ोसी होते हैं, इसलिए उन्हें अणुओं का हिस्सा नहीं माना जाता है, बल्कि एक निरंतर त्रि-आयामी नेटवर्क का हिस्सा माना जाता है, आमतौर पर एक क्रिस्टल संरचना में।
मूल आयन हीड्राकसीड युक्त आयनिक यौगिक (OH .)−) या ऑक्साइड (O .)2−) को आधारों के रूप में वर्गीकृत किया गया है। इन आयनों के बिना आयनिक यौगिकों को नमक (रसायन विज्ञान) के रूप में भी जाना जाता है और एसिड-बेस रिएक्शन # अरहेनियस थ्योरी | एसिड-बेस प्रतिक्रियाओं द्वारा बनाया जा सकता है। आयनिक यौगिकों को उनके विलायक , वर्षा (रसायन विज्ञान) , ठंड, एक ठोस-राज्य प्रतिक्रिया मार्ग | ठोस-राज्य प्रतिक्रिया, या प्रतिक्रियाशील गैर-धातुओं के साथ प्रतिक्रियाशील श्रृंखला धातुओं की इलेक्ट्रॉन स्थानांतरण प्रतिक्रिया के वाष्पीकरण द्वारा उनके घटक आयनों से भी उत्पादित किया जा सकता है। जैसे हलोजन गैसें।
आयनिक यौगिकों में आमतौर पर उच्च [[ गलन ांक ]] और क्वथनांक होते हैं, और कठोरता और भंगुरता होते हैं। ठोस के रूप में वे लगभग हमेशा इन्सुलेटर (विद्युत) होते हैं, लेकिन पिघलने या विघटन (रसायन विज्ञान) में वे अत्यधिक विद्युत प्रतिरोधकता और चालकता बन जाते हैं, क्योंकि आयन जुटाए जाते हैं।
इंटरमेटेलिक यौगिक
एक इंटरमेटेलिक यौगिक एक प्रकार का धातु बंधन मिश्र धातु है जो दो या दो से अधिक धातु तत्वों के बीच एक ठोस-अवस्था वाला यौगिक बनाता है। इंटरमेटेलिक्स आमतौर पर कठिन और भंगुर होते हैं, जिनमें अच्छे उच्च तापमान वाले यांत्रिक गुण होते हैं।[12][13][14] उन्हें स्टोइकोमेट्रिक या नॉनस्टोइकोमेट्रिक इंटरमेटेलिक यौगिकों के रूप में वर्गीकृत किया जा सकता है।[12]
परिसर
एक समन्वय परिसर में एक केंद्रीय परमाणु या आयन होता है, जो आमतौर पर धात्विक होता है और इसे समन्वय केंद्र कहा जाता है, और बाध्य अणुओं या आयनों की एक आसपास की सरणी होती है, जिसे बदले में लिगैंड या कॉम्प्लेक्सिंग एजेंट के रूप में जाना जाता है।[15][16][17] कई धातु युक्त यौगिक, विशेष रूप से संक्रमण धातु ओं के, समन्वय परिसर हैं।[18] एक समन्वय परिसर जिसका केंद्र एक धातु परमाणु होता है उसे डी ब्लॉक तत्व का धातु परिसर कहा जाता है।
बंधन और बल
विभिन्न प्रकार के बंधन और बलों के माध्यम से यौगिकों को एक साथ रखा जाता है। यौगिकों में बंधों के प्रकारों में अंतर यौगिक में मौजूद तत्वों के प्रकार के आधार पर भिन्न होता है।
लंदन फैलाव बल सभी अंतर-आणविक बलों की सबसे कमजोर शक्ति है। वे अस्थायी आकर्षक बल हैं जो तब बनते हैं जब दो आसन्न परमाणुओं में इलेक्ट्रॉनों को तैनात किया जाता है ताकि वे एक अस्थायी द्विध्रुवीय बना सकें। इसके अतिरिक्त, लंदन के फैलाव बल रासायनिक ध्रुवता वाले पदार्थों को तरल पदार्थ में संघनित करने के लिए और पर्यावरण के तापमान के कम होने पर निर्भर एक ठोस अवस्था में आगे जमने के लिए जिम्मेदार हैं।[19] एक सहसंयोजक बंधन, जिसे आणविक बंधन के रूप में भी जाना जाता है, में दो परमाणुओं के बीच इलेक्ट्रॉनों का बंटवारा होता है। मुख्य रूप से, इस प्रकार का बंधन उन तत्वों के बीच होता है जो तत्वों की आवर्त सारणी पर एक दूसरे के करीब आते हैं, फिर भी यह कुछ धातुओं और अधातुओं के बीच देखा जाता है। यह इस प्रकार के बंधन के तंत्र के कारण है। आवर्त सारणी पर एक दूसरे के करीब आने वाले तत्वों में समान विद्युतीयता होती है, जिसका अर्थ है कि उनमें इलेक्ट्रॉनों के लिए समान समानता है। चूंकि किसी भी तत्व में इलेक्ट्रॉनों को दान करने या प्राप्त करने के लिए एक मजबूत संबंध नहीं है, यह तत्वों को इलेक्ट्रॉनों को साझा करने का कारण बनता है, इसलिए दोनों तत्वों में अधिक स्थिर ऑक्टेट नियम होता है।
आयनिक बंधन तब होता है जब अणु की संयोजन क्षमता को तत्वों के बीच पूरी तरह से स्थानांतरित कर दिया जाता है। सहसंयोजक बंधन के विपरीत, यह रासायनिक बंधन दो विपरीत आवेशित आयन बनाता है। आयनिक बंधन में धातुएं आमतौर पर अपने वैलेंस इलेक्ट्रॉनों को खो देती हैं, एक सकारात्मक चार्ज धनायन बन जाती हैं। अधातु धातु से इलेक्ट्रॉनों को प्राप्त करेगी, जिससे अधातु ऋणात्मक रूप से आवेशित आयन बन जाएगी। जैसा कि उल्लिखित है, आयनिक बंधन एक इलेक्ट्रॉन दाता, आमतौर पर एक धातु और एक इलेक्ट्रॉन स्वीकर्ता के बीच होते हैं, जो एक अधातु होता है।[20] हाइड्रोजन बंध तब होती है जब एक इलेक्ट्रोनगेटिव परमाणु से जुड़ा हाइड्रोजन परमाणु दूसरे इलेक्ट्रोनगेटिव परमाणु के साथ इंटरैक्टिंग डिपोल्स या चार्ज के माध्यम से इलेक्ट्रोस्टैटिक कनेक्शन बनाता है।[21][22][23]
प्रतिक्रियाएं
एक रासायनिक प्रतिक्रिया के माध्यम से एक दूसरे रासायनिक यौगिक के साथ बातचीत करके एक यौगिक को एक अलग रासायनिक संरचना में परिवर्तित किया जा सकता है। इस प्रक्रिया में, दोनों परस्पर क्रिया करने वाले यौगिकों में परमाणुओं के बीच के बंधन टूट जाते हैं, और फिर बंधनों में सुधार किया जाता है ताकि परमाणुओं के बीच नए संबंध बन सकें। योजनाबद्ध रूप से, इस प्रतिक्रिया को इस प्रकार वर्णित किया जा सकता है AB + CD → AD + CB, जहां ए, बी, सी, और डी प्रत्येक अद्वितीय परमाणु हैं; और AB, AD, CD और CB प्रत्येक अद्वितीय यौगिक हैं।
यह भी देखें
- रासायनिक संरचना
- IUPAC नामकरण
- रासायनिक सूत्रों का शब्दकोश
- यौगिकों की सूची
संदर्भ
- ↑ Wang, Zhanyun; Walker, Glen W.; Muir, Derek C. G.; Nagatani-Yoshida, Kakuko (2020-01-22). "रासायनिक प्रदूषण की वैश्विक समझ की ओर: राष्ट्रीय और क्षेत्रीय रासायनिक सूची का पहला व्यापक विश्लेषण". Environmental Science & Technology. 54 (5): 2575–2584. Bibcode:2020EnST...54.2575W. doi:10.1021/acs.est.9b06379. PMID 31968937.
- ↑ Whitten, Kenneth W.; Davis, Raymond E.; Peck, M. Larry (2000), General Chemistry (6th ed.), Fort Worth, TX: Saunders College Publishing/Harcourt College Publishers, ISBN 978-0-03-072373-5
- ↑ Brown, Theodore L.; LeMay, H. Eugene; Bursten, Bruce E.; Murphy, Catherine J.; Woodward, Patrick (2013), Chemistry: The Central Science (3rd ed.), Frenchs Forest, NSW: Pearson/Prentice Hall, pp. 5–6, ISBN 9781442559462, archived from the original on 2021-05-31, retrieved 2020-12-08
- ↑ Hill, John W.; Petrucci, Ralph H.; McCreary, Terry W.; Perry, Scott S. (2005), General Chemistry (4th ed.), Upper Saddle River, NJ: Pearson/Prentice Hall, p. 6, ISBN 978-0-13-140283-6, archived from the original on 2009-03-22
- ↑ Wilbraham, Antony; Matta, Michael; Staley, Dennis; Waterman, Edward (2002), Chemistry (1st ed.), Upper Saddle River, NJ: Pearson/Prentice Hall, p. 36, ISBN 978-0-13-251210-7
- ↑ Manchester, F. D.; San-Martin, A.; Pitre, J. M. (1994). "एच-पीडी (हाइड्रोजन-पैलेडियम) प्रणाली". Journal of Phase Equilibria. 15: 62–83. doi:10.1007/BF02667685. S2CID 95343702. Phase diagram for Palladium-Hydrogen System
- ↑ 7.0 7.1 Atkins, Peter; Jones, Loretta (2004). रासायनिक सिद्धांत: अंतर्दृष्टि की खोज. W.H. Freeman. ISBN 978-0-7167-5701-6.
- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "Molecule". doi:10.1351/goldbook.M04002
- ↑ Ebbin, Darrell D. (1990). सामान्य रसायन शास्त्र (3rd ed.). Boston: Houghton Mifflin Co. ISBN 978-0-395-43302-7.
- ↑ Brown, T.L.; Kenneth C. Kemp; Theodore L. Brown; Harold Eugene LeMay; Bruce Edward Bursten (2003). रसायन विज्ञान - केंद्रीय विज्ञान (9th ed.). New Jersey: Prentice Hall. ISBN 978-0-13-066997-1.
- ↑ "अणु की परिभाषा - NCI कैंसर शब्दों का शब्दकोश - NCI". www.cancer.gov (in English). 2011-02-02. Retrieved 2022-08-26.
- ↑ 12.0 12.1 Askeland, Donald R.; Wright, Wendelin J. (January 2015). "11-2 Intermetallic Compounds". सामग्री का विज्ञान और इंजीनियरिंग (Seventh ed.). Boston, MA. pp. 387–389. ISBN 978-1-305-07676-1. OCLC 903959750. Archived from the original on 2021-05-31. Retrieved 2020-11-10.
{{cite book}}: CS1 maint: location missing publisher (link) - ↑ Panel On Intermetallic Alloy Development, Commission On Engineering And Technical Systems (1997). इंटरमेटेलिक मिश्र धातु विकास: एक कार्यक्रम मूल्यांकन. National Academies Press. p. 10. ISBN 0-309-52438-5. OCLC 906692179. Archived from the original on 2021-05-31. Retrieved 2020-11-10.
- ↑ Soboyejo, W. O. (2003). "1.4.3 Intermetallics". इंजीनियर सामग्री के यांत्रिक गुण. Marcel Dekker. ISBN 0-8247-8900-8. OCLC 300921090. Archived from the original on 2021-05-31. Retrieved 2020-11-10.
- ↑ Lawrance, Geoffrey A. (2010). समन्वय रसायन विज्ञान का परिचय. Wiley. doi:10.1002/9780470687123. ISBN 9780470687123.
- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "complex". doi:10.1351/goldbook.C01203
- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "coordination entity". doi:10.1351/goldbook.C01330
- ↑ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ↑ "लंदन फैलाव बल". www.chem.purdue.edu. Archived from the original on 2017-01-13. Retrieved 2017-09-13.
- ↑ "आयनिक और सहसंयोजक बंधन". Chemistry LibreTexts (in English). 2013-10-02. Archived from the original on 2017-09-13. Retrieved 2017-09-13.
- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "hydrogen bond". doi:10.1351/goldbook.H02899
- ↑ "हाइड्रोजन बंध". www.chem.purdue.edu. Archived from the original on 2011-08-08. Retrieved 2017-10-28.
- ↑ "इंटरमॉलिक्युलर बॉन्डिंग - हाइड्रोजन बॉन्ड". www.chemguide.co.uk. Archived from the original on 2016-12-19. Retrieved 2017-10-28.
इस पृष्ठ में अनुपलब्ध आंतरिक कड़ियों की सूची
- रासायनिक एब्सट्रैक्ट सर्विस
- धात्विक बंधन
- समन्वय सहसंयोजक बंधन
- सहसंयोजक बंधन
- द्विपरमाणुक अणु
- क्रिस्टल की संरचना
- आइसोटोप
- विद्युत तटस्थ
- ऋणायन
- कटियन
- बहुपरमाणुक आयन
- प्रतिक्रियाशीलता श्रृंखला
- जमना
- ठोस अवस्था प्रतिक्रिया मार्ग
- इन्सुलेटर (बिजली)
- धातु
- अंतर आणविक बल
- समय समय पर तत्वो की तालिका
- ओकटेट नियम
- वैद्युतीयऋणात्मकता
अग्रिम पठन
- Robert Siegfried (2002), From elements to atoms: a history of chemical composition, American Philosophical Society, ISBN 978-0-87169-924-4