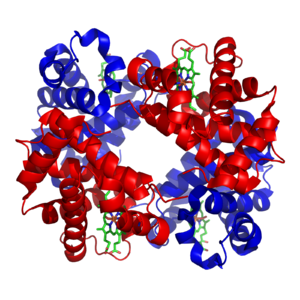
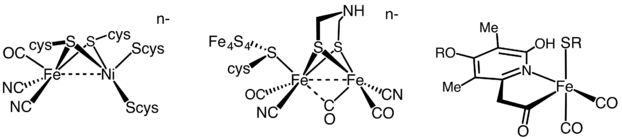
मेटालोप्रोटीन
मेटालोप्रोटीन, प्रोटीन के लिए सामान्य शब्द है जिसमें धातु आयन कॉफ़ेक्टर (जैव रसायन) होता है।[1][2] सभी प्रोटीनों का बड़ा भाग इस श्रेणी का मुख्य भाग होता है। उदाहरण के लिए, कम से कम 1000 मानव प्रोटीन (~20,000 में से) में जिंक से बाध्यकारी प्रोटीन डोमेन पाए जाते हैं।[3] चूंकि 3000 तक मानव जिंक मेटालोप्रोटीन होते हैं।[4]
अधिकता
यह अनुमान लगाया गया है कि सभी प्रोटीनों में से लगभग आधे में धातु होती है।[5] अन्य अनुमान में, सभी प्रोटीनों के लगभग चौथाई से तिहाई तक अपने कार्यों को पूर्ण करने के लिए धातुओं की आवश्यकता का प्रस्ताव दिया जाता है।[6] इस प्रकार, मेटालोप्रोटीन के सेल (जीव विज्ञान) में कई अलग-अलग कार्य करते हैं, जैसे कि प्रोटीन, एंजाइम और संकेत पारगमन प्रोटीन, या संक्रामक रोगों का भंडारण और परिवहन।[7] धातु बाध्यकारी प्रोटीन की प्रचुरता उन अमीनो अम्ल में निहित हो सकती है जो प्रोटीन उपयोग करते हैं, क्योंकि विकासवादी इतिहास के बिना कृत्रिम प्रोटीन भी धातुओं को सरलता से बांध देते हैं।[8]
मानव शरीर में अधिकांश धातुएं प्रोटीन से बंधी होती हैं। उदाहरण के लिए, मानव शरीर में लोहे की अपेक्षाकृत उच्च सांद्रता ज्यादातर हीमोग्लोबिन में लोहे के कारण होती है।
| लीवर | किडनी | फेफड़े | ह्रदय | मस्तिष्क | मांसपेशियाँ | |
|---|---|---|---|---|---|---|
| Mn (मैंगनीज) | 138 | 79 | 29 | 27 | 22 | <4-40 |
| Fe (लोहा) | 16,769 | 7,168 | 24,967 | 5,530 | 4,100 | 3,500 |
| Co (कोबाल्ट) | <2-13 | <2 | <2-8 | --- | <2 | 150 (?) |
| Ni (निकेल) | <5 | <5-12 | <5 | <5 | <5 | <15 |
| Cu (तांबा) | 882 | 379 | 220 | 350 | 401 | 85-305 |
| Zn (जस्ता) | 5,543 | 5,018 | 1,470 | 2,772 | 915 | 4,688 |
समन्वय रसायन विज्ञान का सिद्धांत
मेटालोप्रोटीन में, धातु आयन अतिरिक्त प्रोटीन के एमिनो अम्ल अवशेषों से संबंधित नाइट्रोजन, ऑक्सीजन या गंधक केंद्रों द्वारा समन्वित होते हैं। ये दाता समूह प्रायः अमीनो अम्ल अवशेषों पर साइड-चेन द्वारा प्रदान किए जाते हैं। विशेष रूप से हिस्टडीन अवशेषों में इमिडाजोल प्रतिस्थापन, सिस्टीन अवशेषों में थिओलेट प्रतिस्थापन, और एसपैरटेट द्वारा प्रदान किए गए कार्बोक्सिलेट समूह विशेष रूप से महत्वपूर्ण हैं। मेटालोप्रोटोम की विविधता को देखते हुए, वस्तुतः सभी अमीनो अम्ल अवशेषों को धातु केंद्रों को बांधने के लिए दिखाया गया है। पेप्टाइड बैकबोन दाता समूह भी प्रदान करता है, इनमें डिप्रोटोनेटेड एमाइड्स और एमाइड कार्बोनिल ऑक्सीजन केंद्र सम्मलित हैं। इस प्रकार लीड (II) को प्राकृतिक और कृत्रिम प्रोटीन में बाध्यकारी रूप से समीक्षा की जाती हैं।[10]
अमीनो अम्ल अवशेषों द्वारा प्रदान किए जाने वाले दाता समूहों के अतिरिक्त, कई कार्बनिक कॉफ़ैक्टर (जैव रसायन) लिगेंड के रूप में कार्य करते हैं। इस प्रकार सबसे प्रसिद्ध टेट्राडेंटेट N4 मैक्रोसाईक्लिक लिगैंड्स को हीम प्रोटीन में सम्मलित किया गया। सल्फाइड और ऑक्साइड जैसे अकार्बनिक लिगेंड भी सरल हैं।
भंडारण और परिवहन मेटालोप्रोटीन
ये प्रोटीन हाइड्रोलिसिस के दूसरे चरण के उत्पाद हैं जो मजबूत अम्ल और क्षार के साथ प्राप्त किए जाते हैं।
ऑक्सीजन वाहक
हीमोग्लोबिन, जो मनुष्यों में प्रमुख ऑक्सीजन-वाहक है, में चार सबयूनिट हैं जिनमें आयरन (II) आयन को प्लानर मैक्रोसाइक्लिक लिगैंड पॉरफाइरिन (PIX) और हिस्टीडाइन अवशेषों के इमिडाज़ोल नाइट्रोजन परमाणु द्वारा समन्वित किया जाता है। छठे समन्वय स्थल में पानी का अणु या डाइऑक्सीजन अणु होता है। इसके विपरीत मांसपेशियों की कोशिकाओं में पाए जाने वाले प्रोटीन माईओग्लोबिन में ऐसी इकाई होती है। सक्रिय साइट जल विरोधी पॉकेट में स्थित रहता है। यह महत्वपूर्ण है क्योंकि इसके बिना आयरन (II) अपरिवर्तनीय रूप से आयरन (III) का ऑक्सीकरण करता हैं। HBO2 के गठन के लिए परिसरों की स्थिरता स्थिरांक ऐसा है कि फेफड़ों या मांसपेशियों में ऑक्सीजन के आंशिक दबाव के आधार पर ऑक्सीजन ली या छोड़ी जाती है। हीमोग्लोबिन में चार सबयूनिट सहकारी प्रभाव दिखाते हैं जो हीमोग्लोबिन से मायोग्लोबिन तक सरलता से ऑक्सीजन हस्तांतरण की अनुमति देता है।[11]
हीमोग्लोबिन और मायोग्लोबिन दोनों में यह कभी-कभी गलत विधि से संयोजन करने लगता है जिसके कारण ऑक्सीजन युक्त प्रजातियों में लोहा (III) प्राप्त होता है। अब यह ज्ञात है कि इन प्रजातियों की प्रतिचुंबकीय प्रकृति इसलिए है क्योंकि लोहा (II) परमाणु निम्न-स्पिन अवस्था में है। ऑक्सीहीमोग्लोबिन में लोहे का परमाणु पोर्फिरिन रिंग के तल में स्थित होता है, किन्तु प्रति-चुंबकीय डीआक्सीहीमोग्लोबिन में लोहे का परमाणु रिंग के तल के ऊपर स्थित होता है।[11] उच्च क्रिस्टल क्षेत्र सिद्धांत और Fe2+ के छोटे परमाणु त्रिज्या के कारण स्पिन अवस्था में ऑक्सीहीमोग्लोबिन अंश में इसका परिवर्तन सहकारी प्रभाव देता हैं।
हेमरिथ्रिन अन्य लौह युक्त ऑक्सीजन वाहक है। ऑक्सीजन बाध्यकारी साइट द्विपक्षीय लौह केंद्र है। लोहे के परमाणुओं को ग्लूटामेट और एस्पार्टेट की कार्बोक्सिलेट साइड चेन और पांच हिस्टडीन अवशेषों के माध्यम से प्रोटीन से समन्वित किया जाता है। O2 का संग्रहण हेमरिथ्रिन द्वारा बाध्य पेरोक्साइड (ओओएच) का उत्पादन करने के लिए कम द्विपक्षीय केंद्र के दो-इलेक्ट्रॉन ऑक्सीकरण के साथ किया जाता है, इस प्रकार ऑक्सीजन लेने और छोड़ने की क्रियाविधि पर विस्तार से काम किया गया है।[12][13]
हेमोसायनिन अधिकांश मोलस्क के रक्त में ऑक्सीजन ले जाते हैं, और कुछ सन्धिपाद जैसे घोड़े की नाल, केकड़ा इत्यादि। ये ऑक्सीजन परिवहन में उपयोग की जाने वाली जैविक लोकप्रियता में हीमोग्लोबिन के बाद दूसरे स्थान पर हैं। ऑक्सीकरण पर सक्रिय स्थल पर दो ताँबा (I) परमाणु कॉपर (II) में ऑक्सीकृत हो जाते हैं और डाइऑक्सीजन O2−
2 अणु पेरोक्साइड में कम हो जाते हैं,[14][15]
क्लोरोक्रूओरिन (बड़े वाहक एरिथ्रोक्रूओरिन के रूप में) ऑक्सीजन-बाध्यकारी हीमप्रोटीन है जो कई एन्जिल्स्स के रक्त प्लाज़्मा में सम्मलित होता है, विशेष रूप से कुछ समुद्री पॉलीकीट्स में यह सम्मलित होता हैं।
साइटोक्रोमेस
कार्बनिक रसायन शास्त्र में ऑक्सीकरण और रिडॉक्स प्रतिक्रियाएं सरल नहीं हैं क्योंकि कुछ कार्बनिक अणु ऑक्सीकरण एजेंट या एजेंटों को कम करने के रूप में कार्य कर सकते हैं। दूसरी ओर, आयरन (II) को आसानी से आयरन (III) में ऑक्सीकृत किया जा सकता है। इस कार्यक्षमता का उपयोग साइटोक्रोम्स में किया जाता है, जो इलेक्ट्रॉन स्थानांतरण या इलेक्ट्रॉन-ट्रांसफर वैक्टर के रूप में कार्य करता है। धातु आयन की उपस्थिति मेटलोएंजाइम को रेडॉक्स प्रतिक्रियाओं जैसे कार्यों को करने की अनुमति देती है जो अमीनो अम्ल में पाए जाने वाले कार्यात्मक समूहों के सीमित सेट द्वारा सरलता से नहीं की जाती हैं।[16] अधिकांश साइटोक्रोम में लौह परमाणु हीम समूह में निहित होता है। उन साइटोक्रोमेस के बीच का अंतर अलग-अलग साइड-चेन में निहित है। उदाहरण के लिए साइटोक्रोम ए में हीम प्रोस्थेटिक समूह होता है और साइटोक्रोम बी में हीम बी प्रोस्थेटिक समूह होता है। इन अंतरों के परिणामस्वरूप अलग-अलग Fe2+/Fe3+होते हैं, रिडॉक्स क्षमताएं जैसे कि विभिन्न साइटोक्रोम माइटोकोंड्रिअल इलेक्ट्रॉन परिवहन श्रृंखला में सम्मलित हैं।[17]
साइटोक्रोम P450 एंजाइम ऑक्सीजन परमाणु को C−H बांड, ऑक्सीकरण प्रतिक्रिया में डालने का कार्य करते हैं।[18][19]
रुब्रेडॉक्सिन

रुब्रेडॉक्सिन इलेक्ट्रॉन-वाहक है जो सल्फर-मेटाबोलाइज़िंग जीवाणु और आर्किया में पाया जाता है। सक्रिय साइट में लगभग नियमित चतुर्पाश्वीय बनाने वाले चार सिस्टीन अवशेषों के सल्फर परमाणुओं द्वारा समन्वित लौह आयन होता है। रुब्रेडॉक्सिन एक-इलेक्ट्रॉन ट्रांसफर प्रक्रिया करते हैं। लोहे के परमाणु का ऑक्सीकरण स्थिति में +2 और +3 स्थितियों के बीच परिवर्तित करता है। दोनों ऑक्सीकरण स्थितियों में धातु उच्च स्पिन करते हैं, जो संरचनात्मक परिवर्तनों को कम करने में सहायता करते हैं।
प्लास्टोसायनिन
प्लास्टोसायनिन में कॉपर साइट प्लास्टोसायनिन ब्लू कॉपर प्रोटीन के परिवार में से है जो इलेक्ट्रॉन हस्तांतरण प्रतिक्रियाओं में सम्मलित है। कॉपर-बाइंडिंग साइट को विकृत ट्राइगोनल पिरामिडल आणविक ज्यामिति के रूप में पिरामिड आधार का त्रिकोणीय तल दो नाइट्रोजन परमाणुओं (N1 और n2) अलग हिस्टिडाइन और सल्फर (S1) सिस्टीन से वर्णित किया गया है।[20] सल्फर (S2) अक्षीय मेथिओनाइन से शीर्ष बनाता है। विरूपण तांबे और सल्फर लिगेंड के बीच बंधन की लंबाई में होता है। Cu−S1 संपर्क Cu−S2 से छोटा (282 - 207 पीकोमीटर) है।
लम्बी Cu−S2 बॉन्डिंग Cu(II) फॉर्म को अस्थिर कर देता है और प्रोटीन की रेडॉक्स क्षमता को बढ़ा देता है। नीला रंग (597 नैनोमीटर शिखर अवशोषण) Cu−S1 के कारण होता है बांड जहां S(pπ) से Cu(dx2−y2) आवेष स्थानांतरण करता है।[21]
प्लास्टोसायनिन के घटे हुए रूप में, हिस्टिडीन-87 pKa4.4 के अम्ल पृथक्करण स्थिरांक के साथ प्रोटोनीकृत हो जाएगा। प्रोटोनीकरण इसे लिगैंड के रूप में कार्य करने से रोकता है और कॉपर साइट ज्यामिति ट्राइगोनल प्लानर आणविक ज्यामिति बन जाती है।
धातु-आयन भंडारण और स्थानांतरण
लोहा
आयरन को फेरीटिन में आयरन (III) के रूप में संग्रहित किया जाता है। बाध्यकारी साइट की उत्तम प्रकृति अभी तक निर्धारित नहीं की गई है। ऐसा प्रतीत होता है कि लोहा हाइड्रोलिसिस उत्पाद जैसे कि FeO(OH) के रूप में सम्मलित है। लोहे को ट्रांसफरिन द्वारा ले जाया जाता है जिसकी बाध्यकारी साइट में दो टायरोसिन, एस्पार्टिक अम्ल और हिस्टडीन होता है।[22] मानव शरीर में लोहे के उत्सर्जन के लिए कोई तंत्र नहीं है। इससे रक्त आधान के साथ इलाज किए गए रोगियों में लोहे के अधिभार की समस्या हो सकती है, उदाहरण के लिए, β-थैलेसीमिया के साथ। लोहा वास्तव में मूत्र में उत्सर्जित होता है[23] और पित्त में भी केंद्रित है[24] जो मल के साथ बाहर निकल जाता है।[25]
कॉपर
सेरुलोप्लाज्मिन रक्त में प्रमुख कॉपर ले जाने वाला प्रोटीन है। सेरुलोप्लाज्मिन ऑक्सीडेज गतिविधि प्रदर्शित करता है, जो Fe (II) के Fe (III) में संभावित ऑक्सीकरण से जुड़ा हुआ है, इसलिए ट्रांसफ़रिन के सहयोग से रक्त प्लाज्मा में इसके परिवहन में सहायता करता है, जो केवल Fe (III) अवस्था में लोहे को ले जा सकता है।
कैल्शियम
ओस्टियोपोंट हड्डियों और दांतों के बाह्य मैट्रिक्स में खनिजकरण में सम्मलित है।
मेटालोएंजाइम
मेटालोएंजाइम सभी में विशेषता समान है, अर्थात् धातु आयन प्रोटीन के लिए देयता समन्वय यौगिक साइट के साथ बंधे हैं। जैसा कि सभी एंजाइमों के साथ होता है, सक्रिय स्थल का आकार महत्वपूर्ण होता है। धातु आयन अतिरिक्त जेब में स्थित होता है जिसका आकार सब्सट्रेट को फिट करता है। धातु आयन कटैलिसीस प्रतिक्रियाएं जो कार्बनिक रसायन विज्ञान में हासिल करना कठिनाई है।
कार्बोनिक एनहाइड्रेज़

जलीय घोल में कार्बन डाईऑक्साइड कार्बोनिक अम्ल बनाता है
- CO2 + H2O ⇌ H2CO3
उत्प्रेरक की अनुपस्थिति में यह प्रतिक्रिया बहुत धीमी होती है, किन्तु हाइड्रॉक्साइड आयन की उपस्थिति में अत्यधिक तेज होती है
- CO2 + CO- ⇌ H
- कार्बोनेट |HCO−
3इसी तरह की प्रतिक्रिया कार्बोनिक एनहाइड्रेज़ के साथ लगभग तात्कालिक होती है। कार्बनिक एनहाइड्रेज में सक्रिय साइट की संरचना कई क्रिस्टल संरचनाओं से अच्छी तरह से जानी जाती है। इसमें तीन हिस्टिडाइन इकाइयों से तीन इमिडाज़ोल नाइट्रोजन परमाणुओं द्वारा समन्वित जस्ता आयन होता है। चौथा समन्वय स्थल पानी के अणु द्वारा अधिकार स्थापित कर लिया गया है। जिंक आयन का समन्वय क्षेत्र लगभग टेट्राहेड्रल आणविक ज्यामिति है। सकारात्मक रूप से आवेशित जिंक आयन समन्वित जल अणु का ध्रुवीकरण करता है, और कार्बन डाइऑक्साइड पर नकारात्मक रूप से आवेशित हाइड्रॉक्साइड भाग द्वारा न्युक्लेओफ़िलिक के हमले पर तेजी से होता है। उत्प्रेरक चक्र बाइकार्बोनेट आयन और हाइड्रोजन आयन उत्पन्न करता है[2] रासायनिक संतुलन के रूप में इस समीकरण द्वारा इसे दर्शाया जा सकता हैं। - H2CO3 ⇌ HCO−
3 + H+
जैविक पीएच मान पर कार्बोनिक अम्ल के पृथक्करण का समर्थन करता है।[26]
विटामिन बी12-निर्भर एंजाइम
कोबाल्ट युक्त विटामिन बी12|विटामिन बी12(कोबालिन के रूप में भी जाना जाता है) मिथाइल (−CH3) दो अणुओं के बीच समूह, जिसमें कार्बन-कार्बन बांड|C−C बांड को तोड़ना शामिल है, एक प्रक्रिया जो जैविक प्रतिक्रियाओं में ऊर्जावान रूप से महंगी है। धातु आयन एक क्षणिक सह-सीएच बनाकर प्रक्रिया के लिए सक्रियण ऊर्जा को कम करता है3 गहरा संबंध।[27] कोएंजाइम की संरचना प्रसिद्ध रूप से डोरोथी हॉजकिन और सहकर्मियों द्वारा निर्धारित की गई थी, जिसके लिए उन्हें रसायन विज्ञान में नोबेल पुरस्कार मिला था।[28] इसमें कोबाल्ट (II) आयन होता है जो कोरिन रिंग के चार नाइट्रोजन परमाणुओं और इमिडाज़ोल समूह से पांचवां नाइट्रोजन परमाणु होता है। विश्राम अवस्था में एडेनोसाइन के 5' कार्बन परमाणु के साथ Co-C सिग्मा बंधन होता है।[29] यह प्राकृतिक रूप से पाया जाने वाला और्गेनोधातु यौगिक है, जो ट्रांस-मिथाइलेशन प्रतिक्रियाओं में इसके कार्य की व्याख्या करता है, जैसे कि 5-मिथाइलटेट्राहाइड्रोफोलेट-होमोसिस्टीन मिथाइलट्रांसफेरेज़ द्वारा की गई प्रतिक्रिया।
नाइट्रोजनेस (नाइट्रोजन स्थिरीकरण)
नाइट्रोजन स्थिरीकरण बहुत ही ऊर्जा-गहन प्रक्रिया है, क्योंकि इसमें नाइट्रोजन परमाणुओं के बीच बहुत स्थिर त्रिबंध को तोड़ना सम्मलित है। एंजाइम नाइट्रोजिनेज़ उन कुछ एंजाइमों में से है जो इस प्रक्रिया को उत्प्रेरित कर सकते हैं। एंजाइम राइजोबियम (जीनस) बैक्टीरिया में होता है। इसकी क्रिया के तीन घटक हैं: सक्रिय स्थल पर मोलिब्डेनम परमाणु, लौह-सल्फर क्लस्टर|लौह-सल्फर क्लस्टर जो नाइट्रोजन को कम करने के लिए आवश्यक इलेक्ट्रॉनों के परिवहन में सम्मलित होते हैं, और मैगनीशियम एडेनोसाइन ट्रायफ़ोस्फेट के रूप में प्रचुर मात्रा में ऊर्जा स्रोत . यह आखिरी बैक्टीरिया और मेजबान पौधे, प्रायः फली के बीच पारस्परिकता (जीव विज्ञान) द्वारा प्रदान किया जाता है। प्रतिक्रिया को प्रतीकात्मक रूप में लिखा जा सकता है
- N2 + 16 मिलीग्राम एडिनोसिन ट्राइफॉस्फेट + 8 e− → 2 अमोनिया या NH3+ 16 मिलीग्राम एडेनोसाइन डाइफॉस्फेट +16 Pi + H2
जहां Pi अकार्बनिक फास्फेट के लिए खड़ा है। सक्रिय साइट की उत्तम संरचना निर्धारित करना कठिनाई हो गया है। ऐसा प्रतीत होता है कि इसमें MoFe7S8 है जहाँ क्लस्टर जो डाइनाइट्रोजन अणु को बाँधने में सक्षम है और संभवतः इस कमी को प्रारंभ करने में सक्षम बनाता है।[30] इलेक्ट्रॉनों को संबद्ध P क्लस्टर द्वारा ले जाया जाता है, जिसमें सल्फर ब्रिज से जुड़े क्लस्टर दो घन Fe4S4 होते हैं।[31]
सुपरऑक्साइड डिसम्यूटेज
सुपरऑक्साइड आयन, O−
2 आणविक ऑक्सीजन की कमी से जैविक प्रणालियों में उत्पन्न होता है। इसमें अयुग्मित इलेक्ट्रॉन है, इसलिए यह मुक्त मूलक के रूप में व्यवहार करता है। यह शक्तिशाली ऑक्सीकरण एजेंट है। ये गुण सुपरऑक्साइड आयन को बहुत विषाक्तता प्रदान करते हैं और हमलावर सूक्ष्मजीवों को मारने के लिए फ़ैगोसाइट द्वारा लाभ के लिए नियत किए जाते हैं। अन्यथा, सेल में अवांछित क्षति करने से पहले सुपरऑक्साइड आयन को नष्ट किया जाना चाहिए। सुपरऑक्साइड डिसम्यूटेज़ एंजाइम इस कार्य को बहुत कुशलता से करते हैं।[32]
ऑक्सीजन परमाणुओं की औपचारिक ऑक्सीकरण अवस्था 1⁄2 है, जो तटस्थ पीएच पर समाधान में, आणविक ऑक्सीजन और हाइड्रोजन पेरोक्साइड के लिए सुपरऑक्साइड आयन अनुपातहीनता विधि का उपयोग करता हैं।
- 2O−
2 + 2 H+ → O2 + H2O2
जीव विज्ञान में इस प्रकार की प्रतिक्रिया को विघटन प्रतिक्रिया कहा जाता है। इसमें सुपरऑक्साइड आयनों का ऑक्सीकरण और अपचयन दोनों सम्मलित हैं। एंजाइमों का सुपरऑक्साइड डिसम्यूटेज (एसओडी) समूह प्रतिक्रिया की दर को प्रसार-सीमित दर के पास बढ़ा देता है।[33] इन एंजाइमों की क्रिया की कुंजी धातु आयन है जो परिवर्तनीय ऑक्सीकरण अवस्था के साथ है जो ऑक्सीकरण एजेंट या कम करने वाले एजेंट के रूप में कार्य कर सकता है।
- ऑक्सीकरण: M(n+1)+ + O−
2 → Mn+ + O2 - कमी होने पर : Mn+ + O−
2 + 2 H+ → M(n+1)+ + H2O2
मानव SOD में सक्रिय धातु तांबा है, जैसा कि Cu(II) या Cu(I), चार हिस्टडीन अवशेषों द्वारा समन्वित टेट्राहेड्रल आणविक ज्यामिति। इस एंजाइम में स्थिरीकरण के लिए जिंक आयन भी होते हैं और सुपरऑक्साइड डिसम्यूटेज (सीसीएस (जीन)) के लिए कॉपर चैपरोन द्वारा सक्रिय किया जाता है। अन्य आइसोज़ाइम में लोहा, मैंगनीज या निकल हो सकता है। नी-एसओडी विशेष रूप से रोचक है क्योंकि इसमें निकेल (III) सम्मलित है, जो इस तत्व के लिए असामान्य ऑक्सीकरण अवस्था है। थिओलेट (Cys2 और Cys6) और बैकबोन नाइट्रोजन (उनकी और Cys2) लिगेंड्स, वर्ग पिरामिड आण्विक ज्यामिति Ni(III) के साथ अतिरिक्त अक्षीय रूप के साथ साइड चेन लिगैंड के रूप में उपयोग किया जाता हैं।[34]
क्लोरोफिल युक्त प्रोटीन
प्रकाश संश्लेषण में क्लोरोफिल महत्वपूर्ण भूमिका निभाता है। इसमें क्लोरीन रिंग में संलग्न मैग्नीशियम होता है। चूंकि, मैग्नीशियम आयन सीधे प्रकाश संश्लेषक कार्य में सम्मलित नहीं होता है और गतिविधि के कम नुकसान के साथ अन्य द्विसंयोजक आयनों द्वारा प्रतिस्थापित किया जा सकता है। बल्कि, फोटॉन को क्लोरीन रिंग द्वारा अवशोषित किया जाता है, जिसकी इलेक्ट्रॉनिक संरचना इस उद्देश्य के लिए अच्छी तरह से अनुकूलित है।
प्रारंभ में, फोटॉन के अवशोषण के कारण इलेक्ट्रॉन क्यू बैंड की एकल अवस्था में उत्तेजित हो जाता है। उत्तेजित अवस्था एकल अवस्था से त्रिगुणात्मक अवस्था में अंतर-प्रणाली को पार करती है जिसमें समानांतर इलेक्ट्रॉन स्पिन के साथ दो इलेक्ट्रॉन होते हैं। यह प्रजाति, वास्तव में, मुक्त मूलक है, और बहुत प्रतिक्रियाशील है और क्लोरोप्लास्ट में क्लोरोफिल से सटे स्वीकारकर्ताओं को इलेक्ट्रॉन स्थानांतरित करने की अनुमति देती है। इस प्रक्रिया में क्लोरोफिल ऑक्सीकृत होता है। बाद में प्रकाश संश्लेषक चक्र में, क्लोरोफिल फिर से कम हो जाता है। यह कमी अंततः पानी से इलेक्ट्रॉनों को खींचती है, अंतिम ऑक्सीकरण उत्पाद के रूप में आणविक ऑक्सीजन प्रदान करती है।
हाइड्रोजनेज
सक्रिय साइट धातु सामग्री के आधार पर हाइड्रोजनीज़ को तीन अलग-अलग प्रकारों में उपवर्गीकृत किया जाता है: आयरन-आयरन हाइड्रोजनेज़, निकल-आयरन हाइड्रोजनेज़ और आयरन हाइड्रोजनेज़।[35]
सभी हाइड्रोजन गैसें उत्क्रमणीय हाइड्रोजन|H को उत्प्रेरित करती हैं2तेज, किन्तु जबकि [FeFe] और [NiFe] हाइड्रोजन गैसें सही रेडॉक्स कटैलिसीस हैं, जो H को चलाती हैं2 ऑक्सीकरण और एच+ कमी
- H2 ⇌ 2 H+ + 2
[Fe] हाइड्रोजन गैसें H के उत्क्रमणीय विषम अपघटनी विदलन को उत्प्रेरित करती हैं2.
- H2 ⇌ H+ + H-
राइबोजाइम और डीऑक्सीराइबोजाइम
1980 के दशक की प्रारंभ में थॉमस Cech और सिडनी ऑल्टमैन द्वारा राइबोज़ाइम की खोज के बाद से, राइबोज़ाइम को मेटालोएंज़ाइम का अलग वर्ग दिखाया गया है।[36] रासायनिक उत्प्रेरण के लिए कई राइबोजाइमों को उनके सक्रिय स्थलों में धातु आयनों की आवश्यकता होती है, इसलिए उन्हें मेटालोएंजाइम कहा जाता है। इसके अतिरिक्त, राइबोजाइम के संरचनात्मक स्थिरीकरण के लिए धातु आयन आवश्यक हैं। समूह I उत्प्रेरक इंट्रॉन सबसे अधिक अध्ययन किया जाने वाला राइबोजाइम है जिसमें तीन धातुएँ कटैलिसीस में भाग लेती हैं।[37] अन्य ज्ञात राइबोज़ाइम में समूह II इंट्रॉन, राइबोन्यूक्लिएज पी, और कई छोटे वायरल राइबोज़ाइम (जैसे हैमरहेड राइबोजाइम, हेयरपिन राइबोजाइम, हेपेटाइटिस डेल्टा वायरस राइबोजाइम, और वीएस राइबोजाइम) और राइबोसोम की बड़ी सबयूनिट सम्मलित हैं। हाल ही में, राइबोज़ाइम के चार नए वर्गों की खोज की गई है (ट्विस्टर राइबोजाइम, ट्विस्टर सिस्टर, पिस्टल और हैचेट नाम से) जो सभी स्व-क्लीविंग राइबोज़ाइम हैं।[38]
डीऑक्सीराइबोजाइम, जिसे डीएनएज़ाइम या उत्प्रेरक डीएनए भी कहा जाता है, कृत्रिम उत्प्रेरक डीएनए अणु हैं जो पहली बार 1994 में निर्मित किए गए थे। [39] इस प्रकार इस प्रक्रिया में तेजी से वृद्धि हुई हैं। लगभग सभी डीएनए एंजाइमों को कार्य करने के लिए धातु आयनों की आवश्यकता होती है, इस प्रकार उन्हें मेटालोएंजाइम के रूप में वर्गीकृत किया जाता है। चूंकि राइबोजाइम ज्यादातर आरएनए सबस्ट्रेट्स के क्लीवेज को उत्प्रेरित करते हैं, आरएनए/डीएनए क्लीवेज, आरएनए/डीएनए लिगेशन, अमीनो अम्ल फास्फोराइलेशन और डिफॉस्फोराइलेशन, और कार्बन-कार्बन बॉन्ड गठन सहित डीएनएजाइम द्वारा विभिन्न प्रकार की प्रतिक्रियाएं उत्प्रेरित की जा सकती हैं।[40] फिर भी, आरएनए दरार प्रतिक्रिया को उत्प्रेरित करने वाले डीएनए एंजाइम सबसे व्यापक रूप से खोजे गए हैं। 1997 में खोजा गया 10-23 डीएनए एंजाइम, चिकित्सीय एजेंट के रूप में नैदानिक अनुप्रयोगों के साथ सबसे अधिक अध्ययन किए गए उत्प्रेरक डीएनए में से है।[41] जीआर-5 डीएनए एंजाइम (लेड (धातु)-विशिष्ट) CA1-3 डीएनए एंजाइम (कॉपर-विशिष्ट), 39E डीएनए एंजाइम (यूरेनिल-विशिष्ट)[42] और NaA43 डीएनए एंजाइम (सोडियम-विशिष्ट) सहित कई धातु-विशिष्ट डीएनए एंजाइमों की रिपोर्ट की गई है।[43][44]
सिग्नल-ट्रांसडक्शन मेटालोप्रोटीन
शांतोडुलिन
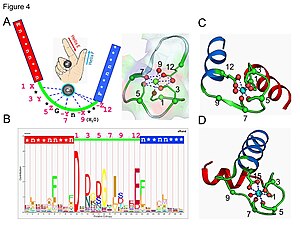
शांतोडुलिन सिग्नल-ट्रांसडक्शन प्रोटीन का उदाहरण है। यह छोटा प्रोटीन है जिसमें चार Fe2+ मोटिफ होते हैं, जिनमें से प्रत्येक कैल्शियम या Ca आयन को बांधने में सक्षम होता है।
ईएफ-हैंड लूप प्रोटीन डोमेन में, कैल्शियम आयन को पंचकोनाल बिपिरामाइडल कॉन्फ़िगरेशन में समन्वित किया जाता है। बाइंडिंग में सम्मलित छह ग्लुटामिक अम्ल और एसपारटिक अम्ल के अवशेष पॉलीपेप्टाइड श्रृंखला की स्थिति 1, 3, 5, 7 और 9 में हैं। स्थिति 12 पर, ग्लूटामेट या एस्पार्टेट लिगैंड होता है जो (बिडेंटेट लिगैंड) के रूप में व्यवहार करता है, दो ऑक्सीजन परमाणु प्रदान करता है। रीढ़ की हड्डी की गठनात्मक आवश्यकताओं के कारण लूप में नौवां अवशेष आवश्यक रूप से ग्लाइसिन है। कैल्शियम आयन के समन्वय क्षेत्र में केवल कार्बोक्सिलेट ऑक्सीजन परमाणु होते हैं और नाइट्रोजन परमाणु नहीं होते हैं। यह कैल्शियम आयन की एचएसएबी प्रकृति के अनुरूप है।
प्रोटीन में लगभग दो सममित डोमेन होते हैं, जो लचीले हिंग क्षेत्र से अलग होते हैं। कैल्शियम के बंधन से प्रोटीन में गठनात्मक परिवर्तन होता है। कैल्मोडुलिन प्रारंभिक उत्तेजनाओं के लिए फैलाने योग्य दूसरे संदेशवाहक के रूप में कार्य करके सेल सिग्नलिंग सिस्टम में भाग लेता है।[45][46]
ट्रोपोनिन
हृदय की मांसपेशियों और कंकाल की मांसपेशियों दोनों में, मांसपेशियों के बल का उत्पादन मुख्य रूप से इंट्रासेल्युलर कैल्शियम एकाग्रता (रसायन विज्ञान) में परिवर्तन से नियंत्रित होता है। अतिरिक्त, जब कैल्शियम बढ़ता है, तो मांसपेशियां सिकुड़ती हैं और जब कैल्शियम गिरता है, तो मांसपेशियां शिथिल हो जाती हैं। ट्रोपोनिन, एक्टिन और ट्रोपोमायोसिन के साथ, प्रोटीन कॉम्प्लेक्स है जिससे कैल्शियम मांसपेशियों के बल के उत्पादन को गति प्रदान करता है।
प्रतिलेखन कारक
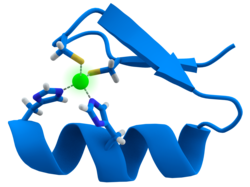
कई प्रतिलेखन कारकों में संरचना होती है जिसे जिंक फिंगर के रूप में जाना जाता है, यह संरचनात्मक मॉड्यूल है जहां प्रोटीन का क्षेत्र जिंक आयन के चारों ओर मोड़ता है। जिंक सीधे डीएनए से संपर्क नहीं करता है जिससे ये प्रोटीन जुड़ते हैं। इसके अतिरिक्त, कसकर मुड़ी हुई प्रोटीन श्रृंखला की स्थिरता के लिए कोफ़ेक्टर आवश्यक है।[47] इन प्रोटीनों में, जिंक आयन अतिरिक्त सिस्टीन और हिस्टडीन साइड-चेन के जोड़े द्वारा समन्वित होता है।
अन्य मेटलोएंजाइम
कार्बन मोनोऑक्साइड डिहाइड्रोजनेज दो प्रकार के होते हैं: में लोहा और मोलिब्डेनम होता है, दूसरे में लोहा और निकल होता है। उत्प्रेरक रणनीतियों में समानताएं और अंतर की समीक्षा की गई है।[48]
Pb2+ (लेड) Ca2+ (कैल्शियम) की जगह ले सकता है, उदाहरण के लिए, शांतोडुलिन या Zn2+ (जिंक) मेटलोकार्बोक्सीपेप्टिडेज़ के साथ[49]
सम्मलित धातु के अनुसार कुछ अन्य मेटलोएंजाइम निम्नलिखित तालिका में दिए गए हैं।
यह भी देखें
संदर्भ
- ↑ Banci L (2013). Sigel A, Sigel H, Sigel RK (eds.). Metallomics and the Cell. pp. 1–13. doi:10.1007/978-94-007-5561-1_1. ISBN 978-94-007-5561-1. PMID 23595668.
{{cite book}}:|journal=ignored (help) - ↑ 2.0 2.1 Shriver DF, Atkins PW (1999). "Charper 19, Bioinorganic chemistry". Inorganic chemistry (3rd ed.). Oxford University Press. ISBN 978-0-19-850330-9.
- ↑ Human reference proteome in Uniprot, accessed 12 Jan 2018
- ↑ Andreini C, Banci L, Bertini I, Rosato A (November 2006). "Zinc through the three domains of life". Journal of Proteome Research. 5 (11): 3173–8. doi:10.1021/pr0603699. PMID 17081069.
- ↑ Thomson AJ, Gray HB (1998). "Bioinorganic chemistry" (PDF). Current Opinion in Chemical Biology. 2 (2): 155–158. doi:10.1016/S1367-5931(98)80056-2. PMID 9667942.
- ↑ Waldron KJ, Robinson NJ (January 2009). "How do bacterial cells ensure that metalloproteins get the correct metal?". Nature Reviews. Microbiology. 7 (1): 25–35. doi:10.1038/nrmicro2057. PMID 19079350. S2CID 7253420.
- ↑ Carver PL (2013). "Chapter 1. Metal Ions and Infectious Diseases. An Overview from the Clinic". In Sigel A, Sigel H, Sigel RK (eds.). Interrelations between Essential Metal Ions and Human Diseases. Metal Ions in Life Sciences. Vol. 13. Springer. pp. 1–28. doi:10.1007/978-94-007-7500-8_1. ISBN 978-94-007-7499-5. PMID 24470087.
- ↑ Wang, MS; Hoegler, KH; Hecht, M (2019). "Unevolved De Novo Proteins Have Innate Tendencies to Bind Transition Metals". Life. 9 (8): 8. doi:10.3390/life9010008. PMC 6463171. PMID 30634485.
- ↑ Maret W (February 2010). "Metalloproteomics, metalloproteomes, and the annotation of metalloproteins". Metallomics. 2 (2): 117–25. doi:10.1039/b915804a. PMID 21069142.
- ↑ Cangelosi V, Ruckthong L, Pecoraro VL (2017). "Chapter 10. Lead(II) Binding in Natural and Artificial Proteins". In Astrid S, Helmut S, Sigel RK (eds.). Lead: Its Effects on Environment and Health. Metal Ions in Life Sciences. Vol. 17. de Gruyter. pp. 271–318. doi:10.1515/9783110434330-010. ISBN 9783110434330. PMC 5771651. PMID 28731303.
- ↑ 11.0 11.1 Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8. Fig.25.7, p 1100 illustrates the structure of deoxyhemoglobin
- ↑ Stenkamp, R. E. (1994). "Dioxygen and hemerythrin". Chem. Rev. 94 (3): 715–726. doi:10.1021/cr00027a008.
- ↑ Wirstam M, Lippard SJ, Friesner RA (April 2003). "Reversible dioxygen binding to hemerythrin". Journal of the American Chemical Society. 125 (13): 3980–7. doi:10.1021/ja017692r. PMID 12656634.
- ↑ Karlin K, Cruse RW, Gultneh Y, Farooq A, Hayes JC, Zubieta J (1987). "Dioxygen–copper reactivity. Reversible binding of O2 and CO to a phenoxo-bridged dicopper(I) complex". J. Am. Chem. Soc. 109 (9): 2668–2679. doi:10.1021/ja00243a019.
- ↑ Kitajima N, Fujisawa K, Fujimoto C, Morooka Y, Hashimoto S, Kitagawa T, Toriumi K, Tatsumi K, Nakamura A (1992). "A new model for dioxygen binding in hemocyanin. Synthesis, characterization, and molecular structure of the μ-η2:η2-peroxo dinuclear copper(II) complexes, [Cu(Hb(3,5-R2pz)3)]2(O2) (R = isopropyl and Ph)". J. Am. Chem. Soc. 114 (4): 1277–1291. doi:10.1021/ja00030a025.
- ↑ Messerschmidt A, Huber R, Wieghardt K, Poulos T (2001). Handbook of Metalloproteins. Wiley. ISBN 978-0-471-62743-2.
- ↑ Moore GR, Pettigrew GW (1990). Cytochrome c: Structural and Physicochemical Aspects. Berlin: Springer.
- ↑ Sigel A, Sigel H, Sigel RK, eds. (2007). The Ubiquitous Roles of Cytochrome 450 Proteins. Metal Ions in Life Sciences. Vol. 3. Wiley. ISBN 978-0-470-01672-5.
- ↑ Ortiz de Montellano P (2005). Cytochrome P450 Structure, Mechanism, and Biochemistry (3rd ed.). Springer. ISBN 978-0-306-48324-0.
- ↑ Colman PM, Freeman HC, Guss JM, Murata M, Norris VA, Ramshaw JA, Venkatappa MP (1978). "X-Ray Crystal-Structure Analysis of Plastocyanin at 2.7 Å Resolution". Nature. 272 (5651): 319–324. Bibcode:1978Natur.272..319C. doi:10.1038/272319a0. S2CID 4226644.
- ↑ Solomon EI, Gewirth AA, Cohen SL (1986). Spectroscopic Studies of Active Sites. Blue Copper and Electronic Structural Analogs. pp. 236–266. doi:10.1021/bk-1986-0307.ch016. ISBN 978-0-8412-0971-8.
{{cite book}}:|journal=ignored (help) - ↑ Anderson BF, Baker HM, Dodson EJ, Norris GE, Rumball SV, Waters JM, Baker EN (April 1987). "Structure of human lactoferrin at 3.2-A resolution". Proceedings of the National Academy of Sciences of the United States of America. 84 (7): 1769–73. doi:10.1073/pnas.84.7.1769. PMC 304522. PMID 3470756.
- ↑ Rodríguez E, Díaz C (December 1995). "Iron, copper and zinc levels in urine: relationship to various individual factors". Journal of Trace Elements in Medicine and Biology. 9 (4): 200–9. doi:10.1016/S0946-672X(11)80025-8. PMID 8808191.
- ↑ Schümann K, Schäfer SG, Forth W (1986). "Iron absorption and biliary excretion of transferrin in rats". Research in Experimental Medicine. Zeitschrift für die Gesamte Experimentelle Medizin Einschliesslich Experimenteller Chirurgie. 186 (3): 215–9. doi:10.1007/BF01852047. PMID 3738220. S2CID 7925719.
- ↑ "Biliary excretion of waste products". Archived from the original on 2017-03-26. Retrieved 2017-03-24.
- ↑ Lindskog S (1997). "कार्बोनिक एनहाइड्रेज़ की संरचना और तंत्र". Pharmacology & Therapeutics. 74 (1): 1–20. doi:10.1016/S0163-7258(96)00198-2. PMID 9336012.
- ↑ Sigel A, Sigel H, Sigel RK, eds. (2008). Metal–carbon bonds in enzymes and cofactors. Metal Ions in Life Sciences. Vol. 6. Wiley. ISBN 978-1-84755-915-9.
- ↑ "The Nobel Prize in Chemistry 1964". Nobelprize.org. Retrieved 2008-10-06.
- ↑ Hodgkin, D. C. (1965). "The Structure of the Corrin Nucleus from X-ray Analysis". Proc. R. Soc. A. 288 (1414): 294–305. Bibcode:1965RSPSA.288..294H. doi:10.1098/rspa.1965.0219. S2CID 95235740.
- ↑ Orme-Johnson, W. H. (1993). Steifel, E. I.; Coucouvannis, D.; Newton, D. C. (eds.). Molybdenum enzymes, cofactors and model systems. Advances in chemystry, Symposium series no. 535. Washington, DC: American Chemical Society. pp. 257. ISBN 9780841227088.
- ↑ Chan MK, Kim J, Rees DC (May 1993). "The nitrogenase FeMo-cofactor and P-cluster pair: 2.2 A resolution structures". Science. 260 (5109): 792–4. doi:10.1126/science.8484118. PMID 8484118.
- ↑ Packer, L., ed. (2002). Superoxide Dismutase: 349 (Methods in Enzymology). Academic Press. ISBN 978-0-12-182252-1.
- ↑ Heinrich P, Löffler G, Petrides PE (2006). Biochemie und Pathobiochemie (in German). Berlin: Springer. p. 123. ISBN 978-3-540-32680-9.
{{cite book}}: CS1 maint: unrecognized language (link) - ↑ Barondeau DP, Kassmann CJ, Bruns CK, Tainer JA, Getzoff ED (June 2004). "Nickel superoxide dismutase structure and mechanism". Biochemistry. 43 (25): 8038–47. doi:10.1021/bi0496081. PMID 15209499.
- ↑ Parkin, Alison (2014). "Chapter 5. Understanding and Harnessing Hydrogenases, Biological Dihydrogen Catalysts". In Kroneck, Peter M. H.; Sosa Torres, Martha E. (eds.). The Metal-Driven Biogeochemistry of Gaseous Compounds in the Environment. Metal Ions in Life Sciences. Vol. 14. Springer. pp. 99–124. doi:10.1007/978-94-017-9269-1_5. ISBN 978-94-017-9268-4. PMID 25416392.
- ↑ Pyle AM (August 1993). "Ribozymes: a distinct class of metalloenzymes". Science. 261 (5122): 709–14. Bibcode:1993Sci...261..709P. doi:10.1126/science.7688142. PMID 7688142.
- ↑ Shan S, Yoshida A, Sun S, Piccirilli JA, Herschlag D (October 1999). "Three metal ions at the active site of the Tetrahymena group I ribozyme". Proceedings of the National Academy of Sciences of the United States of America. 96 (22): 12299–304. Bibcode:1999PNAS...9612299S. doi:10.1073/pnas.96.22.12299. PMC 22911. PMID 10535916.
- ↑ Weinberg Z, Kim PB, Chen TH, Li S, Harris KA, Lünse CE, Breaker RR (August 2015). "New classes of self-cleaving ribozymes revealed by comparative genomics analysis". Nature Chemical Biology. 11 (8): 606–10. doi:10.1038/nchembio.1846. PMC 4509812. PMID 26167874.
- ↑ Breaker RR, Joyce GF (December 1994). "A DNA enzyme that cleaves RNA". Chemistry & Biology. 1 (4): 223–9. doi:10.1016/1074-5521(94)90014-0. PMID 9383394.
- ↑ Silverman SK (May 2015). "Pursuing DNA catalysts for protein modification". Accounts of Chemical Research. 48 (5): 1369–79. doi:10.1021/acs.accounts.5b00090. PMC 4439366. PMID 25939889.
- ↑ Santoro SW, Joyce GF (April 1997). "A general purpose RNA-cleaving DNA enzyme". Proceedings of the National Academy of Sciences of the United States of America. 94 (9): 4262–6. Bibcode:1997PNAS...94.4262S. doi:10.1073/pnas.94.9.4262. PMC 20710. PMID 9113977.
- ↑ Liu J, Brown AK, Meng X, Cropek DM, Istok JD, Watson DB, Lu Y (February 2007). "A catalytic beacon sensor for uranium with parts-per-trillion sensitivity and millionfold selectivity". Proceedings of the National Academy of Sciences of the United States of America. 104 (7): 2056–61. Bibcode:2007PNAS..104.2056L. doi:10.1073/pnas.0607875104. PMC 1892917. PMID 17284609.
- ↑ Breaker RR, Joyce GF (December 1994). "A DNA enzyme that cleaves RNA". Chemistry & Biology (in English). 1 (4): 223–9. doi:10.1016/1074-5521(94)90014-0. PMID 9383394.
- ↑ Torabi SF, Wu P, McGhee CE, Chen L, Hwang K, Zheng N, Cheng J, Lu Y (May 2015). "In vitro selection of a sodium-specific DNAzyme and its application in intracellular sensing". Proceedings of the National Academy of Sciences of the United States of America. 112 (19): 5903–8. Bibcode:2015PNAS..112.5903T. doi:10.1073/pnas.1420361112. PMC 4434688. PMID 25918425.
- ↑ Stevens FC (August 1983). "Calmodulin: an introduction". Canadian Journal of Biochemistry and Cell Biology. 61 (8): 906–10. doi:10.1139/o83-115. PMID 6313166.
- ↑ Chin D, Means AR (August 2000). "Calmodulin: a prototypical calcium sensor". Trends in Cell Biology. 10 (8): 322–8. doi:10.1016/S0962-8924(00)01800-6. PMID 10884684.
- ↑ Berg JM (1990). "Zinc finger domains: hypotheses and current knowledge". Annual Review of Biophysics and Biophysical Chemistry. 19 (1): 405–21. doi:10.1146/annurev.bb.19.060190.002201. PMID 2114117.
- ↑ Jeoung J, Fesseler J, Goetzl S, Dobbek H (2014). "Chapter 3. Carbon Monoxide. Toxic Gas and Fuel for Anaerobes and Aerobes: Carbon Monoxide Dehydrogenases". In Kroneck PM, Sosa Torres ME (eds.). The Metal-Driven Biogeochemistry of Gaseous Compounds in the Environment. Metal Ions in Life Sciences. Vol. 14. Springer. pp. 37–69. doi:10.1007/978-94-017-9269-1_3. ISBN 978-94-017-9268-4. PMID 25416390.
- ↑ Aoki K, Murayama K, Hu N (2017). "Chapter 7. Solid State Structures of Lead Complexes with Relevance for Biological Systems". In Astrid S, Helmut S, Sigel RK (eds.). Lead: Its Effects on Environment and Health. Metal Ions in Life Sciences. Vol. 17. de Gruyter. pp. 123–200. doi:10.1515/9783110434330-007. ISBN 9783110434330. PMID 28731300.
- ↑ Romani, Andrea M. P. (2013). "Chapter 4. Magnesium Homeostasis in Mammalian Cells". In Banci, Lucia (ed.). Metallomics and the Cell. Metal Ions in Life Sciences. Vol. 12. Springer. pp. 69–118. doi:10.1007/978-94-007-5561-1_4. ISBN 978-94-007-5561-1. ISSN 1868-0402. PMID 23595671.
- ↑ Roth J, Ponzoni S, Aschner M (2013). "Chapter 6. Manganese Homeostasis and Transport". In Banci L (ed.). Metallomics and the Cell. Metal Ions in Life Sciences. Vol. 12. Springer. pp. 169–201. doi:10.1007/978-94-007-5561-1_6. ISBN 978-94-007-5561-1. ISSN 1868-0402. PMC 6542352. PMID 23595673.
- ↑ Dlouhy AC, Outten CE (2013). "Chapter 8. The Iron Metallome in Eukaryotic Organisms". In Banci L (ed.). Metallomics and the Cell. Metal Ions in Life Sciences. Vol. 12. Springer. pp. 241–78. doi:10.1007/978-94-007-5561-1_8. ISBN 978-94-007-5561-1. ISSN 1868-0402. PMC 3924584. PMID 23595675.
- ↑ Cracan V, Banerjee R (2013). "Chapter 10 Cobalt and Corrinoid Transport and Biochemistry". In Banci L (ed.). Metallomics and the Cell. Metal Ions in Life Sciences. Vol. 12. Springer. doi:10.1007/978-94-007-5561-10_10 (inactive 31 December 2022). ISBN 978-94-007-5561-1. ISSN 1868-0402.
{{cite book}}: CS1 maint: DOI inactive as of December 2022 (link) - ↑ Sigel A, Sigel H, Sigel RK, eds. (2008). Nickel and Its Surprising Impact in Nature. Metal Ions in Life Sciences. Vol. 2. Wiley. ISBN 978-0-470-01671-8.
- ↑ Sydor AM, Zambie DB (2013). "Chapter 11. Nickel Metallomics: General Themes Guiding Nickel Homeostasis". In Banci L (ed.). Metallomics and the Cell. Metal Ions in Life Sciences. Vol. 12. Springer. doi:10.1007/978-94-007-5561-10_11 (inactive 31 December 2022). ISBN 978-94-007-5561-1. ISSN 1868-0402.
{{cite book}}: CS1 maint: DOI inactive as of December 2022 (link) - ↑ Vest KE, Hashemi HF, Cobine PA (2013). "Chapter 13. The Copper Metallome in Eukaryotic Cells". In Banci L (ed.). Metallomics and the Cell. Metal Ions in Life Sciences. Vol. 12. Springer. doi:10.1007/978-94-007-5561-10_12 (inactive 31 December 2022). ISBN 978-94-007-5561-1. ISSN 1868-0402.
{{cite book}}: CS1 maint: DOI inactive as of December 2022 (link) - ↑ Maret W (2013). "Chapter 14 Zinc and the Zinc Proteome". In Banci L (ed.). Metallomics and the Cell. Metal Ions in Life Sciences. Vol. 12. Springer. doi:10.1007/978-94-007-5561-10_14 (inactive 31 December 2022). ISBN 978-94-007-5561-1. ISSN 1868-0402.
{{cite book}}: CS1 maint: DOI inactive as of December 2022 (link) - ↑ Peackock AF, Pecoraro V (2013). "Chapter 10. Natural and artificial proteins containing cadmium". In Sigel A, Sigel H, Sigel RK (eds.). Cadmium: From Toxicology to Essentiality. Metal Ions in Life Sciences. Vol. 11. Springer. pp. 303–337. doi:10.1007/978-94-007-5179-8_10. ISBN 978-94-007-5178-1. PMID 23430777.
- ↑ Freisinger EF, Vasac M (2013). "Chapter 11. Cadmium in Metallothioneins". In Sigel A, Sigel H, Sigel RK (eds.). Cadmium: From Toxicology to Essentiality. Metal Ions in Life Sciences. Vol. 11. Springer. pp. 339–372. doi:10.1007/978-94-007-5179-8_11. ISBN 978-94-007-5178-1. PMID 23430778.
- ↑ Mendel, Ralf R. (2013). "Chapter 15. Metabolism of Molybdenum". In Banci, Lucia (ed.). Metallomics and the Cell. Metal Ions in Life Sciences. Vol. 12. Springer. doi:10.1007/978-94-007-5561-10_15 (inactive 31 December 2022). ISBN 978-94-007-5561-1. ISSN 1868-0402.
{{cite book}}: CS1 maint: DOI inactive as of December 2022 (link) - ↑ ten Brink, Felix (2014). "Chapter 2. Living on acetylene. A Primordial Energy Source". In Kroneck, Peter M. H.; Sosa Torres, Martha E. (eds.). The Metal-Driven Biogeochemistry of Gaseous Compounds in the Environment. Metal Ions in Life Sciences. Vol. 14. Springer. pp. 15–35. doi:10.1007/978-94-017-9269-1_2. ISBN 978-94-017-9268-4. PMID 25416389.
बाहरी संबंध
- Metalloprotein at the US National Library of Medicine Medical Subject Headings (MeSH)
- Catherine Drennan's Seminar: Snapshots of Metalloproteins