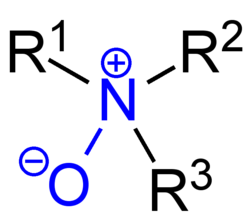
अमीन ऑक्साइड
रसायन शास्त्र में, अमीन ऑक्साइड, जिसे अमीन एन-ऑक्साइड या एन'-ऑक्साइड के रूप में भी जाना जाता है, एक रासायनिक यौगिक है जो एक कार्यात्मक समूह R3N+−O−, या नाइट्रोजन-ऑक्सीजन को सम्मलित करता है, जो N के साथ एक नाइट्रोजन-ऑक्सीजन समन्वयी कोवलेंट बॉन्ड होता है। जो N से जुड़े तीन अतिरिक्त हाइड्रोजन और / या सबस्टीट्यूट ग्रुप साइड चेनों से युक्त होते हैं। कभी-कभी इसे R3N→O या, गलत रूप से, R3N=O के रूप में भी लिखा जाता है।
सख्त अर्थ में, अमीन ऑक्साइड शब्द एकमात्र तीसरे श्रेणी के अमीन के ऑक्साइड के लिए होता है। कभी-कभी यह प्राथमिक और द्वितीय अमीनों के समानवर्ती अपवर्तकों के लिए भी उपयोग किया जाता है।
अमीन ऑक्साइड के उदाहरणों में पाइरीडीन-एन-ऑक्साइड सम्मलित हैं | पाइरीडीन-एन-ऑक्साइड, पानी में घुलनशील क्रिस्टलीय ठोस जिसका गलनांक 62–67 डिग्री सेल्सियस होता है, और एन-मिथाइलमॉर्फोलिन एन-ऑक्साइड|एन-मिथाइलमॉर्फोलिन एन-ऑक्साइड, जो ऑक्सीडेंट है।
अनुप्रयोग
अमीन ऑक्साइड सामान के रूप में शैम्पू, कंडीशनर, डिटर्जेंट और हार्ड सरफेस क्लीनर जैसे उपभोक्ता उत्पादों में सामान्यतः सरफेक्टेंट के रूप में उपयोग किए जाते हैं।[1] अल्काइल डाइमेथाइल अमीन ऑक्साइड (श्रृंखला लंबाई C10-C16) सबसे अधिक वाणिज्यिक रूप से उपयोग किया जाने वाला अमीन ऑक्साइड है।[2] वे आर्थिक सहयोग और विकास संगठन (OECD)के कम से कम सदस्य देश में उच्च उत्पादन मात्रा वाले यौगिकों के रूप में माने जाते हैं; संयुक्त राज्य अमेरिका, यूरोप और जापान में वार्षिक उत्पादन 26,000, 16,000 and 6,800 tonnes (28,700, 17,600 and 7,500 short tons) से अधिक है।[1]उत्तरी अमेरिका में, एमिन ऑक्साइड का 95% से अधिक घरेलू सफाई उत्पादों में उपयोग किया जाता है।[3] वे स्थिरक, मोटाई देने वाले एजेंट, एमोलिएंट्स, एमल्सिफायर्स और कंडीशनर्स के रूप में सेवा करते हैं जिनकी सक्रिय घटक सामान्य रूप से 0.1-10% के भीतर होती हैं।[1]शेष (<5%) व्यक्तिगत देखभाल, संस्थागत, वाणिज्यिक उत्पादों में उपयोग किया जाता है और फोटोग्राफी जैसे अद्वितीय पेटेंट के उपयोगों के लिए भी उपयोग किया जाता है।[4] [1]
गुण
अमीन ऑक्साइड का उपयोग अमीन के लिए सुरक्षात्मक समूह के रूप में और रासायनिक संश्लेषण मध्यवर्ती के रूप में किया जाता है। लंबी-श्रृंखला एल्काइल अमीन ऑक्साइड का उपयोग उभयधर्मी पृष्ठसक्रियकारक और फोम स्टेबलाइजर्स के रूप में किया जाता है।
अमीन ऑक्साइड अत्यधिक ध्रुवीय अणु होते हैं और उनकी रासायनिक ध्रुवता चतुर्धातुक अमोनियम लवण के निकट होती है। छोटे अमीन ऑक्साइड बहुत ही हाइड्रोफिलिक होते हैं और उनमें उत्कृष्ट पानी (अणु) घुलनशीलता होती है और अधिकांश कार्बनिक विलायक में बहुत कम घुलनशीलता होती है।
अमीन ऑक्साइड कमजोर आधार (रसायन विज्ञान) होते हैं जिनका pKbअधिकतर 4.5 होता है जो उनके pKb से कम pH पर प्रोटोनेशन पर R3N+−OH, कैटाइनिकहाइड्रोक्सीलामीन, बनाते हैं।
संश्लेषण
अधिकतर सभी ऐमिन ऑक्साइड हाइड्रोजन पेरोक्साइड के उत्पादन के माध्यम से उत्पन्न किए जाते हैं जो तृतीय एलिफैटिक ऐमिन या एरोमेटिक N-विषमचक्र के ऑक्सीकरण के माध्यम से तैयार किए जाते हैं। हाइड्रोजन पेरोक्साइड औद्योगिक और शिक्षा दोनों में सबसे आम अभिकर्मक है, चूंकि पेरासिड भी महत्वपूर्ण होते हैं।[5] अधिक विशिष्ट ऑक्सीडाइजिंग एजेंट आला उपयोग देख सकते हैं, उदाहरण के लिए कैरो का एसिड या मेटा-क्लोरोपरॉक्सीबेंजोइक एसिड। आणविक ऑक्सीजन का उपयोग कर सहज या उत्प्रेरित प्रतिक्रियाएं दुर्लभ हैं। कुछ अन्य प्रतिक्रियाएं भी अमीन ऑक्साइड का उत्पादन करती हैं, जैसे कोप उन्मूलन, चूंकि वे संभवतः ही कभी नियोजित होते हैं।
प्रतिक्रियाएं
अमीन ऑक्साइड कई प्रकार की प्रतिक्रियाएँ प्रदर्शित करते हैं।[6]
- पायरोलाइटिक उन्मूलन: अमीन ऑक्साइड, जब 150-200 °C के तापमान पर गरम किया जाता है,तो हाइड्रॉक्सिलामाइन निकालते हुए एल्केन उत्पन्न करते हैं। इस पायरोलिसिस सिन-उन्मूलन प्रतिक्रिया को प्रतिक्रिया का सामना करें के नाम से जाना जाता है। तंत्र हॉफमैन उन्मूलन के समान है।
- अमीन्स में कमी: लिथियम एल्यूमीनियम हाइड्राइड, सोडियम बोरोहाइड्राइड, उत्प्रेरक कमी, जस्ता /एसीटिक अम्ल और आयरन/एसिटिक एसिड सहित आम रिडॉक्स अभिकर्मकों के माध्यम से अमीन ऑक्साइड आसानी से मूल एमाइन में परिवर्तित हो जाते हैं। पाइरिडाइन एन-ऑक्साइड को फास्फोरस ऑक्सीक्लोराइड के माध्यम से डीऑक्सीजन किया जा सकता है ।
- बलि कटैलिसीस। एन-मिथाइलमॉर्फोलिन एन-ऑक्साइड के माध्यम से आज़मियम टेट्रोक्साइड के पुनर्जनन के स्थितियों में एन-ऑक्साइड की कमी से ऑक्सीडेंट को पुनर्जीवित किया जा सकता है।
- ओ-अल्काइलेशन। पाइरीडीन एन-ऑक्साइड्स अल्काइल हलाइड के साथ ओ-अल्काइलेटेड उत्पाद पर प्रतिक्रिया करते हैं।
- Bis-ter-pyridine डेरिवेटिव चांदी की सतहों पर सोख लिया ऑक्सीजन के साथ bis-ter-pyridine N-ऑक्साइड पर प्रतिक्रिया करने के लिए चर्चा की जाती है। उप-आण्विक संकल्प के साथ वीडियो-स्कैनिंग टनलिंग माइक्रोस्कोपी के माध्यम से इस प्रतिक्रिया का पालन किया जा सकता है।[7]
- मीसेनहाइमर पुनर्व्यवस्था में (जैकब मीसेनहाइमर के बाद) कुछ एन-ऑक्साइड्स R1R2R3N+O− हाइड्रॉक्सिलामाइन की पुनर्व्यवस्था प्रतिक्रिया R2R3N-O-R1[8][9]
मेटाबोलाइट्स
अमीन ऑक्साइड दवा और साइकोएक्टिव दवाओं के सामान्य विघटक हैं। उदाहरणों में निकोटीन, ज़ोलमिट्रिप्टन और अफ़ीम का सत्त्व सम्मलित हैं।
कीमोथेरपी के अमीन ऑक्साइड | कैंसर रोधी दवाओं को ठंडा ्स के रूप में विकसित किया गया है जो ऑक्सीजन की कमी वाले कैंसर जैविक ऊतक में सक्रिय दवा के रूप में मेटाबोलाइज़ किए जाते हैं।
मानव सुरक्षा
अमीन ऑक्साइड (AO) को कार्सिनोजेन, डर्मल सेंसिटाइजर या जनन विषाक्त नहीं माना जाता है। यदि यह खाया जाए तो वह आसानी से मेटाबोलाइज्ड और उत्सर्जित हो जाता है। खरगोशों के माध्यम से दीर्घकालिक खुराक लेने से निम्नतम अनुद्देश्य प्रभाव स्तर (LOAEL) के रेंज में 87-150 मिलीग्राम एओ / किलोवॉट-बॉडी वजन / दिन के तौर पर निचले शरीर के वजन, दस्त और आँखों के अस्पष्ट दिखाई देने वाले संकेत हुए हैं। मानव त्वचा के संपर्क की परीक्षणों में पाया गया है कि 8 घंटों के बाद शरीर में एकमात्र 1% से कम अवशोषित होता है। अमीन ऑक्साइड और अन्य सरफेक्टेंट्स के कारण आँखों में दर्द होता है जो मध्यम और अस्थायी होता है और कोई टिकाऊ प्रभाव नहीं होता है।[1]
पर्यावरण सुरक्षा
औसत श्रृंखला लंबाई 12.6 वाले एमिन ऑक्साइडों को अधिकतर 410 ग्राम प्रति लीटर की जल में विलयनशील मापा गया है। ये C14 से कम श्रृंखला वाले एमिन ऑक्साइडों के लॉग Kow डेटा पर आधारित जैव-संचयन क्षमता के लिए कम हैं (जीवों में जीव-संचयन अंक <87%)।[1]असंशोधित इन्फ्लुएंट में एमिन ऑक्साइड के स्तर 2.3-27.8 ug L−1 मिले, चूँकि इफ्लुएंट में वे 0.4-2.91 ug L−1 मिले। सबसे अधिक इफ्लुएंट उत्पादन खाद और ट्रिकलिंग फ़िल्टर उपचार संयंत्रों में पाए गए। सेकेंडरी सक्रिय स्लज उपचार के साथ औसतन, 96% से अधिक हटाने का प्रतिशत पाया गया है।[2]मछलियों में तीव्र विषाक्तता, 96 घंटे LC50 परीक्षणों के माध्यम से दर्शायी गई है, जो C14 से कम कार्बन शृंखलाओं के लिए 1,000-3,000 ug L−1 की अंकित में होती है। C14 से अधिक शृंखलाओं के लिए LC50 मूल्य 600 से 1400 यूजी L−1 की अंकित में होते हैं। मछलियों के लिए अवसादक विषाक्तता आंकड़े 420 ug/L है। C12.9 को सामान्य करने पर, वृद्धि और अंकुरण के लिए NOEC 310 ug L−1 होता है।[2]
यह भी देखें
- कार्यात्मक समूह
- अमीन, NR3
- हाइड्रॉक्सिलमाइन, NR2OH
- फॉस्फीन ऑक्साइड, PR3=O
- सल्फॉक्साइड, R2S=O
- अज़ॉक्सी, RN=N+(O−)R RN=N+RO−
- सामान्य संरचना आर के साथ अमीनोक्सिल समूह रेडिकल्स2नहीं•
- :श्रेणी:अमीन आक्साइड, विशिष्ट अमीन-आक्साइड यौगिकों पर सभी लेख युक्त
संदर्भ
- ↑ Jump up to: 1.0 1.1 1.2 1.3 1.4 1.5 Organisation for Economic Co-operation and Development (OECD) (2006). "अमीन ऑक्साइड". OECD Existing Chemicals Database. Archived from the original on 22 February 2014.
- ↑ Jump up to: 2.0 2.1 2.2 Sanderson, H; C Tibazarwa; W Greggs; DJ Versteeg (2009). "उच्च उत्पादन आयतन रासायनिक अमीन ऑक्साइड [C8–C20]". Risk Analysis. 29 (6): 857–867. doi:10.1111/j.1539-6924.2009.01208.x. PMID 19504658.
- ↑ Modler, RF; Inoguchi Y (2004). "CEH Marketing Research Report: Surfactants, Household Detergents, and their Raw Materials". Chemical Economics Handbook. Menlo Park, CA: SRI Consulting.
- ↑ Sanderson, H; Counts JL; Stanton K; Sedlak R (2006). "एक्सपोजर और प्राथमिकता - उपभोक्ता उत्पादों में उच्च उत्पादन मात्रा रसायनों के लिए मानव स्क्रीनिंग डेटा और तरीके: अमीन ऑक्साइड एक केस स्टडी।". Risk Analysis. 26 (6): 1637–1657. doi:10.1111/j.1539-6924.2006.00829.x. PMID 17184403.
- ↑ Smith, Michael B.; March, Jerry (2007), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th ed.), New York: Wiley-Interscience, p. 1779, ISBN 978-0-471-72091-1
- ↑ Albini, Angelo (1993). "अमीन 'एन'-ऑक्साइड की सिंथेटिक उपयोगिता". Synthesis. 1993 (3): 263–77. doi:10.1055/s-1993-25843.
- ↑ Waldmann, T.; et al. (2012). "Oxidation of an Organic Adlayer: A Bird's Eye View". Journal of the American Chemical Society. 134 (21): 8817–22. doi:10.1021/ja302593v. PMID 22571820.
- ↑ J. Meisenheimer, Ber. 52. 1667 (1919)
- ↑ Smith, Michael B.; March, Jerry (2001). March's Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (5th ed.). Wiley-Interscience. ISBN 0-471-58589-0.[page needed]
- ↑ Grierson, D (1990). "पोलोनोव्स्की प्रतिक्रिया". Org. React. 39: 85. doi:10.1002/0471264180.or039.02. ISBN 0471264180.
- ↑ M. Polonovski, M. Polonovski, Bull. Soc. Chim. France 41, 1190 (1927).
- ↑ Kürti, Laszlo; Czako, Barbara. कार्बनिक संश्लेषण में नामित प्रतिक्रियाओं के सामरिक अनुप्रयोग (paperback ed.). ISBN 0-12-429785-4.[page needed]