कॉपर (II) फ्लोराइड
 इकाई कोशिका का निर्जल रूप
| |
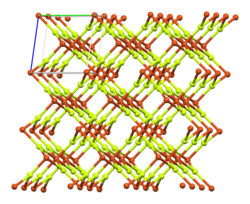 बॉल-एंड-स्टिक मॉडल का निर्जल रूप में क्रिस्टल पैकिंग
| |
 डाइहाइड्रेट
| |
| Names | |
|---|---|
| IUPAC name
कॉपर डाइफ्लोराइड
| |
| Other names
क्यूप्रिक फ्लोराइड; कॉपर फ्लोराइड; कॉपर (2+) डिफ्लुओराइड
| |
| Identifiers | |
| |
3D model (JSmol)
|
|
| ChemSpider | |
| EC Number |
|
PubChem CID
|
|
| UNII |
|
| |
| |
| Properties | |
| CuF2 | |
| Molar mass | 101.543 g/mol (anhydrous) 137.573 g/mol (dihydrate) |
| Appearance | White crystalline powder When hydrated: Blue |
| Density | 4.23 g/cm3 (anhydrous) 2.934 g/cm3 (dihydrate)[1] |
| Melting point | 836 °C (1,537 °F; 1,109 K) (anhydrous) 130 °C (dihydrate, decomposes) |
| Boiling point | 1,676 °C (3,049 °F; 1,949 K) (anhydrous) |
| +1050.0·10−6 cm3/mol | |
| Hazards | |
| NIOSH (US health exposure limits): | |
PEL (Permissible)
|
TWA 1 mg/m3 (as Cu)[2] |
REL (Recommended)
|
TWA 1 mg/m3 (as Cu)[2] |
IDLH (Immediate danger)
|
TWA 100 mg/m3 (as Cu)[2] |
| Related compounds | |
Other anions
|
Copper(II) bromide Copper(II) chloride |
Other cations
|
Silver(II) fluoride Cobalt(II) fluoride |
Related compounds
|
Copper(I) fluoride |
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
| |
कॉपर(तांबा) (II) फ्लोराइड एक अकार्बनिक यौगिक है जिसका रासायनिक सूत्र CuF2 है। निर्जल रूप एक सफेद, आयनिक, क्रिस्टलीय, आर्द्रताग्राही (हीड्रोस्कोपिक) ठोस है जिसमें विकृत रूटाइल-प्रकार की क्रिस्टल संरचना होती है, जो रासायनिक सूत्र MF2 (जहां एम एक धातु है) के अन्य फ्लोराइड के समान है। डाइहाइड्रेट, CuF2·2H2O, नीले रंग का होता है।[3]
संरचना
कॉपर (II) फ्लोराइड में एक मोनोक्लिनिक क्रिस्टल प्रणाली होती है[4] और उच्च-समरूपता संरचना प्राप्त नहीं कर सकता है। यह समांतर चतुर्भुज आधार के साथ आयताकार प्रिज्म बनाता है।[5] प्रत्येक कॉपर आयन में 1.93 Å पृथक्करण पर चार निकटतम फ्लोराइड आयन होते हैं और 2.27 Å पृथक्करण पर दो दूर होते हैं।[3]यह विकृत अष्टफलकीय [4+2] समन्वय d9 कॉपर(II) में जाह्न-टेलर प्रभाव का परिणाम है,[6] और क्रोमियम(II) फ्लोराइड, CrF2 के समान एक विकृत रूटाइल संरचना की ओर ले जाता है, जो एक d4 यौगिक है।[3]
| कॉपर का समन्वय | फ्लोरीन समन्वय |
|---|---|

|

|
उपयोग
कॉपर (II) फ्लोराइड का उपयोग 450 डिग्री सेल्सियस (842 डिग्री फारेनहाइट) से ऊपर के तापमान पर ऑक्सीजन युक्त वातावरण में ऐरोमैटिक हाइड्रोकार्बन के साथ प्रतिक्रिया करके फ्लोराइडयुक्त ऐरोमैटिक हाइड्रोकार्बन बनाने के लिए किया जा सकता है। यह प्रतिक्रिया सैन्डमायर अभिक्रिया की तुलना में सरल है, लेकिन केवल ऐसे यौगिक बनाने में प्रभावी है जो उपयोग किए गए तापमान पर जीवित रह सकते हैं। ऑक्सीजन और 2 एचएफ का उपयोग करके एक युग्मित प्रतिक्रिया कॉपर (II) फ्लोराइड को पुनर्जीवित करती है, जिससे पानी बनता है।[7] इस विधि को फ्लोरोएरोमैटिक्स के उत्पादन की एक हरित विधि के रूप में प्रस्तावित किया गया है क्योंकि यह अमोनियम फ्लोराइड जैसे जहरीले अपशिष्ट उत्पादों के उत्पादन से बचाती है।
रसायन शास्त्र
कॉपर (II) फ्लोराइड को कॉपर और एक अधातु तत्त्व से 400°C (752 °F) के तापमान पर संश्लेषित किया जा सकता है। यह सीधी प्रतिक्रिया के रूप में होता है।
- Cu + F2 → CuF2
यह 950°C (1742°F) से ऊपर के तापमान पर पिघले हुए चरण में फ्लोरीन खो देता है।
- 2CuF2 → 2CuF + F2
- 2CuF → CuF2 + Cu
यदि CuF2 फ्लोराइड आयन F- युक्त पदार्थों के संपर्क में आता है तो CuF3−, CuF42− और CuF64− के जटिल आयन बनते हैं।
घुलनशीलता
कॉपर (II) फ्लोराइड पानी में थोड़ा घुलनशील है, लेकिन गर्म पानी में विघटित होने लगता है, जिससे क्षारीय F− और Cu(OH) आयन उत्पन्न होता है।[citation needed]
विषाक्तता
कॉपर (II) फ्लोराइड की विषाक्तता के बारे में बहुत कम जानकारी है। चूंकि, सेवन करने पर तांबा और फ्लोराइड दोनों व्यक्तिगत रूप से विषाक्त हो सकते हैं।
कॉपर की विषाक्तता त्वचा, आंखों और श्वसन तंत्र को प्रभावित कर सकती है। गंभीर स्थितियों में धातु धूआं बुखार, और लाल रक्त कोशिकाओं का हेमोलिसिस सम्मलित हैं। तांबा लीवर और अन्य प्रमुख अंगों को भी नुकसान पहुंचा सकता है।
धातु फ्लोराइड सामान्यत: निम्न स्तर पर सुरक्षित होते हैं और कई देशों में दांतों की सड़न से बचाने के लिए जल फ्लोराइडेशन किया जाता है। उच्च स्तर पर वे मतली और उल्टी से लेकर कंपकंपी, सांस लेने में समस्या, गंभीर ऐंठन और यहां तक कि कोमा तक फ्लोराइड विषाक्तता का कारण बन सकते हैं। मस्तिष्क और गुर्दे को क्षति हो सकती है। लगातार संपर्क से हड्डियों के घनत्व में कमी, वजन में कमी और एनोरेक्सिया(अरोचक) हो सकता है।
खतरे
कॉपर (II) फ्लोराइड का उपयोग करने वाले प्रयोगों को धूआं हुड में आयोजित किया जाना चाहिए क्योंकि धातु ऑक्साइड धूआं हो सकता है। कॉपर (II) फ्लोराइड के साथ अम्ल के संयोजन से हाइड्रोजिन फ्लोराइड का उत्पादन हो सकता है, जो अत्यधिक विषैला और संक्षारक होता है।
संदर्भ
- ↑ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8
- ↑ 2.0 2.1 2.2 NIOSH Pocket Guide to Chemical Hazards. "#0150". National Institute for Occupational Safety and Health (NIOSH).
- ↑ 3.0 3.1 3.2 3.3 Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. pp. 1184–1185. ISBN 978-0-08-037941-8.
- ↑ 4.0 4.1 Fischer, P.; Hälg, W.; Schwarzenbach, D.; Gamsjäger, H. (1974). "कॉपर (II) फ्लोराइड की चुंबकीय और क्रिस्टल संरचना". J. Phys. Chem. Solids. 35 (12): 1683–1689. doi:10.1016/S0022-3697(74)80182-4.
- ↑ C. Billy; H. M. Haendler (1957). "कॉपर (II) फ्लोराइड की क्रिस्टल संरचना". Journal of the American Chemical Society. 79 (5): 1049–51. doi:10.1021/ja01562a011.
- ↑ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. pp. 1190–1191. ISBN 978-0-08-037941-8.
- ↑ M. A. Subramanian; L. E. Manzer (2002). "कॉपर (II) फ्लोराइड के माध्यम से फ्लोरोएरोमैटिक्स के लिए एक "हरित" सिंथेटिक मार्ग". Science. 297 (5587): 1665. doi:10.1126/science.1076397. PMID 12215637. S2CID 32697750.
- P. C. de Mello; M. Hehenberg; S. Larson; M. Zerner (1980). "Studies of the electronic structure of copper fluorides and copper chlorides". Journal of the American Chemical Society. 102 (4): 1278–1288. doi:10.1021/ja00524a010.
- H. M. Haendler; L. H. Towle; E. F. Bennett; W. L. Patterson (1954). "The Reaction of Fluorine with Copper and Some of its Compounds. Some Properties of Copper(II) Fluoride". Journal of the American Chemical Society. 76 (8): 2178–2179. doi:10.1021/ja01637a039.
- T. C. Ehlert; J. S. Wang (1977). "Thermochemistry of the copper fluorides". Journal of Physical Chemistry. 81 (22): 2069–2073. doi:10.1021/j100537a005.
- Dierks, S. "Copper Fluoride". http://www.espimetals.com/index.php/msds/537-copper-fluoride (accessed October 9).
- Subramanian, M. A.; Manzer, L. E. (2002). "A 'Greener' Synthetic Route for Fluoroaromantics via Copper (II) Fluoride". Science. 297 (5587): 1665. doi:10.1126/science.1076397. PMID 12215637. S2CID 32697750.
- Olejniczak, I.; Wolak, J.; Barszcz, B.; Schlueter, J.; Manson, J. (2010). "CuF2 Structural Changes in Two-Dimensional Quantum Magnet (H2O)2(pyz) Under Pressure: Raman Study". AIP Conference Proceedings. 1267 (1): 597–598. Bibcode:2010AIPC.1267..597O. doi:10.1063/1.3482697.
- Kent, R. A.; Mcdonald, J. D.; Margrave, J. L. (1966). "Mass Spectrometric Studies at High Temperatures. IX. The Sublimation Pressure of Copper(II) Fluoride". Journal of Physical Chemistry. 70 (3): 874–877. doi:10.1021/j100875a042.
- Shashkin, S. Y.; Goddard III, W. A. (1986). "Electron Correlation effects in ligand field parameters and other properties of copper II fluoride". Journal of Physical Chemistry. 90 (2): 250–255. doi:10.1021/j100274a010.
