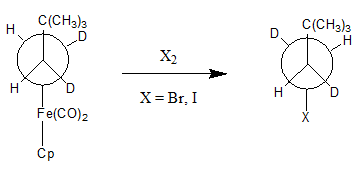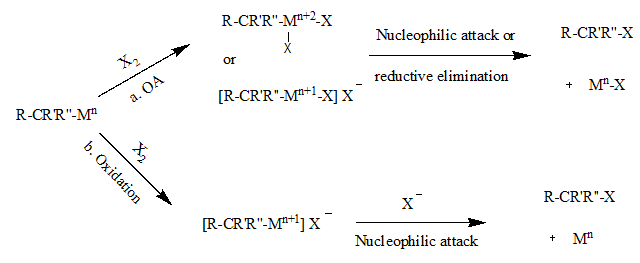न्यूक्लियोफिलिक अमूर्तन
न्यूक्लियोफिलिक अमूर्तन प्रकार की ऑर्गेनोमेटेलिक रसायन प्रतिक्रिया है, जिसे लिगैंड पर न्यूक्लियोफिलिक आक्षेप के रूप में परिभाषित किया जा सकता है, जिसके कारण न्यूक्लियोफाइल के साथ-साथ धातु से कुछ या सभी मूल लिगैंड को विस्थापित कर दिया जाता है।[1][2]
अल्काइल पृथक्करण
एल्काइल समूह का न्यूक्लियोफिलिक पृथक्करण अपेक्षाकृत असामान्य है, इस प्रकार की प्रतिक्रिया के उदाहरण हैं। इस प्रतिक्रिया के अनुकूल होने के लिए, धातु को रिडॉक्स होना चाहिए क्योंकि कम धातुएं प्रायः अनुपयुक्त त्याग करने वाले समूह होते हैं। धातु के ऑक्सीकरण के कारण M-C बंधन अशक्त हो जाता है, जो न्यूक्लियोफिलिक पृथक्करण की अनुमति प्रदान करता है। जी.एम. व्हाईटसाइड्स और डी.जे. बोशेटो हैलोजन Br2 और I2 का उपयोग करते हैं I न्यूक्लियोफिलिक एब्स्ट्रैक्शन के निम्नलिखित उदाहरण में M-C क्लीविंग एजेंट के रूप में उपयोग करते हैं।[3]
यह ध्यान रखना महत्वपूर्ण है कि इस प्रतिक्रिया का उत्पाद धातु से जुड़ी त्रिविम के संबंध में विपरीत है। इस प्रतिक्रिया के प्रतिक्रिया तंत्र के लिए अनेक संभावनाएँ हैं, जिन्हें निम्नलिखित योजनाबद्ध रूप में प्रदर्शित किया गया है।[1]
पथ a में, प्रथम चरण धातु परिसर में हलोजन के ऑक्सीडेटिव जोड़ के साथ आगे बढ़ता है। इस चरण के परिणामस्वरूप ऑक्सीकृत धातु केंद्र निर्मित करता है, जो M-C बंधन को अशक्त करने के लिए आवश्यक है। दूसरा चरण या तो अल्काइल समूह के α-कार्बन पर हैलाइड आयन के न्यूक्लियोफिलिक आक्षेप या रिडक्टिव उन्मूलन के साथ आगे बढ़ सकता है, जिसके परिणामस्वरूप स्टीरियोकैमिस्ट्री का विपरीत होता है। पथ b में, धातु को पूर्व में हैलाइड मिश्रित किये बिना ऑक्सीकरण किया जाता है। दूसरा चरण α-कार्बन के न्यूक्लियोफिलिक आक्षेप के साथ होता है, जिसके परिणामस्वरूप फिर से स्टीरियोकैमिस्ट्री का विपरीत होता है।
कार्बोनिल पृथक्करण
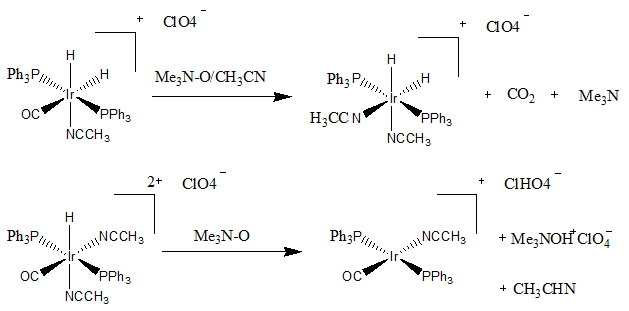
ट्राइमेथिलैमाइन एन-ऑक्साइड (Me3NO) का उपयोग कार्बोनिल के न्यूक्लियोफिलिक पृथक्करण में किया जा सकता है। कार्बोनिल समूह के कार्बन पर Me3NO जो धातु पर इलेक्ट्रॉनों को प्रोत्साहित करता है। इसके पश्चात् प्रतिक्रिया CO2 और NMe3 को बाहर निकालने के लिए आगे बढ़ती है I[4][5]
बुलेटिन ऑफ कोरियन केमिकल सोसाइटी जर्नल के लेख में परिणाम सामने आए जहां इरिडियम कॉम्प्लेक्स कार्बोनिल अमूर्तन से निकलता है, जबकि अधिक समान इरिडियम कॉम्प्लेक्स हाइड्राइड निष्कर्षण से निकलता है।[6]
हाइड्रोजन पृथक्करण
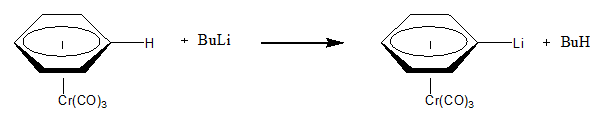
यदि परिस्थितियाँ त्रुटिहीन हों तो किसी धातु के लिगैंड पर न्यूक्लियोफिलिक पृथक्करण हो सकता है। उदाहरण के लिए निम्नलिखित उदाहरण क्रोमियम से जुड़े एरेने लिगैंड से H+ के न्यूक्लियोफिलिक पृथक्करण को प्रदर्शित करता है। क्रोमियम की इलेक्ट्रॉन निकालने की प्रकृति प्रतिक्रिया को आसान प्रतिक्रिया के रूप में घटित होने की अनुमति प्रदान करती है I[1] facile
मिथाइल पृथक्करण
फिशर कार्बाइन न्यूक्लियोफिलिक पृथक्करण से निकल सकता है, जहां मिथाइल समूह विस्थापित कर दिया जाता है। छोटे अमूर्त एजेंट को जोड़ने के साथ, अमूर्त एजेंट सामान्यतः कार्बाइन कार्बन में जोड़ देगा। चूँकि, इस विषय में, जोड़े गए पृथक्करण एजेंट के स्टेरिक प्रभाव मिथाइल समूह के पृथक्करण का कारण बनते हैं। यदि मिथाइल समूह को एथिल से परिवर्तित कर दिया जाता है, तो प्रतिक्रिया 70 गुना मंद हो जाती है, जो कि SN2 विस्थापन तंत्र के साथ अपेक्षित है I [7]
सिलिलियम पृथक्करण
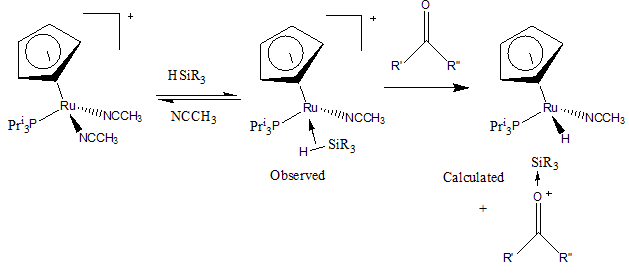
सिलिलियम आयन सिलिकॉन धनायन है, जिसमें केवल तीन बंधन और सकारात्मक आवेश होता है। सिलिलियम आयन का पृथक्करण नीचे दिखाए गए रूथेनियम कॉम्प्लेक्स से देखा जाता है।[8]
इस तंत्र के पूर्व चरण में एसीटोनिट्राइल समूहों में से किसी समूह को सिलिकॉन अणु द्वारा प्रतिस्थापित किया जाता है, जहां सिलिकॉन और हाइड्रोजन के मध्य का बंधन रूथेनियम के साथ समन्वयित होता है। दूसरे चरण में सिलिलियम आयन के न्यूक्लियोफिलिक पृथक्करण के लिए कीटोन जोड़ा जाता है और हाइड्रोजन को धातु पर विस्थापित कर दिया जाता है।
α-एसाइल एब्स्ट्रैक्शन
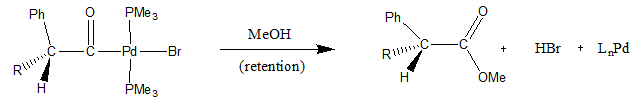
α-एसाइल समूह के न्यूक्लियोफिलिक पृथक्करण का उदाहरण तब देखा जाता है जब MeOH को निम्नलिखित पैलेडियम कॉम्प्लेक्स में जोड़ा जाता है। तंत्र चतुष्फलकीय इंटरमीडिएट का अनुसरण करता है जिसके परिणामस्वरूप मिथाइल एस्टर और कम पैलेडियम कॉम्प्लेक्स प्रदर्शित किया जाता है।[9]
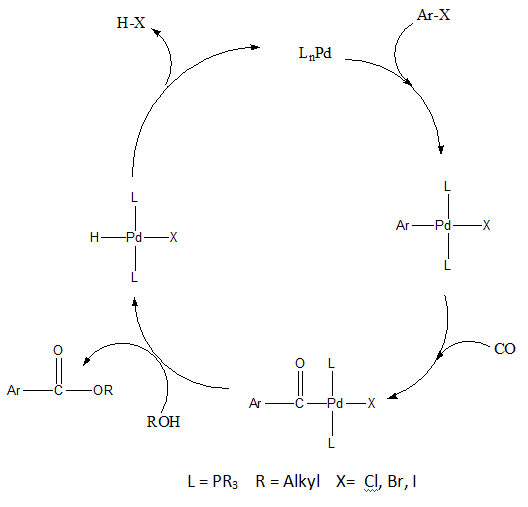
 अगले वर्ष समान तंत्र प्रस्तावित किया गया था जहां एरिल हैलाइड के ऑक्सीडेटिव जोड़ के पश्चात् प्रवासी प्रविष्टि होता है, और इसके पश्चात् MeOH द्वारा α-एसाइल का न्यूक्लियोफिलिक पृथक्करण होता है। इस अंतरआणविक न्यूक्लियोफिलिक पृथक्करण के लाभों में से रैखिक एसाइल डेरिवेटिव का उत्पादन है। इन रैखिक एसाइल डेरिवेटिव का इंट्रामोल्युलर आक्षेप लैक्टोन या लेक्टम जैसे चक्रीय यौगिकों को उत्पन्न करता है।[10]
अगले वर्ष समान तंत्र प्रस्तावित किया गया था जहां एरिल हैलाइड के ऑक्सीडेटिव जोड़ के पश्चात् प्रवासी प्रविष्टि होता है, और इसके पश्चात् MeOH द्वारा α-एसाइल का न्यूक्लियोफिलिक पृथक्करण होता है। इस अंतरआणविक न्यूक्लियोफिलिक पृथक्करण के लाभों में से रैखिक एसाइल डेरिवेटिव का उत्पादन है। इन रैखिक एसाइल डेरिवेटिव का इंट्रामोल्युलर आक्षेप लैक्टोन या लेक्टम जैसे चक्रीय यौगिकों को उत्पन्न करता है।[10]
यह भी देखें
- पाइ लिगैंड्स के अतिरिक्त
संदर्भ
- ↑ Jump up to: 1.0 1.1 1.2 Spessard, Gary; Miessler, Gary (2010).Organometallic Chemistry: Second Edition. pp. 285-289 ISBN 978-0-19-533099-1
- ↑ Xu, Ruren; Pang, Wenqin; Huo, Qisheng (2011).Modern Inorganic Synthetic Chemistry. pp. 275-278 ISBN 978-0-444-53599-3
- ↑ G.M. Whitesides and D. J. Boschetto, J. Am. Chem. Soc., 1971, 93, 1529.
- ↑ K. Yang, S. G. Bott, and M. G. Richmond, Organometallics, 1994, 13, 3788.
- ↑ M. O. Albers and N. Coville, J. Coord. Chem. Rev., 1984, 53, 227.
- ↑ C. S. Chin, M. Oh, G. Won, H. Cho, and D. Shin, Bull. Korean Chem Soc., 1999, 20, 85.
- ↑ L. M. Toomey and J. D. Atwood, Organometallics, 1997, 16, 490.
- ↑ D. V. Gutsulyak, S. F. Vyboishchikov, and G. I. Nikonov, J. Am. Chem. Soc., 2010, 132, 5950.
- ↑ J. K. Stille and K. S. Y. Lau, Acc. Chem. Res., 1977, 10, 434.
- ↑ R. F. Heck, Pure Appl. Chem., 1978, 50, 691.