धात्विक बंधन (मैटेलिक बॉन्ड): Difference between revisions
No edit summary |
No edit summary |
||
| Line 4: | Line 4: | ||
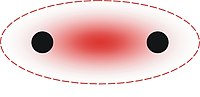
[[File:Metallic Bonding Example.svg|thumb|धात्विक बंधन दिखाने वाला एक उदाहरण। + धनायनों का प्रतिनिधित्व करता है, - मुक्त तैरते इलेक्ट्रॉनों का प्रतिनिधित्व करता है।]] | [[File:Metallic Bonding Example.svg|thumb|धात्विक बंधन दिखाने वाला एक उदाहरण। + धनायनों का प्रतिनिधित्व करता है, - मुक्त तैरते इलेक्ट्रॉनों का प्रतिनिधित्व करता है।]] | ||
{{Atomic radius}} | {{Atomic radius}} | ||
धात्विक बंधन एक प्रकार का [[रासायनिक बंध]]न है जो [[चालन इलेक्ट्रॉन|चालन]] इलेक्ट्रॉनोंं ([[डेलोकलाइज्ड इलेक्ट्रॉन|डेलोकलाइज्ड]] इलेक्ट्रॉनों के इलेक्ट्रॉन बादल के रूप में) और सकारात्मक रूप से आवेशित [[धातु]] आयनों के बीच इलेक्ट्रोस्टैटिक आकर्षक बल से उत्पन्न होता है। | धात्विक बंधन एक प्रकार का [[रासायनिक बंध]]न है जो [[चालन इलेक्ट्रॉन|चालन]] इलेक्ट्रॉनोंं ([[डेलोकलाइज्ड इलेक्ट्रॉन|डेलोकलाइज्ड]] इलेक्ट्रॉनों के इलेक्ट्रॉन बादल के रूप में) और सकारात्मक रूप से आवेशित [[धातु]] आयनों के बीच इलेक्ट्रोस्टैटिक आकर्षक बल से उत्पन्न होता है। इसे धनावेशित आयनों (धनायनों) की संरचना के बीच ''मुक्त'' इलेक्ट्रॉनों की साझेदारी के रूप में वर्णित किया जा सकता है। धातुओं की कई [[भौतिक संपत्ति|भौतिक]] गुणों जैसे धातु की ताकत, [[लचीलापन]], तापीय और [[विद्युत प्रतिरोधकता और चालकता]], अपारदर्शिता (प्रकाशिकी), और [[चमक (खनिज विज्ञान)]] के लिए धात्विक संबंध हैं।<ref>[http://www.chemguide.co.uk/atoms/bonding/metallic.html Metallic bonding]. chemguide.co.uk</ref><ref>[http://www.chemguide.co.uk/atoms/structures/metals.html Metal structures]. chemguide.co.uk</ref><ref>[http://hyperphysics.phy-astr.gsu.edu/hbase/chemical/bond.html Chemical Bonds]. chemguide.co.uk</ref><ref>[https://web.archive.org/web/19991018204506/http://www.physics.ohio-state.edu/%7Eaubrecht/physics133.html "Physics 133 Lecture Notes" Spring, 2004. Marion Campus]. physics.ohio-state.edu</ref> | ||
धात्विक बंधन एकमात्र प्रकार का रासायनिक बंधन नहीं है जो एक धातु एक शुद्ध पदार्थ के रूप में भी प्रदर्शित कर सकता है। उदाहरण के लिए, तात्विक [[गैलियम]] में [[सहसंयोजक बंधन|सहसंयोजक]] जोड़े होते हैं - ये जोड़े उनके बीच धातु बंधन के साथ एक क्रिस्टल संरचना बनाते हैं। धातु-धातु सहसंयोजक बंधन का एक अन्य उदाहरण उदाहरण पारा आयन है ({{chem|Hg|2|2+}}). | |||
== इतिहास == | == इतिहास == | ||
क्वांटम यांत्रिकी के आगमन के साथ, इस तस्वीर को [[मुक्त इलेक्ट्रॉन मॉडल]] और इसके आगे के विस्तार, [[लगभग मुक्त इलेक्ट्रॉन मॉडल]] के रूप में अधिक औपचारिक व्याख्या दी गई। दोनों मॉडलों में, इलेक्ट्रॉनों को ठोस की संरचना के माध्यम से यात्रा करने वाली गैस के रूप में देखा जाता है जो अनिवार्य रूप से आइसोट्रोपिक है, जिसमें यह [[परिमाण (वेक्टर)]] के वर्ग पर निर्भर करता है, न कि संवेग वेक्टर [[लहर वेक्टर|k]] की दिशा पर। त्रि-आयामी के-स्पेस में, उच्चतम भरे हुए स्तरों ([[फर्मी सतह]]) के बिंदुओं का सेट एक गोला होना चाहिए। लगभग-मुक्त मॉडल में, (आयनिक) संरचना से अनुभवी आवधिक क्षमता द्वारा बॉक्स-जैसे [[ब्रिलौइन क्षेत्र]] को के-स्पेस में जोड़ा जाता है, इस प्रकार आइसोट्रॉपी को हल्के से तोड़ता है। | क्वांटम यांत्रिकी के आगमन के साथ, इस तस्वीर को [[मुक्त इलेक्ट्रॉन मॉडल]] और इसके आगे के विस्तार, [[लगभग मुक्त इलेक्ट्रॉन मॉडल]] के रूप में अधिक औपचारिक व्याख्या दी गई। दोनों मॉडलों में, इलेक्ट्रॉनों को ठोस की संरचना के माध्यम से यात्रा करने वाली गैस के रूप में देखा जाता है जो अनिवार्य रूप से आइसोट्रोपिक है, जिसमें यह [[परिमाण (वेक्टर)]] के वर्ग पर निर्भर करता है, न कि संवेग वेक्टर [[लहर वेक्टर|k]] की दिशा पर। त्रि-आयामी के-स्पेस में, उच्चतम भरे हुए स्तरों ([[फर्मी सतह]]) के बिंदुओं का सेट एक गोला होना चाहिए। लगभग-मुक्त मॉडल में, (आयनिक) संरचना से अनुभवी आवधिक क्षमता द्वारा बॉक्स-जैसे [[ब्रिलौइन क्षेत्र]] को के-स्पेस में जोड़ा जाता है, इस प्रकार आइसोट्रॉपी को हल्के से तोड़ता है। | ||
Revision as of 00:57, 5 April 2023
| Types of radii |
|---|
धात्विक बंधन एक प्रकार का रासायनिक बंधन है जो चालन इलेक्ट्रॉनोंं (डेलोकलाइज्ड इलेक्ट्रॉनों के इलेक्ट्रॉन बादल के रूप में) और सकारात्मक रूप से आवेशित धातु आयनों के बीच इलेक्ट्रोस्टैटिक आकर्षक बल से उत्पन्न होता है। इसे धनावेशित आयनों (धनायनों) की संरचना के बीच मुक्त इलेक्ट्रॉनों की साझेदारी के रूप में वर्णित किया जा सकता है। धातुओं की कई भौतिक गुणों जैसे धातु की ताकत, लचीलापन, तापीय और विद्युत प्रतिरोधकता और चालकता, अपारदर्शिता (प्रकाशिकी), और चमक (खनिज विज्ञान) के लिए धात्विक संबंध हैं।[1][2][3][4]
धात्विक बंधन एकमात्र प्रकार का रासायनिक बंधन नहीं है जो एक धातु एक शुद्ध पदार्थ के रूप में भी प्रदर्शित कर सकता है। उदाहरण के लिए, तात्विक गैलियम में सहसंयोजक जोड़े होते हैं - ये जोड़े उनके बीच धातु बंधन के साथ एक क्रिस्टल संरचना बनाते हैं। धातु-धातु सहसंयोजक बंधन का एक अन्य उदाहरण उदाहरण पारा आयन है (Hg2+
2).
इतिहास
क्वांटम यांत्रिकी के आगमन के साथ, इस तस्वीर को मुक्त इलेक्ट्रॉन मॉडल और इसके आगे के विस्तार, लगभग मुक्त इलेक्ट्रॉन मॉडल के रूप में अधिक औपचारिक व्याख्या दी गई। दोनों मॉडलों में, इलेक्ट्रॉनों को ठोस की संरचना के माध्यम से यात्रा करने वाली गैस के रूप में देखा जाता है जो अनिवार्य रूप से आइसोट्रोपिक है, जिसमें यह परिमाण (वेक्टर) के वर्ग पर निर्भर करता है, न कि संवेग वेक्टर k की दिशा पर। त्रि-आयामी के-स्पेस में, उच्चतम भरे हुए स्तरों (फर्मी सतह) के बिंदुओं का सेट एक गोला होना चाहिए। लगभग-मुक्त मॉडल में, (आयनिक) संरचना से अनुभवी आवधिक क्षमता द्वारा बॉक्स-जैसे ब्रिलौइन क्षेत्र को के-स्पेस में जोड़ा जाता है, इस प्रकार आइसोट्रॉपी को हल्के से तोड़ता है।
एक्स-रे विवर्तन और थर्मल विश्लेषण के आगमन ने धातुओं और उनके मिश्र धातुओं सहित क्रिस्टलीय ठोस पदार्थों की संरचना का अध्ययन करना संभव बना दिया; और चरण आरेख विकसित किए गए थे। इस सारी प्रगति के बावजूद, इंटरमेटेलिक यौगिकों और मिश्र धातुओं की प्रकृति काफी हद तक एक रहस्य बनी रही और उनका अध्ययन अक्सर अनुभवजन्य था। केमिस्ट आमतौर पर ऐसी किसी भी चीज़ से दूर चले जाते हैं जो डाल्टन के कई अनुपातों के नियम का पालन नहीं करती थी; और समस्या को एक अलग विज्ञान, धातु विज्ञान का क्षेत्र माना गया।
इस क्षेत्र के कुछ शोधकर्ताओं, विशेष रूप से ह्यूम-रोथेरी द्वारा लगभग-मुक्त इलेक्ट्रॉन मॉडल को उत्सुकता से लिया गया था, यह समझाने के प्रयास में कि कुछ रचनाओं के साथ कुछ इंटरमेटेलिक मिश्र धातुएं क्यों बनेंगी और अन्य नहीं बनेंगी। शुरू में ह्यूम-रोथेरी के प्रयास काफी सफल रहे। उनका विचार ब्रिलौइन-बक्से की श्रृंखला के अंदर गोलाकार फर्मी-गुब्बारे को फुलाए जाने के लिए इलेक्ट्रॉनों को जोड़ना था और यह निर्धारित करना था कि एक निश्चित बॉक्स कब भरा होगा। इसने काफी बड़ी संख्या में मिश्र धातु रचनाओं की भविष्यवाणी की जो बाद में देखी गई। जैसे ही साइक्लोट्रॉन अनुनाद उपलब्ध हुआ और गुब्बारे का आकार निर्धारित किया जा सका, यह पाया गया कि यह धारणा सही नहीं थी कि गुब्बारा गोलाकार था, सिवाए शायद सीज़ियम के मामले में। इस खोज ने कई निष्कर्षों को उदाहरणों में बदल दिया कि कैसे एक मॉडल कभी-कभी सही भविष्यवाणियों की एक पूरी श्रृंखला दे सकता है, फिर भी गलत हो सकता है।
लगभग मुक्त इलेक्ट्रॉन पराजय ने शोधकर्ताओं को दिखाया कि कोई भी मॉडल जो मानता है कि आयन मुक्त इलेक्ट्रॉनों के समुद्र में थे, उन्हें संशोधन की आवश्यकता थी। इसलिए, कई क्वांटम मैकेनिकल मॉडल - जैसे कि आणविक कक्षा या घनत्व कार्यात्मक सिद्धांत पर आधारित बैंड संरचना गणना - विकसित किए गए थे। इन मॉडलों में, एक या तो तटस्थ परमाणुओं के परमाणु कक्षाओं से निकलता है जो अपने इलेक्ट्रॉनों को साझा करते हैं या (घनत्व कार्यात्मक सिद्धांत के मामले में) कुल इलेक्ट्रॉन घनत्व से निकलते हैं। मुक्त-इलेक्ट्रॉन चित्र, फिर भी, शिक्षा में प्रमुख रहा है।
इलेक्ट्रॉनिक बैंड संरचना मॉडल न केवल धातुओं के अध्ययन के लिए बल्कि अर्धचालकों के अध्ययन के लिए और भी अधिक महत्वपूर्ण हो गया। इलेक्ट्रॉनिक राज्यों के साथ, कंपन राज्यों को भी बैंड बनाने के लिए दिखाया गया था। रुडोल्फ पीयरल्स ने दिखाया कि, धातु परमाणुओं की एक-आयामी पंक्ति के मामले में - कहते हैं, हाइड्रोजन - एक अस्थिरता उत्पन्न होती है जो व्यक्तिगत अणुओं में ऐसी श्रृंखला के टूटने की ओर ले जाती है। इसने सामान्य प्रश्न में रुचि जगाई: सामूहिक धात्विक बंधन कब स्थिर होता है और बंधन का अधिक स्थानीय रूप कब अपना स्थान लेगा? धातु परमाणुओं के क्लस्टरिंग के अध्ययन में काफी शोध किया गया।
धातु बंधन का वर्णन करने में बैंड संरचना मॉडल की अवधारणा जितनी शक्तिशाली साबित हुई, इसमें कई-शरीर की समस्या के एक-इलेक्ट्रॉन सन्निकटन शेष रहने का दोष है। दूसरे शब्दों में, प्रत्येक इलेक्ट्रॉन की ऊर्जा अवस्थाओं का वर्णन इस प्रकार किया जाता है जैसे कि अन्य सभी इलेक्ट्रॉन केवल एक सजातीय पृष्ठभूमि बनाते हैं। मॉट और हबर्ड जैसे शोधकर्ताओं ने महसूस किया कि यह शायद दृढ़ता से डेलोकलाइज्ड s - और p -इलेक्ट्रॉनों के लिए उपयुक्त था ; लेकिन d -इलेक्ट्रॉनों के लिए, और f -इलेक्ट्रॉनों के लिए और भी अधिक , स्थानीय वातावरण में इलेक्ट्रॉनों (और परमाणु विस्थापन) के साथ बातचीत व्यापक बैंड की ओर ले जाने वाले डेलोकलाइजेशन से अधिक मजबूत हो सकती है। इस प्रकार, स्थानीय अयुग्मित इलेक्ट्रॉनों से संक्रमणयात्रा करने वालों के लिए धातु बंधन में भाग लेना अधिक बोधगम्य हो गया।
धात्विक बंधन की प्रकृति
दो परिघटनाओं का संयोजन धात्विक बंधन को जन्म देता है: इलेक्ट्रॉनों का निरूपण और निरूपित इलेक्ट्रॉनों की तुलना में कहीं अधिक बड़ी संख्या में विस्थानीकृत ऊर्जा अवस्थाओं की उपलब्धता।[clarification needed] बाद वाले को इलेक्ट्रॉन की कमी कहा जा सकता है।
2डी में
ग्राफीन द्वि-आयामी धात्विक बंधन का एक उदाहरण है। इसके धात्विक बंधन बेंजीन, नेफ़थलीन, अंगारिन, ओवलीन आदि में सुगंधितता के समान हैं।
3डी में
धातु समूहों में धातु की सुगन्धितता निरूपण का एक और उदाहरण है, इस बार अक्सर त्रि-आयामी व्यवस्था में। धातुएं डेलोकलाइज़ेशन सिद्धांत को अपने चरम पर ले जाती हैं, और कोई कह सकता है कि धातु का एक क्रिस्टल एक एकल अणु का प्रतिनिधित्व करता है, जिसके ऊपर सभी चालन इलेक्ट्रॉनों को तीनों आयामों में विभाजित किया जाता है। इसका मतलब यह है कि धातु के अंदर आमतौर पर अणुओं को अलग नहीं किया जा सकता है, इसलिए धातु बंधन न तो इंट्रा- और न ही इंटर-आणविक है। 'नॉनमोलेक्युलर' शायद एक बेहतर शब्द होगा। धात्विक बंधन ज्यादातर गैर-ध्रुवीय होते हैं, क्योंकि मिश्र धातुओं में भी बॉन्डिंग इंटरेक्शन में भाग लेने वाले परमाणुओं की वैद्युतीयऋणात्मकता में बहुत कम अंतर होता है (और, शुद्ध तात्विक धातुओं में, बिल्कुल भी नहीं)। इस प्रकार, धात्विक बंधन सहसंयोजक बंधन का एक अत्यंत मुखर सांप्रदायिक रूप है। एक मायने में, धात्विक बंधन कोई 'नई' प्रकार की बॉन्डिंग नहीं है। यह बंधन का वर्णन केवल संघनित पदार्थ के एक टुकड़े में मौजूद है: यह क्रिस्टलीय ठोस, तरल या कांच भी हो। इसके विपरीत, धात्विक वाष्प अक्सर परमाणु (Hg) होते हैं या कभी-कभी अणु होते हैं, जैसे Na2, जो एक अधिक पारंपरिक सहसंयोजक बंधन द्वारा एक साथ बंधे होते हैं। इसलिए एकल 'धात्विक बंधन' कहना सही नहीं है।[clarification needed]
डेलोकलाइज़ेशन s- और p-इलेक्ट्रॉनों के लिए सबसे अधिक स्पष्ट है। सीज़ियम में डेलोकलाइज़ेशन इतना मजबूत है कि इलेक्ट्रॉनों को लगभग सीज़ियम परमाणुओं से मुक्त कर दिया जाता है ताकि केवल धातु की सतह से विवश गैस बन सके। सीज़ियम के लिए, इसलिए, नकारात्मक रूप से आवेशित इलेक्ट्रॉन गैस द्वारा एक साथ रखे गए Cs+ आयनों की तस्वीर गलत नहीं है।[lower-alpha 1] अन्य तत्वों के लिए इलेक्ट्रॉन कम मुक्त होते हैं, जिसमें वे अभी भी धातु के परमाणुओं की क्षमता का अनुभव करते हैं, कभी-कभी काफी दृढ़ता से। उन्हें अधिक जटिल क्वांटम यांत्रिक उपचार (जैसे, तंग बंधन) की आवश्यकता होती है जिसमें परमाणुओं को बेंजीन में कार्बन परमाणुओं की तरह तटस्थ रूप में देखा जाता है। D और विशेष रूप से f-इलेक्ट्रॉनों के लिए डेलोकलाइज़ेशन बिल्कुल भी मजबूत नहीं है और यह बताता है कि क्यों ये इलेक्ट्रॉन अयुग्मित इलेक्ट्रॉनों के रूप में व्यवहार करना जारी रखने में सक्षम हैं जो अपने स्पिन को बनाए रखते हैं, इन धातुओं में दिलचस्प चुंबकत्व जोड़ते हैं।
इलेक्ट्रॉन की कमी और गतिशीलता
धातु के परमाणुओं में उनके पीरियड्स या ऊर्जा स्तरों के सापेक्ष उनके वैलेंस शेल में कुछ इलेक्ट्रॉन होते हैं । वे इलेक्ट्रॉन की कमी हैंतत्वों और सांप्रदायिक बंटवारे से उसमें बदलाव नहीं होता है। साझा इलेक्ट्रॉनों की तुलना में कहीं अधिक उपलब्ध ऊर्जा अवस्थाएँ हैं। इसलिए चालकता के लिए दोनों आवश्यकताएं पूरी होती हैं: मजबूत निरूपण और आंशिक रूप से भरे ऊर्जा बैंड। इसलिए ऐसे इलेक्ट्रॉन आसानी से एक ऊर्जा अवस्था से थोड़ी अलग अवस्था में बदल सकते हैं। इस प्रकार, न केवल वे संरचना में प्रवेश करने वाले इलेक्ट्रॉनों के समुद्र का निर्माण करते हुए मुखर हो जाते हैं, बल्कि वे बाहरी विद्युत क्षेत्र को लागू करने पर संरचना के माध्यम से माइग्रेट करने में भी सक्षम होते हैं, जिससे विद्युत चालकता होती है। क्षेत्र के बिना, सभी दिशाओं में समान रूप से चलने वाले इलेक्ट्रॉन होते हैं। इस तरह के एक क्षेत्र के भीतर, कुछ इलेक्ट्रॉन एक अलग तरंग वेक्टर को अपनाते हुए अपनी स्थिति को थोड़ा समायोजित करेंगे. नतीजतन, वहाँ एक तरह से दूसरे की तुलना में अधिक गति होगी और एक शुद्ध धारा का परिणाम होगा।
माइग्रेट करने के लिए इलेक्ट्रॉनों की स्वतंत्रता भी धातु के परमाणुओं, या उनकी परतों को एक-दूसरे को स्लाइड करने की क्षमता देती है। स्थानीय रूप से, बंधनों को आसानी से तोड़ा जा सकता है और विरूपण के बाद नए लोगों द्वारा प्रतिस्थापित किया जा सकता है। यह प्रक्रिया साम्प्रदायिक धात्विक बंधन को बहुत अधिक प्रभावित नहीं करती है, जो धातुओं की विशिष्ट आघातवर्धनीयता और तन्यता को जन्म देती है। यह शुद्ध तत्वों के लिए विशेष रूप से सच है। घुली हुई अशुद्धियों की उपस्थिति में, सामान्य रूप से आसानी से बनने वाले विदलन अवरुद्ध हो सकते हैं और सामग्री सख्त हो जाती है। उदाहरण के लिए, सोना शुद्ध रूप (24-कैरेट (शुद्धता)) में बहुत नरम होता है, यही वजह है कि गहनों में मिश्र धातुओं को प्राथमिकता दी जाती है।
धातु आमतौर पर गर्मी के अच्छे संवाहक भी होते हैं, लेकिन चालन इलेक्ट्रॉन इस घटना में केवल आंशिक रूप से योगदान करते हैं। परमाणुओं के सामूहिक (अर्थात्, डेलोकलाइज़्ड) कंपन, जिन्हें ध्वनि के रूप में जाना जाता है, जो एक तरंग के रूप में ठोस के माध्यम से यात्रा करते हैं, बड़े योगदानकर्ता होते हैं।
हालांकि, हीरा जैसे पदार्थ, जो काफी अच्छी तरह से गर्मी का संचालन करता है, एक विद्युत कंडक्टर नहीं है। यह हीरे में डेलोकलाइजेशन के अनुपस्थित होने का परिणाम नहीं है, बल्कि यह है कि कार्बन में इलेक्ट्रॉन की कमी नहीं है।
धातु को अधिक पारंपरिक सहसंयोजक बंधन से अलग करने में इलेक्ट्रॉन की कमी महत्वपूर्ण है। इस प्रकार, हमें ऊपर दी गई अभिव्यक्ति में संशोधन करना चाहिए: धात्विक बंधन इलेक्ट्रॉन की कमी का एक अत्यंत जटिल सांप्रदायिक रूप है[lower-alpha 2] सहसंयोजक संबंध।
धात्विक त्रिज्या
धात्विक त्रिज्या को धात्विक संरचना में दो आसन्न धातु आयनों के बीच की दूरी के आधे के रूप में परिभाषित किया गया है। यह त्रिज्या परमाणु की प्रकृति के साथ-साथ उसके पर्यावरण पर निर्भर करती है - विशेष रूप से, समन्वय संख्या (CN) पर, जो बदले में तापमान और लगाए गए दबाव पर निर्भर करती है।
परमाणुओं के आकार में आवधिक प्रवृत्तियों की तुलना करते समय अक्सर तथाकथित गोल्डस्मिथ सुधार को लागू करने के लिए वांछनीय होता है, जो परमाणु त्रिज्या को मूल्यों में परिवर्तित करता है यदि परमाणु 12-समन्वित होते हैं। चूँकि धात्विक त्रिज्या उच्चतम समन्वय संख्या के लिए सबसे बड़ी है, कम सघन समन्वय के लिए सुधार में x से गुणा करना शामिल है, जहाँ 0 <x <1. विशेष रूप से, CN = 4, x = 0.88 के लिए; CN = 6, x = 0.96, और CN = 8, x = 0.97 के लिए। सुधार का नाम विक्टर गोल्डश्मिड्ट के नाम पर रखा गया है जिन्होंने ऊपर उद्धृत संख्यात्मक मान प्राप्त किए।[6]
त्रिज्या सामान्य आवधिक प्रवृत्तियों का पालन करती है: वे प्रभावी परमाणु प्रभार में वृद्धि के कारण पूरी अवधि में घट जाती हैं, जो अणु की संयोजन क्षमता की बढ़ी हुई संख्या से ऑफसेट नहीं होती है; लेकिन मूल क्वांटम संख्या में वृद्धि के कारण त्रिज्या समूह में नीचे की ओर बढ़ती है। 4d और 5d तत्वों के बीच, लैन्थेनाइड संकुचन देखा जाता है - खराब इलेक्ट्रॉन परिरक्षण वाले एफ ऑर्बिटल्स की उपस्थिति के कारण समूह के नीचे त्रिज्या में बहुत कम वृद्धि होती है।
बंधन की ताकत
This section does not cite any sources. (September 2014) (Learn how and when to remove this template message) |
धातुओं में परमाणुओं के बीच एक मजबूत आकर्षण बल होता है। इसे दूर करने के लिए बहुत अधिक ऊर्जा की आवश्यकता होती है। इसलिए, धातुओं में अक्सर उच्च क्वथनांक होते हैं, जिनमें टंगस्टन (5828 K) अत्यधिक उच्च होता है। एक उल्लेखनीय अपवाद समूह 12 तत्व के तत्व हैं: Zn, Cd और Hg। उनका इलेक्ट्रॉन विन्यास ... ns2 में समाप्त होता है, जो आवर्त सारणी में नीचे जाने पर हीलियम की तरह एक महान गैस विन्यास जैसा दिखता है, क्योंकि खाली np ऑर्बिटल्स के लिए ऊर्जा का अंतर बड़ा हो जाता है। इसलिए ये धातुएं अपेक्षाकृत अस्थिर हैं, और अति उच्च वैक्यूम सिस्टम में इससे बचा जाता है।
अन्यथा, गैलियम जैसी पिघली हुई धातुओं में भी धातु बंधन बहुत मजबूत हो सकता है। भले ही गैलियम कमरे के तापमान से ठीक ऊपर हाथ की गर्मी से पिघल जाएगा, लेकिन इसका क्वथनांक तांबे के क्वथनांक से ज्यादा दूर नहीं है। पिघला हुआ गैलियम, इसलिए, एक बहुत ही गैर-वाष्पशील तरल है, इसकी मजबूत धातु बंधन के लिए धन्यवाद।
तरल रूप में धातुओं का मजबूत बंधन दर्शाता है कि धातु बंधन की ऊर्जा बंधन की दिशा पर अत्यधिक निर्भर नहीं होती है; बॉन्ड डायरेक्शनलिटी की कमी इलेक्ट्रॉन डेलोकलाइज़ेशन का प्रत्यक्ष परिणाम है, और सहसंयोजक बॉन्ड के दिशात्मक बॉन्डिंग के विपरीत सबसे अच्छी तरह से समझा जाता है। एक धात्विक बंधन की ऊर्जा इस प्रकार ज्यादातर इलेक्ट्रॉनों की संख्या का एक कार्य है जो धात्विक परमाणु को घेरे हुए है, जैसा कि एम्बेडेड परमाणु मॉडल द्वारा उदाहरण दिया गया है।[7] यह आमतौर पर धातुओं में अपेक्षाकृत सरल, परमाणु पैकिंग कारक | क्लोज-पैक क्रिस्टल संरचनाओं, जैसे कि एफसीसी, बीसीसी और एचसीपी के रूप में होता है।
उच्च पर्याप्त शीतलन दर और उपयुक्त मिश्र धातु संरचना को देखते हुए, धातु के कांच में भी धातु का संबंध हो सकता है, जिसमें अनाकार संरचना होती है।
धातु आयनों और बायोमोलेक्यूल्स की कमजोर अंतःक्रिया द्वारा बहुत अधिक जैव रसायन की मध्यस्थता की जाती है। इस तरह की बातचीत, और उनके संबंधित परिवर्तन, दोहरे ध्रुवीकरण इंटरफेरोमेट्री का उपयोग करके मापा गया है।
घुलनशीलता और यौगिक गठन
धातु पानी या कार्बनिक सॉल्वैंट्स में अघुलनशील होते हैं, जब तक कि वे उनके साथ प्रतिक्रिया न करें। आमतौर पर, यह एक ऑक्सीकरण प्रतिक्रिया है जो धातु के बंधन को नष्ट करते हुए, उनके पुनरावर्तक इलेक्ट्रॉनों के धातु परमाणुओं को लूटती है। हालाँकि धातुएँ अक्सर एक दूसरे में आसानी से घुलनशील होती हैं जबकि उनके बंधन के धात्विक चरित्र को बनाए रखते हैं। उदाहरण के लिए, सोना कमरे के तापमान पर भी पारे में आसानी से घुल जाता है। ठोस धातुओं में भी घुलनशीलता व्यापक हो सकती है। यदि दो धातुओं की संरचना समान है, तो पूर्ण ठोस घुलनशीलता भी हो सकती है, जैसा कि चांदी और सोने के मिश्रधातु एलेक्ट्रम के मामले में होता है। हालांकि, कभी-कभी, दो धातुएं दो माता-पिता की तुलना में अलग-अलग संरचनाओं के साथ मिश्रधातु बनाती हैं। कोई इन सामग्रियों को इंटरमेटेलिक्स कह सकता है। लेकिन, क्योंकि धातु बंधन वाली सामग्री आमतौर पर आणविक नहीं होती है, डाल्टन का निश्चित अनुपात का नियम मान्य नहीं है; और अक्सर स्टोइकीओमेट्रिक अनुपात की एक श्रृंखला प्राप्त की जा सकती है। ऐसे मामलों में 'शुद्ध पदार्थ' या 'विलेय' जैसी अवधारणाओं को त्यागना और इसके बजाय चरण (पदार्थ) की बात करना बेहतर है। इस तरह के चरणों का अध्ययन पारंपरिक रूप से रसायन विज्ञान की तुलना में धातु विज्ञान का अधिक क्षेत्र रहा है, हालांकि दोनों क्षेत्र काफी हद तक ओवरलैप करते हैं।
स्थानीयकरण और क्लस्टरिंग: बॉन्डिंग से बॉन्ड्स तक
जटिल यौगिकों में धात्विक बंधन आवश्यक रूप से सभी घटक तत्वों को समान रूप से शामिल नहीं करता है। एक या एक से अधिक तत्वों का होना बहुत संभव है जो बिल्कुल भी भाग नहीं लेते हैं। उनके चारों ओर बहने वाले प्रवाहकीय इलेक्ट्रॉनों को एक द्वीप या एक बड़ी चट्टान के चारों ओर एक नदी की तरह चित्रित किया जा सकता है। यह देखना संभव है कि कौन से तत्व भाग लेते हैं: उदाहरण के लिए, एक्स - रे फ़ोटोइलैक्ट्रॉन स्पेक्ट्रोस्कोपी (एक्सपीएस) स्पेक्ट्रम में कोर स्तरों को देखकर। यदि कोई तत्व भाग लेता है, तो उसकी चोटियाँ तिरछी हो जाती हैं।
कुछ इंटरमेटेलिक सामग्री, उदाहरण के लिए, अणुओं की याद दिलाने वाले धातु समूहों को प्रदर्शित करते हैं; और ये यौगिक धातु विज्ञान की तुलना में अधिक रसायन विज्ञान का विषय हैं। समूहों के गठन को अधिक स्थानीयकृत प्रकृति के बंधनों में इलेक्ट्रॉन-कमी वाले बंधन को 'संघनित' (स्थानीयकृत) करने के तरीके के रूप में देखा जा सकता है। हाइड्रोजन संघनन के इस रूप का एक चरम उदाहरण है। उच्च दाब पर धात्विक हाइड्रोजन। बृहस्पति ग्रह के कोर को गुरुत्वाकर्षण द्वारा प्रेरित धातु बंधन और उच्च दबाव के संयोजन से एक साथ रखा जा सकता है। हालांकि, कम दबावों पर, बंधन पूरी तरह से एक नियमित सहसंयोजक बंधन में स्थानीयकृत हो जाता है। स्थानीयकरण इतना पूर्ण है कि (अधिक परिचित) H2 गैस परिणाम। बोरॉन जैसे तत्व के लिए भी यही तर्क लागू होता है। हालांकि यह कार्बन की तुलना में इलेक्ट्रॉन की कमी है, यह धातु नहीं बनाता है। इसके बजाय इसमें कई जटिल संरचनाएं हैं जिनमें विंशतिफलक B12 गुच्छों का हावी है। चार्ज घनत्व तरंगें एक संबंधित घटना हैं।
चूँकि इन परिघटनाओं में परमाणुओं का एक-दूसरे की ओर या दूर जाना शामिल है, उन्हें सामग्री के इलेक्ट्रॉन जोड़ी कंपन अवस्थाओं (अर्थात फोनोन्स) के बीच युग्मन के रूप में व्याख्या किया जा सकता है। ऐसा माना जाता है कि इस तरह के एक अलग इलेक्ट्रॉन-फोनन इंटरैक्शन से अतिचालकता के कम तापमान पर बहुत अलग परिणाम मिलते हैं। स्थानीय बांडों में इलेक्ट्रॉन जोड़े बनाकर आवेश वाहकों की गतिशीलता को अवरुद्ध करने के बजाय, कूपर-जोड़े बनते हैं जो अब उनकी गतिशीलता के लिए किसी भी प्रतिरोध का अनुभव नहीं करते हैं।
ऑप्टिकल गुण
मोबाइल आवेश वाहकों के एक महासागर की उपस्थिति का धातुओं के ऑप्टिकल गुणों पर गहरा प्रभाव पड़ता है, जिसे केवल इलेक्ट्रॉनों को एक सामूहिक के रूप में समझा जा सकता है, बजाय इसके कि अधिक पारंपरिक सहसंयोजक बंधों में शामिल व्यक्तिगत इलेक्ट्रॉनों की अवस्थाओं पर विचार किया जाए।
प्रकाश में एक विद्युत और एक चुंबकीय क्षेत्र का संयोजन होता है। विद्युत क्षेत्र आमतौर पर धातु बंधन में शामिल इलेक्ट्रॉनों से लोचदार प्रतिक्रिया को उत्तेजित करने में सक्षम होता है। नतीजा यह है कि फोटॉन धातु में बहुत दूर तक प्रवेश नहीं कर सकते हैं और आम तौर पर प्रतिबिंबित होते हैं, हालांकि कुछ अवशोषित भी हो सकते हैं। यह दृश्यमान स्पेक्ट्रम में सभी फोटॉन के लिए समान रूप से लागू होता है, यही वजह है कि धातुएं अक्सर धातु की चमक (खनिज विज्ञान) के विशिष्ट स्पेक्युलर प्रतिबिंब के साथ चांदी जैसे सफेद या भूरे रंग की होती हैं। परावर्तन और अवशोषण के बीच संतुलन यह निर्धारित करता है कि धातु कितनी सफेद या कितनी ग्रे है, हालांकि सतह का धुंधलापन चमक को अस्पष्ट कर सकता है। चांदी, उच्च चालकता वाली धातु, सबसे सफेद में से एक है।
उल्लेखनीय अपवाद लाल रंग का तांबा और पीला सोना है। उनके रंग का कारण यह है कि प्रकाश की आवृत्ति की एक ऊपरी सीमा होती है जिसका धात्विक इलेक्ट्रॉन आसानी से जवाब दे सकते हैं: प्लास्मोन आवृत्ति। प्लास्मोन आवृत्ति पर, मुक्त इलेक्ट्रॉन मॉडल का आवृत्ति-निर्भर ढांकता हुआ कार्य नकारात्मक (प्रतिबिंबित) से सकारात्मक (संचारण) तक जाता है; उच्च आवृत्ति फोटॉन सतह पर प्रतिबिंबित नहीं होते हैं, और धातु के रंग में योगदान नहीं करते हैं। कुछ सामग्रियां हैं, जैसे इंडियम टिन ऑक्साइड (आईटीओ), जो कि धात्विक चालक (वास्तव में पतित अर्धचालक) हैं, जिसके लिए यह दहलीज अवरक्त में है,[8] यही कारण है कि वे दृश्यमान में पारदर्शी होते हैं, लेकिन इन्फ्रारेड में अच्छे परावर्तक होते हैं।
चांदी के लिए सीमित आवृत्ति दूर पराबैंगनी में होती है, लेकिन तांबे और सोने के लिए यह दृश्यमान के करीब होती है। यह इन दोनों धातुओं के रंगों की व्याख्या करता है। एक धातु की सतह पर, अनुनाद प्रभाव जिसे सरफेस प्लास्मोन अनुनाद के रूप में जाना जाता है, का परिणाम हो सकता है। वे चालन इलेक्ट्रॉनों के सामूहिक दोलन हैं, जैसे इलेक्ट्रॉनिक महासागर में एक लहर। हालाँकि, भले ही फोटॉनों में पर्याप्त ऊर्जा हो, उनके पास आमतौर पर तरंग को गति में सेट करने के लिए पर्याप्त गति नहीं होती है। इसलिए, थोक धातु पर प्लास्मों को उत्तेजित करना कठिन होता है। यही कारण है कि सोना और तांबा रंग के डैश के साथ चमकदार धातुओं की तरह दिखते हैं। हालांकि, कोलाइडयन सोने में धात्विक बंधन एक छोटे धातु के कण तक ही सीमित होता है, जो प्लास्मोन के दोलन तरंग को 'भागने' से रोकता है। संवेग चयन नियम इसलिए टूट गया है, और प्लास्मोन अनुनाद हरे रंग में एक अत्यंत तीव्र अवशोषण का कारण बनता है, जिसके परिणामस्वरूप बैंगनी-लाल रंग होता है। इस तरह के रंग रंगों और इसी तरह के सामान्य अवशोषणों की तुलना में अधिक तीव्र परिमाण के क्रम होते हैं, जिसमें व्यक्तिगत इलेक्ट्रॉनों और उनकी ऊर्जा अवस्थाएं शामिल होती हैं।
यह भी देखें
टिप्पणियाँ
- ↑ If the electrons were truly free, their energy would only depend on the magnitude of their wave vector k, not its direction. That is, in k-space, the Fermi level should form a perfect sphere. The shape of the Fermi level can be measured by cyclotron resonance and is never a sphere, not even for caesium.[5]
- ↑ Electron deficiency is a relative term: it means fewer than half of the electrons needed to complete the next noble gas configuration. For example, lithium is electron deficient with respect to neon, but electron-rich with respect to the previous noble gas, helium.
संदर्भ
- ↑ Metallic bonding. chemguide.co.uk
- ↑ Metal structures. chemguide.co.uk
- ↑ Chemical Bonds. chemguide.co.uk
- ↑ "Physics 133 Lecture Notes" Spring, 2004. Marion Campus. physics.ohio-state.edu
- ↑ Okumura, K. & Templeton, I. M. (1965). "The Fermi Surface of Caesium". Proceedings of the Royal Society of London A. 287 (1408): 89–104. Bibcode:1965RSPSA.287...89O. doi:10.1098/rspa.1965.0170. JSTOR 2415064. S2CID 123127614.
- ↑ श्राइवर और एटकिंस की अकार्बनिक रसायन. Oxford University Press. 2010. pp. 74–. ISBN 978-0-19-923617-6.
- ↑ Daw, Murray S.; Foiles, Stephen M.; Baskes, Michael I. (1993). "एम्बेडेड-एटम विधि: सिद्धांत और अनुप्रयोगों की समीक्षा". Materials Science Reports (Submitted manuscript). 9 (7–8): 251–310. doi:10.1016/0920-2307(93)90001-U.
- ↑ Brewer, Scott H.; Franzen, Stefan (2002). "इंडियम टिन ऑक्साइड प्लाज्मा आवृत्ति शीट प्रतिरोध पर निर्भरता और प्रतिबिंब एफटीआईआर स्पेक्ट्रोस्कोपी द्वारा निर्धारित सतह एडलेयर". The Journal of Physical Chemistry B. 106 (50): 12986–12992. doi:10.1021/jp026600x.