विलेयता: Difference between revisions
m (→ठोस विलयन) |
|||
| Line 236: | Line 236: | ||
== ठोस विलयन == | == ठोस विलयन == | ||
इस शब्द का प्रयोग अक्सर धातु विज्ञान के क्षेत्र में किया जाता है ताकि एक अलग अवस्था के गठन के बिना [[मिश्र धातु]] तत्व | इस शब्द का प्रयोग अक्सर धातु विज्ञान के क्षेत्र में किया जाता है ताकि एक मिश्रधातु तत्व एक अलग अवस्था बनाए बिना [[आधार धातु]] में विलेय हो जाए। इस शब्द का प्रयोग अक्सर धातु विज्ञान के क्षेत्र में किया जाता है ताकि एक अलग अवस्था के गठन के बिना [[मिश्र धातु]] तत्व में विलेय हो जाए। [[अपराध]] या विलेयता रेखा (या वक्र) एक [[चरण आरेख|अवस्था आरेख]] पर रेखा (या रेखाएँ) होती है जो विलेय योग की सीमाएँ देती है। अर्थात्, रेखाएँ किसी घटक की अधिकतम मात्रा दर्शाती हैं जिसे किसी अन्य घटक में जोड़ा जा सकता है और फिर भी ठोस विलयन में हो सकता है। ठोस की क्रिस्टलीय संरचना में, 'विलेय' तत्व या तो जाली के भीतर मैट्रिक्स का स्थान ले सकता है (एक प्रतिस्थापन स्थिति; उदाहरण के लिए, लोहे में क्रोमियम) या जाली बिंदुओं (एक अंतरालीय स्थिति; उदाहरण के लिए, लोहे में कार्बन)। This term is often used in the field of metallurgy to refer to the extent that an alloying element will dissolve into the base metal without forming a separate phase. The solvus or solubility line (or curve) is the line (or lines) on a phase diagram that give the limits of solute addition. That is, the lines show the maximum amount of a component that can be added to another component and still be in solid solution. In the solid's crystalline structure, the 'solute' element can either take the place of the matrix within the lattice (a substitutional position; for example, chromium in iron) or take a place in a space between the lattice points (an interstitial position; for example, carbon in iron).अर्थात्, रेखाएँ किसी घटक की अधिकतम मात्रा दर्शाती हैं जिसे किसी अन्य घटक में जोड़ा जा सकता है और फिर भी ठोस समाधान में हो सकता है | ||
माइक्रोइलेक्ट्रॉनिक फैब्रिकेशन में, ठोस विलेयताअशुद्धियों की अधिकतम सांद्रता को संदर्भित करती है जिसे सब्सट्रेट में रखा जा सकता है। | माइक्रोइलेक्ट्रॉनिक फैब्रिकेशन में, ठोस विलेयताअशुद्धियों की अधिकतम सांद्रता को संदर्भित करती है जिसे सब्सट्रेट में रखा जा सकता है। | ||
Revision as of 16:03, 27 December 2022

रसायन विज्ञान में, विलेयताएक रासायनिक पदार्थ की क्षमता है, विलेय, दूसरे पदार्थ, विलायक के साथ मिलकर एक विलयन बनाता है। अविलेयताविलेयताके विपरीत है, इसमें विलेय विलायक के साथ विलयन बनाने में असमर्थता प्रदर्शित करता है।
एक विशिष्ट विलायक में किसी पदार्थ की विलेयता की सीमा को सामान्यतः पर संतृप्त घोल में विलेय की सांद्रता के रूप में मापा जाता है, जिसमें कोई और विलेय नहीं घुल सकता है।[1] इस बिंदु पर, कहा जाता है की दो पदार्थों की आपस में विलेयता साम्यावस्था है। कुछ विलेय और विलायक के लिए, ऐसी कोई सीमा नहीं हो सकती है, जिस स्थिति में दो पदार्थों को "सभी अनुपातों में मिश्रणीय" (या केवल "विलेय") कहा जाता है।[2]
विलेय ठोस, द्रव या गैस हो सकता है, जबकि विलायक सामान्यतः पर ठोस या द्रव होता है। दोनों शुद्ध पदार्थ हो सकते हैं, या स्वयं विलयन हो सकते हैं। अत्यधिक चरम स्थितियों को छोड़कर, गैसें हमेशा सभी अनुपातों में मिश्रणीय होती हैं।[3], और एक ठोस या द्रव गैस में गैसीय अवस्था में ही परिवर्तित होकर ही "घुल" सकती है।
विलेयतामुख्य रूप से विलेय और विलायक की संरचना (उनके पीएच(pH)और अन्य घुले हुई पदार्थों की उपस्थिति) के साथ-साथ तापमान और दबाव पर निर्भर करती है। निर्भरता को अक्सर दो पदार्थों के कणों (परमाणुओं, अणुओं, या आयनों) के बीच परस्पर क्रिया के रूप में और तापीय धारिता और एन्ट्रॉपी जैसी ऊष्मागतिकीय अवधारणाओं के संदर्भ में समझाया जा सकता है।
कुछ शर्तों के तहत, विलेय की सांद्रता इसकी सामान्य विलेयता सीमा से अधिक हो सकती है। जिसका परिणाम एक सुपरसैचुरेटेड विलयन है, जो मेटास्टेबल है और यदि एक उपयुक्त केंद्रक साइट दिखाई देती है तो अतिरिक्त विलेय को तेजी से बाहर कर देगा।[4]
विलेयता की अवधारणा तब लागू नहीं होती है जब दो पदार्थों के बीच एक अपरिवर्तनीय रासायनिक अभिक्रिया होती है, जैसे कि हाइड्रोक्लोरिक अम्ल के साथ कैल्शियम हाइड्रॉक्साइड की अभिक्रिया; भले ही कोई कह सकता है, अनौपचारिक रूप से, कि एक दूसरे में घुल गया। विलेयताभी विलयन की दर के समान नहीं है, जो कि द्रव विलायक में एक ठोस विलेय कितनी तेजी से घुलता है। यह संपत्ति कई अन्य चरों पर निर्भर करती है, जैसे कि दो पदार्थों का भौतिक रूप और मिश्रण का तरीका और तीव्रता।
रसायन विज्ञान के अलावा कई विज्ञानों में विलेयता की अवधारणा और विलेयता का पैमाना अत्यंत महत्वपूर्ण हैं, जैसे कि भूविज्ञान, जीव विज्ञान, भौतिकी और समुद्र विज्ञान, साथ ही साथ अभियांत्रिकी, चिकित्सा, कृषि और यहां तक कि गैर-तकनीकी गतिविधियों जैसे चित्र, सफाई, खाना पकाना, और शराब बनाना। वैज्ञानिक, औद्योगिक, या व्यावहारिक हित की अधिकांश रासायनिक अभिक्रियाएँ तभी होती हैं जब अभिकर्मक को एक उपयुक्त विलायक में घोल दिया जाता है। जल अब तक का सबसे सामान्य विलायक है।
विलेयता शब्द का प्रयोग कभी-कभी उन सामग्रियों के लिए किया जाता है जो द्रव में बहुत महीन ठोस कणों के कोलाइड बना सकते हैं।[5] हालांकि, ऐसे पदार्थों की मात्रात्मक विलेयता सामान्यतः पर अच्छी तरह से परिभाषित नहीं होती है।
विलेयता की मात्रा
एक विशिष्ट विलायक में एक विशिष्ट विलेय की विलेयता को सामान्यतः दो के संतृप्त विलयन की सान्द्रता के रूप में व्यक्त किया जाता है[1]। विलयन की सान्द्रता को व्यक्त करने के कई तरीकों में से किसी का भी उपयोग किया जा सकता है, जैसे कि द्रव्यमान, आयतन, या किसी विशिष्ट द्रव्यमान, आयतन या विलायक या विलयन के मोल के लिए विलेय की मोल् में मात्रा।
विलायक की प्रति मात्रा
विशेष रूप से, रासायनिक पुस्तिकाएं अक्सर एक द्रव पदार्थ में पदार्थ की विलेयता को विलेय प्रति डेसी लीटर (100 मिली लीटर) विलायक (g/dL) के के रूप में; या, सामान्यतः पर ग्राम प्रति लीटर (g/L) के रूप में व्यक्त करती हैं। इसके बजाय विलायक की मात्रा द्रव्यमान में व्यक्त की जा सकती है, जैसे ग्राम/100 ग्राम या ग्राम/किग्रा। इस मामले में संख्या को प्रतिशत के रूप में व्यक्त किया जा सकता है, और "भार प्रति भार" इंगित करने के लिए संक्षिप्त नाम w/w का उपयोग किया जा सकता है।[6] (g/L और g/kg में मान व्यावहारिक रूप से जल के लिए समान हैं, लेकिन अन्य विलायक के लिए नहीं।)
वैकल्पिक रूप से, विलेय की मात्रा द्रव्यमान के बजाय मोल्स में व्यक्त की जा सकती है; यदि विलायक की मात्रा किलोग्राम में दी गई है, तो विलयन की मोललता (mol/kg) होगी।
विलयन की प्रति मात्रा की प्रति मात्रा
किसी द्रव में किसी पदार्थ की विलेयता को विलायक की बजाय विलयन की प्रति मात्रा में उपस्थित विलेय की मात्रा के रूप में भी व्यक्त किया जा सकता है। उदाहरण के लिए, अनुमापन में सामान्य अभ्यास के बाद, इसे विलयन मे उपस्थित विलेय के मोल प्रति लीटर (mol / L) के रूप में व्यक्त किया जा सकता है,
अधिक विशिष्ट संदर्भों में विलेयता मोल - प्रभाज(विलेय प्लस सॉल्वेंट के कुल मोल प्रति विलेय के मोल्स) या द्रव्यमान अंश (रसायन विज्ञान) द्वारा साम्य (विलेय प्लस सॉल्वेंट के द्रव्यमान प्रति द्रव्यमान का द्रव्यमान), दोनों आयामी विश्लेषण द्वारा दी जा सकती है। 0 और 1 के बीच की संख्याएँ जिन्हें प्रतिशत के रूप में व्यक्त किया जा सकता है। In more specialized contexts the solubility may be given by the mole fraction (moles of solute per total moles of solute plus solvent) or by the mass fraction at equilibrium (mass of solute per mass of solute plus solvent), both adimensional numbers between 0 and 1 which may be expressed as percentages.
द्रव और गैसीय विलेय
द्रव पदार्थ या गैसों में उपस्थित द्रव पदार्थ के विलयन के लिए, दोनों पदार्थों की मात्राओं को द्रव्यमान या मोल राशि के बजाय दोनों पदार्थों की मात्रा को आयतन दिया जा सकता है; जैसे कि प्रति लीटर विलायक का लीटर, या प्रति लीटर विलयन में विलेय की मात्रा। मान प्रतिशत के रूप में दिया जा सकता है, और इस विकल्प को इंगित करने के लिए "आयतन प्रति आयतन" के लिए संक्षिप्त नाम "v/v" का उपयोग किया जा सकता है।
विलेयता मूल्यों का रूपांतरण
विलेयता को मापने के इन विभिन्न तरीकों के बीच रूपांतरण नगण्य नहीं हो सकता है, क्योंकि इसके लिए विलयन के घनत्व को जानने की आवश्यकता हो सकती है - जिसे प्रायः मापा नहीं जाता है, और इसकी भविष्यवाणी नहीं की जा सकती है। जबकि कुल द्रव्यमान को विघटन द्वारा संरक्षित किया जाता है, अंतिम मात्रा विलायक की मात्रा और दोनों मात्राओं के योग से भिन्न हो सकती है।[7]
इसके अलावा, कई ठोस (जैसे अम्ल और लवण) विलेय होने पर गैर-मामूली तरीकों से पृथक्करण होगा; इसके विपरीत, विलायक विलेय के अणुओं या आयनों के साथ समन्वय संकुल बना सकता है। उन मामलों में, विलेय और विलायक के अणुओं के मोल् का योग वास्तव में स्वतंत्र कणों के विलयन का कुल मोल नहीं होता है। उस समस्या को दूर करने के लिए, विलयन के प्रति मोल की विलेयता की गणना सामान्यतः की जाती है और इसे इस तरह उद्धृत किया जाता है जैसे कि विलेय अलग नहीं होता है या कॉम्प्लेक्स नहीं बनाते हैं - अर्थात, यह दिखावा करके कि विलयन की मोल मात्रा दो पदार्थों की मोल मात्रा का योग है। .
विलेयता की सीमा का वर्णन करने के लिए प्रयुक्त क्वालिफायर्स
विलेयता की सीमा व्यापक रूप से, असीम रूप से विलेयता (बिना सीमा के, यानी मिश्रणीय) से होती है[2] जैसे कि जल में विलेय इथेनॉल, अनिवार्य रूप से जल में अविलेय, टाइटेनियम डाइऑक्साइ किसी दिए गए आवेदन के लिए विलेयता की सीमा को अर्हता प्राप्त करने के लिए कई अन्य वर्णनात्मक शर्तों का भी उपयोग किया जाता है। उदाहरण के लिए, यू.एस. फार्माकोपिया विलेय के द्रव्यमान msu की एक इकाई को विलेय करने के लिए आवश्यक विलायक के द्रव्यमान msv के अनुसार निम्नलिखित शर्तें देता है:[8] (20-25 डिग्री सेल्सियस पर पानी के लिए उदाहरणों की विलेयताएं अनुमानित है।)
| Term | range | Example | g/dL | msv/msu |
|---|---|---|---|---|
| Very soluble | <1 | calcium nitrate | 158.7 | 0.63 |
| Freely soluble | 1 to 10 | calcium chloride | 65 | 1.54 |
| Soluble | 10 to 30 | sodium oxalate | 3.9 | 26 |
| Sparingly soluble | 30 to 100 | |||
| Slightly soluble | 100 to 1000 | calcium sulfate | 0.21 | 490 |
| Very slightly soluble | 1000 to 10,000 | dicalcium phosphate | 0.02 | 5000 |
| Practically insoluble or insoluble | ≥ 10,000 | barium sulfate | 0.000245 | 409000 |
अविलेयता, या समान शर्तों के रूप में किसी चीज़ का वर्णन करने के लिए थ्रेसहोल्ड, अनुप्रयोग पर निर्भर हो सकता है। उदाहरण के लिए, एक स्रोत बताता है कि जब पदार्थों की घुलनशीलता 0.1 ग्राम प्रति 100 एमएल विलायक से कम होती है तो पदार्थों को "अघुलनशील" के रूप में वर्णित किया जाता है।
आणविक दृश्य
विलेयता गतिशील साम्यावस्था के तहत होती है, जिसका अर्थ है कि विलेयता विघटन और अवस्था में सम्मिलित होने के साथ और विरोधी प्रक्रियाओं (जैसे ठोस पदार्थों के अवक्षेपण) से उत्पन्न होती है। विलेयता साम्यावस्था तब आती है जब दो प्रक्रियाएं समान और विपरीत दरों पर आगे बढ़ती हैं।
विलेयता शब्द का उपयोग कुछ क्षेत्रों में भी किया जाता है जहां विलेय को विलेयता द्वारा बदल दिया जाता है। उदाहरण के लिए, कई धातुओं और उनके ऑक्साइड को हाइड्रोक्लोरिक एसिड में विलेय किया जाता है, हालांकि वास्तव में जलीय अम्ल घुलनशील उत्पाद देने के लिए ठोस को अपरिवर्तनीय रूप से कम करता है। यह भी सच है कि अधिकांश आयनिक ठोस ध्रुवीय विलायकों द्वारा घुल जाते हैं, लेकिन ऐसी प्रक्रियाएं उत्क्रमणीय होती हैं। उन मामलों में जहां विलायक के वाष्पीकरण पर विलेय को पुनर्प्राप्त नहीं किया जाता है, इस प्रक्रिया को सॉल्वोलिसिस कहा जाता है। विलेयता की थर्मोडायनामिक अवधारणा सीधे तौर पर सॉल्वोलिसिस पर लागू नहीं होती है।
जब एक विलेय घुल जाता है, तो यह विलयन में कई प्रजातियाँ बना सकता है। उदाहरण के लिए, आयरन (आयरन(II) हाइड्रॉक्साइड Fe(OH)
2 का एक जलीय निलंबन, में श्रृंखला शामिल होगी [Fe(H2O)x(OH)x](2x)+ साथ ही अन्य प्रजातियां सम्मिलित होंगी। इसके अलावा, फेरस हाइड्रॉक्साइड की विलेयता और इसके घुलनशील अवयवों की संरचना पीएच पर निर्भर करती है। सामान्य तौर पर, विलायक अवस्था में विलेयता केवल एक विशिष्ट विलेय के लिए दी जा सकती है जो थर्मोडायनामिक रूप से स्थिर है, और विलेयता के मान में सभी प्रजातियों को विलयन में सम्मिलित किया जाएगा (ऊपर के उदाहरण में, सभी लोहे युक्त संकुल)।
विलेयता को प्रभावित करने वाले कारक
विलेयता को विशिष्ट अवस्था के लिए परिभाषित किया गया है। उदाहरण के लिए, पानी में एंरेगोनाइट और केल्साइट की विलेयता अलग-अलग होने की उम्मीद है, भले ही वे दोनों कैल्शियम कार्बोनेट के बहुरूप हैं और उनका रासायनिक सूत्र समान है।
एक पदार्थ की दूसरे में विलेयता विलायक और विलेय के बीच अंतर-आणविक बलों के साम्य और सॉल्वेशन के साथ होने वाले एन्ट्रापी परिवर्तन से निर्धारित होती है। तापमान और दबाव जैसे कारक इस साम्य को बदल देंगे, इस प्रकार विलेयता बदल जाएगी।
विलेयता विलायक में घुली अन्य प्रजातियों की उपस्थिति पर भी दृढ़ता से निर्भर हो सकती है, उदाहरण के लिए, द्रव पदार्थों में संकुल बनाने वाले ऋणायन (लिगेंड)। विलेयता विलयन में एक सामान्य आयन की अधिकता या कमी पर भी निर्भर करेगी, जिसे सामान्य-आयन प्रभाव के रूप में जाना जाता है। कुछ हद तक, विलेयता विलयनों की आयनिक शक्ति पर निर्भर करेगी। विलेयता साम्यावस्था के लिए समीकरण का उपयोग करके पिछले दो प्रभावों को परिमाणित किया जा सकता है।
एक ठोस के लिए जो एक रेडॉक्स अभिक्रिया में घुल जाता है, विलेयता विभव पर निर्भरकरती है (विभव की सीमा में जिसके तहत ठोस ऊष्मागतिकीय रूप से स्थिर अवस्था में रहता है)। उदाहरण के लिए, उच्च तापमान वाले जल में सोने की विलेयता लगभग उच्च मैग्नीट्यूड पर देखी जाती है (यानी लगभग दस गुना अधिक) के रूप में देखी जाती है, जब रेडॉक्स क्षमता को अत्यधिक ऑक्सीकरण वाले Fe3O4-Fe2O3 रेडॉक्स बफर का[9] उपयोग करके मध्यम ऑक्सीकरण वाले Ni-NiO बफर के साथ नियंत्रित किया जाता है।
विलेयता (मेटास्टेबल, संतृप्ति के करीब आने वाली सांद्रता पर) क्रिस्टल के भौतिक आकार या विलेय की छोटी बूंद (या, सख्ती से बोलना, विशिष्ट सतह क्षेत्र या विलेय के मोलर सतह क्षेत्र पर निर्भर करता है।[10] परिमाणीकरण के लिए, विलेयता साम्यावस्था पर लेख में समीकरण देखें। अत्यधिक दोषपूर्ण क्रिस्टल के लिए, जैसे जैसे विकार बढ़ेगा वैसे वैसे विलेयता बढ़ती है।ये दोनों प्रभाव क्रिस्टल की गिब्स ऊर्जा पर विलेयता स्थिरांक की निर्भरता के कारण उत्पन्न होते हैं। अंतिम दो प्रभाव, हालांकि मापना अक्सर मुश्किल होता है, व्यावहारिक महत्व के होते हैं।[citation needed] उदाहरण के लिए, वे ऑस्वाल्ड राइपनिंग के लिए प्रेरणा शक्ति प्रदान करते हैं (क्रिस्टल का आकार अनायास समय के साथ बढ़ता है)।
तापमान
किसी दिए गए विलायक में किसी दिए गए विलेय की विलेयता तापमान का फलन है। विघटन प्रतिक्रिया के तापीय धारिता (ΔH) में परिवर्तन के आधार पर, यानी, एंडोथर्मिक प्रक्रिया (ΔH > 0) या एक्ज़ोथिर्मिक प्रक्रिया (ΔH < 0) विघटन प्रतिक्रिया के लक्षण पर, किसी दिए गए यौगिक की घुलनशीलता तापमान के साथ बढ़ या घट सकती है। वैन 'टी हॉफ समीकरण तापमान परिवर्तन और प्रतिक्रिया एन्थैल्पी परिवर्तन के लिए घुलनशीलता साम्यावस्था स्थिरांक (केएसपी) के परिवर्तन से संबंधित है। अधिकांश ठोस और द्रव पदार्थों के लिए, तापमान के साथ उनकी विलेयता बढ़ जाती है क्योंकि उनकी विघटन अभिक्रिया एंडोथर्मिक (ΔH > 0) होती है।[11] उच्च तापमान पर द्रव पानी में, (जैसे कि महत्वपूर्ण तापमान के करीब), द्रव पानी के गुणों और संरचना में परिवर्तन के कारण आयनिक विलेय की विलेयता कम हो जाती है; कम ढांकता हुआ स्थिरांक एक कम ध्रुवीय विलायक और जलयोजन ऊर्जा के परिवर्तन में विघटन अभिक्रिया के ΔG को प्रभावित करता है।
गैसीय विलेय तापमान के साथ अधिक जटिल व्यवहार प्रदर्शित करते हैं। जैसे-जैसे तापमान बढ़ता है, गैसें सामान्यतः पानी में कम विलेय हो जाती हैं (उनके जलयोजन से संबंधित एक्ज़ोथिर्मिक विघटन अभिक्रिया) (न्यूनतम तक, जो अधिकांश स्थायी गैसों के लिए 120 डिग्री सेल्सियस से कम है[12]), लेकिन कार्बनिक विलायक में अधिक विलेय होती है (उनके सॉल्वैंशन से संबंधित एंडोथर्मिक विघटन अभिक्रिया)।[11]
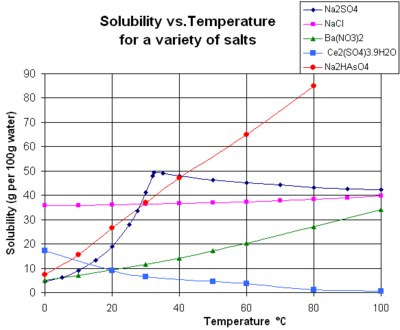
चार्ट द्रव पानी में कुछ विशिष्ट ठोस अकार्बनिक लवण (रसायन विज्ञान) के लिए विलेयतावक्र दिखाता है (तापमान डिग्री सेल्सीयस में है, यानी केल्विन माइनस 273.15)।[13] कई लवण बेरियम नाइट्रेट और डाइसोडियम हाइड्रोजन आर्सेनेट की तरह व्यवहार करते हैं, और तापमान के साथ विलेयता में बड़ी वृद्धि दिखाते हैं (ΔH > 0)। कुछ विलेय (जैसे पानी में सोडियम क्लोराइड) विलेयता प्रदर्शित करते हैं जो तापमान पर निर्भर नहीं करती (ΔH ≈ 0)। कुछ, जैसे कैल्शियम सल्फेट (जिप्सम) और सीरियम (III) सल्फेट, तापमान बढ़ने पर पानी में कम विलेय हो जाते हैं (ΔH < 0)।[14] यही स्थिति कैल्शियम हाइड्रॉक्साइड (पोर्टलैंडर्स) की भी है, जिसकी 70 डिग्री सेल्सियस पर विलेयता 25 डिग्री सेल्सियस पर इसके मूल्य का लगभग आधा है। कैल्शियम हाइड्रॉक्साइड का पानी में घुलना भी एक एक्ज़ोथिर्मिक प्रक्रिया (ΔH < 0) है और वैन 'टी हॉफ़ समीकरण और ले चेटेलियर के सिद्धांत का पालन करता है। तापमान में कमी प्रणाली से विघटन गर्मी को हटाने के पक्ष में है और इस प्रकार सीए (ओएच) के विघटन का पक्ष लेती है।2: इसलिए कम तापमान पर पोर्टलैंडाइट विलेयता बढ़ जाती है। इस तापमान निर्भरता को कभी-कभी "प्रतिगामी" या "प्रतिलोम" विलेयता कहा जाता है। कभी-कभी, एक अधिक जटिल पैटर्न देखा जाता है, जैसे कि सोडियम सल्फेट के साथ, जहां कम घुलनशील डिकाहाइड्रेट क्रिस्टल (मिराबिलिट) 32 डिग्री सेल्सियस पर क्रिस्टलीकरण के पानी को खो देता है ताकि गिब्स मुक्त ऊर्जा में एक छोटे से बदलाव के साथ अधिक घुलनशील निर्जल अवस्था (थेनाडाइट) बन सके।[citation needed]
तापमान के साथ कार्बनिक यौगिकों की विलेयता लगभग हमेशा बढ़ जाती है। ठोस पदार्थों के शुद्धिकरण के लिए उपयोग की जाने वाली पुनर्क्रिस्टलीकरण की तकनीक गर्म और ठंडे विलायक में विलेय की विभिन्न विलेयताओं पर निर्भर करती है। कुछ अपवाद मौजूद हैं, जैसे कुछ साइक्लोडेक्सट्रिन।[15]
दबाव
संघनित अवस्थाों (ठोस और द्रव पदार्थ) के लिए, विलेयता की दबाव निर्भरता सामान्यतः कमजोर होती है और सामान्यतः व्यवहार में उपेक्षित होती है। एक आदर्श विलयन मानते हुए, निर्भरता को इस प्रकार निर्धारित किया जा सकता है:
जहां सूचकांक घटकों को पुनरावृत्त करता है, th विलयन का मोल प्रभाज है दबाव है, सूचकांक स्थिर तापमान को संदर्भित करता है, th विलयन का आंशिक मोलर आयतन है, विलयनका आंशिक मोलर आयतन है, R सार्वत्रिक गैस नियतांक है।[16]
विलेयता की दबाव निर्भरता का कभी-कभी व्यावहारिक महत्व होता है। उदाहरण के लिए, कैल्शियम सल्फेट (जो दबाव में कमी के साथ इसकी विलेयता को कम करता है) द्वारा तेल क्षेत्रों और कुओं के दूषित होने से समय के साथ उत्पादकता में कमी आ सकती है।
गैसों की विलेयता
विलायक में गैसों की विलेयता की मात्रा निर्धारित करने के लिए हेनरी के नियम का उपयोग किया जाता है। किसी विलायक में गैस की विलेयता विलायक के ऊपर उस गैस के आंशिक दबाव के समानुपाती होती है। यह संबंध राउल्ट के नियम के समान है और इसे इस प्रकार लिखा जा सकता है:
कहाँ पे एक तापमान-निर्भर स्थिरांक है ((उदाहरण के लिए, 298 K पर पानी में डाइऑक्सीजन (O2) के लिए 769.2 लीटर atm/mol ), आंशिक दबाव (एटीएम में) है, और द्रव में घुलित गैस की सांद्रता है (mol/L में)।
बन्सेन विलेयता गुणांक का उपयोग करके कभी-कभी गैसों की विलेयता भी निर्धारित की जाती है।
छोटे बुलबुले की उपस्थिति में, गैस की घुलनशीलता दबाव पर त्रिज्या के प्रभाव के अलावा किसी अन्य तरीके से बुलबुला त्रिज्या पर निर्भर नहीं करती है। (अर्थात छोटे बुलबुले के संपर्क में द्रव में गैस की विलेयता बढ़ जाती है) Δp = 2γ/r द्वारा दबाव बढ़ाने के लिए; यंग-लाप्लास समीकरण देखें)।[17]
हेनरी का नियम गैसों के लिए मान्य है जो विघटन पर रासायनिक प्रजाति परिवर्तन से नहीं गुजरते हैं। सिवर्ट्स का कानून एक मामला दिखाता है जब यह धारणा सही नहीं होती है।
समुद्री जल में कार्बन डाइआक्साइड विलेयता भी तापमान, विलयन के पीएच और कार्बोनेट बफर द्वारा प्रभावित होती है। तापमान बढ़ने पर समुद्री जल में कार्बन डाइऑक्साइड की विलेयता में कमी भी एक महत्वपूर्ण पूर्वव्यापी कारक (सकारात्मक अभिक्रिया) है जो अतीत और भविष्य के जलवायु परिवर्तन (सामान्य अवधारणा) को बढ़ा देता है जैसा कि अंटार्कटिका में वोस्तोक साइट से बर्फ के कोर में देखा गया है। भूगर्भीय समय के पैमाने पर, मिलनकोविच चक्र के कारण, जब पृथ्वी की कक्षा के खगोलीय पैरामीटर और इसके घूर्णन अक्ष उत्तरोत्तर बदलते हैं और पृथ्वी की सतह पर सौर विकिरण को संशोधित करते हैं, तो तापमान बढ़ना शुरू हो जाता है। जब हिमस्खलन की अवधि शुरू की जाती है, तो महासागरों का उत्तरोत्तर तापन CO2 को वायुमंडल में छोड़ता है क्योंकि गर्म समुद्र के पानी में इसकी घुलनशीलता कम होती है। बदले में, CO2 का उच्च स्तर ग्रीनहाउस प्रभाव में वृद्धि करता है और कार्बन डाइऑक्साइड सामान्य वार्मिंग के प्रवर्धक के रूप में कार्य करता है।
ध्रुवीयता
विलेयता की भविष्यवाणी करने के लिए इस्तेमाल किया जाने वाला एक लोकप्रिय सूक्ति समान घुलने वाली है, जिसे लैटिन भाषा में सिमिलिया सिमिलिबस सॉल्वेंटर के रूप में भी व्यक्त किया गया है।[18] यह कथन इंगित करता है कि मिश्रण के अनुकूल एन्ट्रापी के आधार पर, एक विलेय एक विलायक में सबसे अच्छी तरह से घुल जाएगा जिसकी रासायनिक संरचना स्वयं के समान है। यह दृष्टिकोण सरल है, लेकिन यह अंगूठे का एक उपयोगी नियम है। एक विलायक की समग्र सॉल्वैंशन क्षमता मुख्य रूप से इसकी रासायनिक ध्रुवीयता पर निर्भर करती है।[lower-alpha 1] उदाहरण के लिए, एक बहुत ध्रुवीय (हाइड्रोफिलिक) विलेय जैसे कि यूरिया अत्यधिक ध्रुवीय पानी में विलेयता है, काफी ध्रुवीय मेथनॉल में कम विलेयता है, और बेंजीन जैसे गैर-ध्रुवीय विलायक में व्यावहारिक रूप से अविलेयता है। इसके विपरीत, एक गैर-ध्रुवीय या lipophilicity विलेय जैसे नेफ़थलीन पानी में अविलेयता है, मेथनॉल में काफी विलेयता है, और गैर-ध्रुवीय बेंजीन में अत्यधिक विलेयता है।[19]
और भी सरल शब्दों में एक साधारण आयनिक यौगिक (सकारात्मक और नकारात्मक आयनों के साथ) जैसे सोडियम क्लोराइड (सामान्य लवण) अत्यधिक रासायनिक ध्रुवीय विलायक (सकारात्मक (δ+) और नकारात्मक (δ-) के कुछ पृथक्करण के साथ आसानी से विलेयता होता है। सहसंयोजक अणु में) जैसे कि पानी, इस प्रकार समुद्र खारा है क्योंकि यह प्रारंभिक भूवैज्ञानिक युगों से विलेय लवणों को जमा करता है।
विलेयताएन्ट्रापी ऑफ मिक्सिंग (ΔS) द्वारा पसंद की जाती है और यह विघटन की तापीय धारिता (ΔH) और हाइड्रोफोबिक प्रभाव पर निर्भर करती है। विघटन की थर्मोडायनामिक मुक्त ऊर्जा (गिब्स ऊर्जा) तापमान पर निर्भर करती है और रिश्ते द्वारा दी जाती है: ΔG = ΔH - TΔS। छोटे ΔG का अर्थ है अधिक विलेयता।
द्रव-द्रव निष्कर्षण की तकनीक का उपयोग करते हुए, रसायनज्ञ अक्सर अभिक्रिया मिश्रण से यौगिकों को अलग करने और शुद्ध करने के लिए विलेयतामें अंतर का फायदा उठाते हैं। यह दवा संश्लेषण से लेकर खर्च किए गए परमाणु ईंधन पुनर्संसाधन तक रसायन विज्ञान के विशाल क्षेत्रों में लागू होता है।
विघटन की दर
विघटन एक तात्कालिक प्रक्रिया नहीं है। विलेयता की दर (किग्रा/सेकेंड में) विलेयता उत्पाद और सामग्री के सतह क्षेत्र से संबंधित है। जिस गति से एक ठोस घुलता है वह अनाकार ठोस और सतह क्षेत्र (क्रिस्टलीय आकार) और बहुरूपता (सामग्री विज्ञान) की उपस्थिति के मामले में इसकी क्रिस्टलीयता या इसकी कमी पर निर्भर हो सकता है। कई व्यावहारिक प्रणालियां इस प्रभाव को दर्शाती हैं, उदाहरण के लिए नियंत्रित दवा वितरण के लिए डिजाइनिंग के तरीके। कुछ मामलों में, विलेयता साम्य स्थापित करने में लंबा समय लग सकता है (घंटों, दिनों, महीनों, या कई वर्षों; विलेय की प्रकृति और अन्य कारकों के आधार पर)।
विघटन की दर को अक्सर नॉयस-व्हिटनी समीकरण या नर्नस्ट और ब्रूनर समीकरण द्वारा व्यक्त किया जा सकता है[20] वह इस प्रकार है:
कहाँ पे:
- = घुलित पदार्थ का द्रव्यमान
- = समय
- = घुलने वाले पदार्थ और विलायक के बीच इंटरफेस का सतह क्षेत्र
- = प्रसार गुणांक
- = घुलने वाले पदार्थ की सतह पर विलायक की सीमा परत की मोटाई
- = सतह पर पदार्थ की द्रव्यमान सांद्रता
- = विलायक के थोक में पदार्थ की द्रव्यमान सांद्रता
प्रसार द्वारा सीमित विघटन के लिए (या बड़े पैमाने पर स्थानांतरण अगर मिश्रण मौजूद है), पदार्थ की विलेयता के बराबर है। जब एक शुद्ध पदार्थ की विघटन दर ठोस के सतह क्षेत्र (जो सामान्यतः विघटन प्रक्रिया के दौरान समय के साथ बदलती है) के लिए सामान्यीकृत होती है, तो इसे किग्रा / मी2 में व्यक्त किया जाता है और "आंतरिक विघटन दर" के रूप में जाना जाता है। आंतरिक विघटन दर को संयुक्त राज्य फार्माकोपिया द्वारा परिभाषित किया गया है।
विभिन्न प्रणालियों के बीच परिमाण के क्रम में विघटन दर भिन्न होती है। सामान्यतः, बहुत कम विघटन दर समानांतर कम विलेयता के समानांतर है, और उच्च विलेयता वाले पदार्थ उच्च विघटन दर प्रदर्शित करते हैं, जैसा कि नॉयस-व्हिटनी समीकरण द्वारा सुझाया गया है।
विलेयता के सिद्धांत
विलेयता उत्पाद
विलेयता स्थिरांक का उपयोग आयनिक यौगिकों के अपेक्षाकृत कम विलेयता के संतृप्त विलयनों का वर्णन करने के लिए किया जाता है (विलेयता साम्य देखें)। विलेयता स्थिरांक साम्य स्थिरांक का एक विशेष मामला है। चूंकि यह साम्यावस्था में आयन सांद्रता का उत्पाद है, इसलिए इसे विलेयता उत्पाद के रूप में भी जाना जाता है। यह घुलनशील लवण और अघुलनशील लवण के आपस में घुलकर प्राप्त आयनों के बीच संतुलन का वर्णन करता है। विलेयता स्थिरांक अवक्षेपण पर भी लागू होता है (यानी उपयोगी), घुलने वाली अभिक्रिया के विपरीत। जैसा कि अन्य साम्य स्थिरांकों के साथ होता है, तापमान विलेयता स्थिरांक के संख्यात्मक मान को प्रभावित कर सकता है। जबकि विलेयता स्थिरांक विलेयता जितना सरल नहीं है, इस स्थिरांक का मान सामान्यतः विलायक में अन्य प्रजातियों की उपस्थिति से स्वतंत्र होता है।
अन्य सिद्धांत
फ्लोरी-हगिंस विलयन सिद्धांत एक सैद्धांतिक मॉडल है जो पॉलिमर की विलेयता का वर्णन करता है। हैनसेन विलेयता पैरामीटर और हिल्डेब्रांड विलेयता पैरामीटर विलेयता की भविष्यवाणी के लिए अनुभवजन्य तरीके हैं। अन्य भौतिक स्थिरांकों जैसे संलयन की तापीय धारिता से विलेयता का अनुमान लगाना भी संभव है।
ऑक्टेनॉल-जल विभाजन गुणांक, जिसे सामान्यतः इसके लघुगणक (लॉग पी) के रूप में व्यक्त किया जाता है, एक जल विरोधी सॉल्वेंट (1-ऑक्टेनॉल) और एक हाइड्रोफाइल सॉल्वेंट (पानी) में एक यौगिक की अंतर विलेयता का एक उपाय है। इन दो मूल्यों का लघुगणक हाइड्रोफिलिसिटी (या हाइड्रोफोबिसिटी) के संदर्भ में यौगिकों को रैंक करने में सक्षम बनाता है।
घुलने से जुड़ा ऊर्जा परिवर्तन सामान्यतः विलेय के प्रति मोल को विलयन की एन्थैल्पी के रूप में दिया जाता है।
अनुप्रयोग
अयस्क प्रसंस्करण और परमाणु पुनर्संसाधन से लेकर दवाओं के उपयोग और प्रदूषकों के परिवहन तक बड़ी संख्या में वैज्ञानिक विषयों और व्यावहारिक अनुप्रयोगों में विलेयता का मौलिक महत्व है।
विलेयता को अक्सर किसी पदार्थ के विशिष्ट गुणों में से एक कहा जाता है, जिसका अर्थ है कि विलेयता का उपयोग सामान्यतः पदार्थ का वर्णन करने के लिए, किसी पदार्थ की ध्रुवीयता को इंगित करने के लिए, इसे अन्य पदार्थों से अलग करने में मदद करने के लिए, और पदार्थ के अनुप्रयोगों के लिए एक गाइड के रूप मेंकिया जाता है। उदाहरण के लिए, इंडिगो को "पानी, शराब, या ईथर में अघुलनशील लेकिन क्लोरोफॉर्म, नाइट्रोबेंजीन, या सल्फ्यूरिक एसिड में घुलनशील" के रूप में वर्णित किया गया है।[citation needed]
मिश्रण को अलग करते समय किसी पदार्थ की विलेयता उपयोगी होती है। उदाहरण के लिए, लवण (सोडियम क्लोराइड) और सिलिका के मिश्रण को लवण को पानी में घोलकर और बिना घुले सिलिका को छानकर अलग किया जा सकता है। रासायनिक यौगिकों का संश्लेषण, एक प्रयोगशाला में मिलीग्राम द्वारा, या उद्योग में टन द्वारा, दोनों वांछित उत्पाद की सापेक्ष विलेयताओं का उपयोग करते हैं, साथ ही अलग-अलग प्रारंभिक सामग्री, उप-उत्पादों और साइड उत्पादों को अलग करने के लिए उपयोग करते हैं। जिसका अर्थ है कि घुलनशीलता का उपयोग आमतौर पर पदार्थ का वर्णन करने के लिए किया जाता है, पदार्थ की ध्रुवीयता को इंगित करने के लिए, इसे अन्य पदार्थों से अलग करने में मदद करने के लिए और पदार्थ के अनुप्रयोगों के लिए एक गाइड के रूप में उपयोग किया जाता है।
इसका एक और उदाहरण फेनिलमैग्नीशियम ब्रोमाइड और सूखी बर्फ से बेंज़ोइक अम्ल का संश्लेषण है। बेंजोइक एसिड एक कार्बनिक विलायक जैसे डाइक्लोरोमेथेन या डाईइथाइल इथर में अधिक विलेय होता है, और जब इस कार्बनिक विलायक के साथ एक अलग फ़नल में हिलाया जाता है, तो यह कार्बनिक परत में अधिमानतः विलेय हो जाएगा। मैग्नीशियम ब्रोमाइड सहित अन्य अभिक्रिया उत्पाद, जलीय परत में बने रहेंगे, जो स्पष्ट रूप से दिखाते हैं कि विलेयता के आधार पर पृथक्करण हासिल किया गया है। द्रव-द्रव निष्कर्षण के रूप में जानी जाने वाली यह प्रक्रिया सिंथेटिक रसायन विज्ञान में एक महत्वपूर्ण तकनीक है। अधिकतम निष्कर्षण सुनिश्चित करने के लिए पुनर्चक्रण का उपयोग किया जाता है।
विभेदक विलेयता
बहने वाली प्रणालियों में, घुलनशीलता में अंतर अक्सर प्रजातियों के विघटन-अवक्षेपण संचालित परिवहन को निर्धारित करता है। ऐसा तब होता है जब सिस्टम के अलग-अलग हिस्से अलग-अलग स्थितियों का अनुभव करते हैं। पर्याप्त समय दिए जाने पर थोड़ी भिन्न स्थितियों के भी महत्वपूर्ण प्रभाव हो सकते हैं।
उदाहरण के लिए, अपेक्षाकृत कम विलेयता वाले यौगिक अधिक चरम वातावरण में विलेय होते हैं, जिसके परिणामस्वरूप पृथ्वी की पपड़ी में हाइड्रोथर्मल द्रव पदार्थों की गतिविधि के भू-रासायनिक और भूवैज्ञानिक प्रभाव होते हैं। ये अक्सर उच्च गुणवत्ता वाले आर्थिक खनिज भंडार और कीमती या अर्ध-कीमती रत्नों के स्रोत होते हैं। उसी तरह, कम विलेयता वाले यौगिक विस्तारित समय (भूवैज्ञानिक समय) में घुल जाएंगे, जिसके परिणामस्वरूप व्यापक गुफा प्रणाली या कार्स्टिक भूमि की सतह जैसे महत्वपूर्ण प्रभाव होंगे।
पानी में आयनिक यौगिकों की विलेयता
कुछ आयनिक यौगिक (लवण) पानी में घुल जाते हैं, जो धनात्मक और ऋणात्मक आवेशों के बीच आकर्षण के कारण उत्पन्न होते हैं (देखें: सॉल्वेशन)। उदाहरण के लिए, लवण के धनात्मक आयन (उदा. Ag+) H2O में आंशिक रूप से ऋणायन ऑक्सीजन परमाणु को आकर्षित करता है। इसी तरह, लवण ऋणायन (Cl में−) आंशिक रूप से धनात्मक हाइड्रोजन को आकर्षित करते हैं H2O. नोट: ऑक्सीजन परमाणु आंशिक रूप से ऋणायन है क्योंकि यह हाइड्रोजन की तुलना में अधिक वैद्युतीयऋणात्मक है, और इसके विपरीत (देखें: रासायनिक ध्रुवीयता)।
- AgCl(s) ⇌ Ag+(aq) + Cl−(aq)
हालाँकि, पानी की दी गई मात्रा में कितना लवण घोला जा सकता है, इसकी एक सीमा है। यह सांद्रता विलेयता है और और घुलनशीलता उत्पाद, Ksp से संबंधित है। यह साम्य स्थिरांक लवण के प्रकार पर निर्भर करता है (उदाहरण के लिए AgCl बनाम NaCl), तापमान और सम आयन प्रभाव।
की राशि की गणना कर सकते हैं AgCl जो 1 लीटर शुद्ध पानी में इस प्रकार घुलेगा:
1 लीटर शुद्ध पानी में घुलने वाले AgCl की मात्रा की गणना निम्नानुसार की जा सकती है:
Ksp = [Ag+] × [Cl−] / M2 (विलेयतागुणनफल की परिभाषा; M = mol/L) Ksp = 1.8 × 10−10 (विलेयताउत्पादों की तालिका से)
[Ag+] = [Cl−], चांदी या क्लोराइड लवणों की अनुपस्थिति में, इसलिए
- [Ag+]2 = 1.8 × 10−10 M2
- [Ag+] = 1.34 × 10−5 mol/L
परिणाम: कमरे के तापमान पर 1 लीटर पानी 1.34 × 10−5 मोल AgCl को घोल सकता है। अन्य लवणों की तुलना में, AgCl पानी में आंशिक विलेय है। उदाहरण के लिए, टेबल लवण (NaCl) का Ksp = 36 जोकी बहुत अधिक है औरऔर इसलिए इसकी विलेयता भी बहुत अधिक है। निम्न तालिका विभिन्न आयनिक यौगिकों के लिए विलेयता नियमों का अवलोकन करती है।
| Soluble | Insoluble[21] |
|---|---|
| Group I and NH4+ compounds (except lithium phosphate) | Carbonates (except Group I, NH4+ and uranyl compounds) |
| Nitrates | Sulfites (except Group I and NH4+ compounds) |
| Acetates (ethanoates) (except Ag+ compounds) | Phosphates (except Group I and NH4+ compounds (excluding Li+)) |
| Chlorides (chlorates and perchlorates), bromides and iodides (except Ag+, Pb2+, Cu+ and Hg22+) | Hydroxides and oxides (except Group I, NH4+, Ba2+, Sr2+ and Tl+) |
| Sulfates (except Ag+, Pb2+, Ba2+, Sr2+ and Ca2+) | Sulfides (except Group I, Group II and NH4+ compounds) |
कार्बनिक यौगिकों की विलेयता
- ध्रुवीयता के तहत ऊपर उल्लिखित सिद्धांत, लाइक डिसॉल्व लाइक, जैविक प्रणालियों के साथ घुलनशीलता का सामान्य मार्गदर्शक है। उदाहरण के लिए, पेट्रोलियम जेली गैसोलीन में घुल जाएगी क्योंकि पेट्रोलियम जेली और गैसोलीन दोनों गैर-ध्रुवीय हाइड्रोकार्बन हैं। दूसरी ओर, यह एथिल एल्कोहल या पानी में नहीं घुलेगा, क्योंकि इन विलायक की ध्रुवीयता बहुत अधिक है। चीनी गैसोलीन में नहीं घुलेगी, क्योंकि चीनी गैसोलीन की तुलना में बहुत अधिक ध्रुवीय है। इसलिए गैसोलीन और चीनी के मिश्रण को पानी से छानकर या विलायक निष्कर्षण द्वारा अलग किया जा सकता है।
ठोस विलयन
इस शब्द का प्रयोग अक्सर धातु विज्ञान के क्षेत्र में किया जाता है ताकि एक मिश्रधातु तत्व एक अलग अवस्था बनाए बिना आधार धातु में विलेय हो जाए। इस शब्द का प्रयोग अक्सर धातु विज्ञान के क्षेत्र में किया जाता है ताकि एक अलग अवस्था के गठन के बिना मिश्र धातु तत्व में विलेय हो जाए। अपराध या विलेयता रेखा (या वक्र) एक अवस्था आरेख पर रेखा (या रेखाएँ) होती है जो विलेय योग की सीमाएँ देती है। अर्थात्, रेखाएँ किसी घटक की अधिकतम मात्रा दर्शाती हैं जिसे किसी अन्य घटक में जोड़ा जा सकता है और फिर भी ठोस विलयन में हो सकता है। ठोस की क्रिस्टलीय संरचना में, 'विलेय' तत्व या तो जाली के भीतर मैट्रिक्स का स्थान ले सकता है (एक प्रतिस्थापन स्थिति; उदाहरण के लिए, लोहे में क्रोमियम) या जाली बिंदुओं (एक अंतरालीय स्थिति; उदाहरण के लिए, लोहे में कार्बन)। This term is often used in the field of metallurgy to refer to the extent that an alloying element will dissolve into the base metal without forming a separate phase. The solvus or solubility line (or curve) is the line (or lines) on a phase diagram that give the limits of solute addition. That is, the lines show the maximum amount of a component that can be added to another component and still be in solid solution. In the solid's crystalline structure, the 'solute' element can either take the place of the matrix within the lattice (a substitutional position; for example, chromium in iron) or take a place in a space between the lattice points (an interstitial position; for example, carbon in iron).अर्थात्, रेखाएँ किसी घटक की अधिकतम मात्रा दर्शाती हैं जिसे किसी अन्य घटक में जोड़ा जा सकता है और फिर भी ठोस समाधान में हो सकता है
माइक्रोइलेक्ट्रॉनिक फैब्रिकेशन में, ठोस विलेयताअशुद्धियों की अधिकतम सांद्रता को संदर्भित करती है जिसे सब्सट्रेट में रखा जा सकता है।
ठोस यौगिकों में (तत्वों के विपरीत), विलेय तत्व की विलेयता साम्य में अलग होने वाले अवस्थाों पर भी निर्भर कर सकती है। उदाहरण के लिए, ZnSb अवस्था में विलेयता Sn की मात्रा काफी हद तक इस बात पर निर्भर कर सकती है कि क्या साम्य में अलग होने वाले अवस्था हैं (Zn4एसबी3+Sn(L)) या (ZnSnSb2+ आयु (एल))[22]. इनके अलावा, एक विलेय के रूप में Sn के साथ ZnSb यौगिक संश्लेषण के दौरान प्रारंभिक रासायनिक संरचना के आधार पर विलेयतासीमा तक पहुंचने के बाद अवस्थाों के अन्य संयोजनों में अलग हो सकता है। प्रत्येक संयोजन ZnSb में Sn की भिन्न विलेयता उत्पन्न करता है। इसलिए यौगिकों में विलेयता अध्ययन, द्वितीयक अवस्थाों को अलग करने के पहले उदाहरण पर निष्कर्ष निकाला गया है जो विलेयता को कम कर सकता है।[23] जबकि साम्य में एक बार में अलग होने वाले अवस्थाों की अधिकतम संख्या गिब के अवस्था नियम द्वारा निर्धारित की जा सकती है, रासायनिक यौगिकों के लिए इस तरह के अवस्था अलग करने वाले संयोजनों की संख्या पर कोई सीमा नहीं है। इसलिए, प्रयोगात्मक रूप से ठोस यौगिकों में अधिकतम विलेयतास्थापित करना कठिन हो सकता है, जिसके लिए कई नमूनों के साम्य की आवश्यकता होती है। यदि ठोस-घोल में शामिल प्रमुख क्रिस्टलोग्राफिक दोष (ज्यादातर अंतरालीय या प्रतिस्थापन बिंदु दोष) को रासायनिक रूप से पहले ही समझा जा सकता है, तो कुछ सरल थर्मोडायनामिक दिशानिर्देशों का उपयोग करके अधिकतम विलेयतास्थापित करने के लिए आवश्यक नमूनों की संख्या को काफी कम किया जा सकता है। [24]
असंगत विघटन
कई पदार्थ सर्वांगसम रूप से घुलते हैं (अर्थात ठोस और घुले हुए विलेय की संरचना स्टोइकोमेट्रिक रूप से मेल खाती है)। हालांकि, कुछ पदार्थ असंगत संक्रमण को विलेय कर सकते हैं, जिससे विलयन में विलेय की संरचना ठोस से मेल नहीं खाती। यह विलेयकरण प्राथमिक ठोस के परिवर्तन और संभवतः एक द्वितीयक ठोस अवस्था के गठन के साथ है। हालाँकि, सामान्य तौर पर, कुछ प्राथमिक ठोस भी बने रहते हैं और एक जटिल विलेयतासाम्य स्थापित होता है। उदाहरण के लिए, ऐल्बाइट के विघटन से gibbsite का निर्माण हो सकता है।[25]
- NaAlSi3O8(s) + H+ + 7H2O ⇌ Na+ + Al(OH)3(s) + 3H4SiO4.
इस मामले में, एल्बाइट की विलेयताठोस-से-विलायक अनुपात पर निर्भर होने की उम्मीद है। भूविज्ञान में इस प्रकार की विलेयताका बहुत महत्व है, जहाँ इसके परिणामस्वरूप रूपांतरित चट्टानों का निर्माण होता है।
सिद्धांत रूप में, सर्वांगसम और असंगत दोनों प्रकार के विघटन से साम्य में द्वितीयक ठोस अवस्थाों का निर्माण हो सकता है। तो, सामग्री विज्ञान के क्षेत्र में, दोनों मामलों के लिए विलेयतारासायनिक संरचना अवस्था आरेखों पर अधिक सामान्य रूप से वर्णित है।
विलेयता भविष्यवाणी
विलेयता विज्ञान के कई पहलुओं में रुचि की संपत्ति है, जिसमें शामिल हैं लेकिन इन तक सीमित नहीं है: पर्यावरणीय भविष्यवाणियां, जैव रसायन, फार्मेसी, ड्रग-डिज़ाइन, एग्रोकेमिकल डिज़ाइन और प्रोटीन लिगैंड बाइंडिंग। पानी द्वारा निभाए जाने वाले महत्वपूर्ण जैविक और परिवहन कार्यों के कारण जलीय विलेयतामौलिक रुचि है।[26][27][28] इसके अलावा, पानी की विलेयताऔर विलायक प्रभाव में इस स्पष्ट वैज्ञानिक रुचि के अलावा; विलेयता की सटीक भविष्यवाणियां औद्योगिक रूप से महत्वपूर्ण हैं। एक अणु की विलेयता की सटीक भविष्यवाणी करने की क्षमता फार्मास्यूटिकल्स जैसे कई रासायनिक उत्पाद विकास प्रक्रियाओं में संभावित रूप से बड़ी वित्तीय बचत का प्रतिनिधित्व करती है।[29] फार्मास्युटिकल उद्योग में, विलेयता की भविष्यवाणी ड्रग उम्मीदवारों की प्रारंभिक अवस्था लीड अनुकूलन प्रक्रिया का हिस्सा बनती है। विलेयतासूत्रीकरण के लिए सभी तरह से एक चिंता का विषय बनी हुई है।[29]मात्रात्मक संरचना-गतिविधि संबंध (QSAR), मात्रात्मक संरचना-संपत्ति संबंध (QSPR) और डेटा माइनिंग सहित ऐसी भविष्यवाणियों के लिए कई तरीके लागू किए गए हैं। ये मॉडल विलेयता की कुशल भविष्यवाणियां प्रदान करते हैं और वर्तमान मानक का प्रतिनिधित्व करते हैं। ऐसे मॉडल का ड्रॉ बैक यह है कि उनमें भौतिक अंतर्दृष्टि की कमी हो सकती है। भौतिक सिद्धांत में स्थापित एक विधि, एक समझदार लागत पर सटीकता के समान स्तर प्राप्त करने में सक्षम, वैज्ञानिक और औद्योगिक रूप से एक शक्तिशाली उपकरण होगा।[30][31]Cite error: Closing </ref> missing for <ref> tag
भौतिक सिद्धांत में स्थापित विधियों में थर्मोडायनामिक चक्रों का उपयोग होता है, जो शास्त्रीय थर्मोडायनामिक्स की एक अवधारणा है। उपयोग किए जाने वाले दो सामान्य थर्मोडायनामिक चक्रों में या तो उर्ध्वपातन (अवस्था संक्रमण) (द्रव अवस्था से गुजरे बिना गैस से ठोस) की मुक्त ऊर्जा की गणना और गैसीय अणु (गैस से विलयन) को सॉल्वेट करने की मुक्त ऊर्जा या एन्थैल्पी शामिल है। संलयन (एक पिघला हुआ अवस्था के लिए ठोस) और मिश्रण की मुक्त ऊर्जा (पिघला हुआ विलयन)। इन दो प्रक्रियाओं को निम्नलिखित आरेखों में दर्शाया गया है।
इन चक्रों का उपयोग शारीरिक रूप से प्रेरित विलायक मॉडल का उपयोग करके पहले सिद्धांतों की भविष्यवाणियों (मौलिक भौतिक समीकरणों का उपयोग करके हल करना) के प्रयासों के लिए किया गया है।[31]पैरामीट्रिक समीकरण और QSPR मॉडल बनाने के लिए[32][33]और दोनों का संयोजन।[33]इन चक्रों का उपयोग अप्रत्यक्ष रूप से या तो गैस (उच्च बनाने की क्रिया चक्र में) या एक पिघल (संलयन चक्र) के माध्यम से सॉल्वैंशन मुक्त ऊर्जा की गणना करने में सक्षम बनाता है। यह मददगार है क्योंकि सॉल्वैंशन की मुक्त ऊर्जा की सीधे गणना करना अत्यंत कठिन है। सॉल्वैंशन की मुक्त ऊर्जा को विभिन्न सूत्रों का उपयोग करके विलेयतामान में परिवर्तित किया जा सकता है, सबसे सामान्य मामला नीचे दिखाया जा रहा है, जहां अंश सॉल्वैंशन की मुक्त ऊर्जा है, R गैस स्थिरांक है और T केल्विन में तापमान है।[31]
विलेयता की भविष्यवाणी के लिए जाने-माने समीकरण सामान्य विलेयतासमीकरण हैं। ये समीकरण यालकोवस्की एट अल के काम से उपजा है।[34][35] मूल सूत्र पहले दिया गया है, उसके बाद एक संशोधित सूत्र दिया गया है जो ऑक्टेनॉल में पूर्ण मिश्रणीयता की एक अलग धारणा लेता है।[35]
ये समीकरण संलयन चक्र के सिद्धांतों पर आधारित हैं।
यह भी देखें
- Apparent molar property
- Biopharmaceutics Classification System
- Dühring's rule
- Fajans–Paneth–Hahn Law
- Flexible SPC water model
- Henry's law
- Hot water extraction
- Hydrotrope
- Micellar solubilization
- Raoult's law
- Rate of solution
- Solubility equilibrium
- van 't Hoff equation
टिप्पणियाँ
- ↑ The solvent polarity is defined as its solvation power according to Reichardt.
संदर्भ
- ↑ 1.0 1.1 IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "Solubility". doi:10.1351/goldbook.S05740
- ↑ 2.0 2.1 Clugston, M.; Fleming, R. (2000). उन्नत रसायन विज्ञान (1st ed.). Oxford: Oxford Publishing. p. 108.
- ↑ J. de Swaan Arons and G. A. M. Diepen (1966): "Gas—Gas Equilibria". Journal of Chemical Physics, volume 44, issue 6, page 2322. doi:10.1063/1.1727043
- ↑ Tomlinson, Charles (1868-01-01). "सुपरसैचुरेटेड सेलाइन सॉल्यूशंस पर". Philosophical Transactions of the Royal Society of London. 158: 659–673. doi:10.1098/rstl.1868.0028. ISSN 0261-0523. S2CID 110079029.
- ↑ Claudius Kormann, Detlef W. Bahnemann, and Michael R. Hoffmann (1988): "Preparation and characterization of quantum-size titanium dioxide". Journal of Physical Chemistry,volume 92, issue 18, pages 5196–5201. doi:10.1021/j100329a027
- ↑ Abler (2021): "W/W (Weight/Weight)". Online page at Abler.com website. Accessed on 2021-11-26.
- ↑ I. Lee and J. Lee (2012): "Measurement of mixing ratio and volume change of ethanol-water binary mixtures using suspended microchannel resonators." SENSORS, volume 2012, pages 1-3. doi:10.1109/ICSENS.2012.6411272.
- ↑ "Pharmacopeia of the United States of America, 32nd revision, and the National Formulary, 27th edition," 2009, pp.1 to 12.
- ↑ I.Y. Nekrasov (1996). जियोकेमिस्ट्री, मिनरलॉजी एंड जेनेसिस ऑफ गोल्ड डिपॉजिट. Taylor & Francis. pp. 135–136. ISBN 978-90-5410-723-1.
- ↑ Hefter, G.T.; Tomkins, R.P.T (Editors) (2003). घुलनशीलता का प्रायोगिक निर्धारण. Wiley-Blackwell. ISBN 978-0-471-49708-0.
{{cite book}}:|first2=has generic name (help) - ↑ 11.0 11.1 John W. Hill, Ralph H. Petrucci, General Chemistry, 2nd edition, Prentice Hall, 1999.
- ↑ P. Cohen, ed. (1989). थर्मल पावर सिस्टम्स के लिए जल प्रौद्योगिकी पर ASME हैंडबुक. The American Society of Mechanical Engineers. p. 442.
- ↑ रसायन और भौतिकी पुस्तिका (27th ed.). Cleveland, Ohio: Chemical Rubber Publishing Co. 1943.
- ↑ "सेरियम सल्फेट जैसे किन पदार्थों को गर्म करने पर उनकी विलेयता कम होती है?". Scientific American. Retrieved 28 May 2014.
- ↑ Salvatore Filippone, Frank Heimanna and André Rassat (2002). "एक अत्यधिक पानी में घुलनशील 2+1 बी-साइक्लोडेक्सट्रिन-फुलरीन संयुग्म". Chem. Commun. 2002 (14): 1508–1509. doi:10.1039/b202410a. PMID 12189867.
- ↑ E.M. Gutman (1994). ठोस सतहों की मेकेनोकेमिस्ट्री. World Scientific Publishing Co.
- ↑ G.W. Greenwood (1969). "गैस के बुलबुले की घुलनशीलता". Journal of Materials Science. 4 (4): 320–322. Bibcode:1969JMatS...4..320G. doi:10.1007/BF00550401. S2CID 93098036.
- ↑ Kenneth J. Williamson (1994). मैक्रोस्केल और माइक्रोस्केल ऑर्गेनिक प्रयोग (2nd ed.). Lexington, Massachusetts: D. C, Heath. p. 40. ISBN 978-0-669-19429-6.
- ↑ मर्क इंडेक्स (7th ed.). Merck & Co. 1960.
- ↑ Dokoumetzidis, Aristides; Macheras, Panos (2006). "विघटन अनुसंधान की एक सदी: नॉयस और व्हिटनी से बायोफार्मास्यूटिक्स वर्गीकरण प्रणाली तक". Int. J. Pharm. 321 (1–2): 1–11. doi:10.1016/j.ijpharm.2006.07.011. PMID 16920290.
- ↑ C. Houk; R. Post, eds. (1997). Chemistry, Concept and Problems. John Wiley & Sons. p. 121. ISBN 978-0-471-12120-6.
- ↑ Wood, Maxwell; Toriyama, Michael; Dugar, Shristi; Male, James; Anand, Shashwat; Stevanović, Vladan; Snyder, Jeff (2020). "टिन-डोप्ड ZnSb की फेज बाउंड्री मैपिंग से उच्च थर्मोइलेक्ट्रिक दक्षता के लिए थर्मोडायनामिक रूट का पता चलता है". Advanced Energy Materials. 11 (20). doi:10.1002/aenm.202100181. S2CID 234807088.
- ↑ Tang, Yinglu; Hanus, Riley; Chen, Sin-wen; Snyder, Jeff (2015). "घुलनशीलता डिजाइन कम लागत वाले सीई-सीओएसबी3 स्कटरडाइट्स में योग्यता के उच्च आंकड़े की ओर ले जाता है।". Nature Communications. 6 (7584): 7584. Bibcode:2015NatCo...6.7584T. doi:10.1038/ncomms8584. PMC 4518255. PMID 26189943.
- ↑ Anand, Shashwat; Wolverton, Chris; Snyder, Jeff (2022). "अधिकतम घुलनशीलता के लिए थर्मोडायनामिक दिशानिर्देश". Chemistry of Materials. 34 (4): 1638–1648. doi:10.1021/acs.chemmater.1c03715. S2CID 246516386.
- ↑ O.M. Saether; P. de Caritat, eds. (1997). जलग्रहण क्षेत्रों में भू-रासायनिक प्रक्रियाएं, अपक्षय और भूजल पुनर्भरण. Rotterdam: Taylor & Francis. p. 6. ISBN 978-90-5410-641-8.
- ↑ Skyner, R.; McDonagh, J. L.; Groom, C. R.; van Mourik, T.; Mitchell, J. B. O. (2015). "समाधान मुक्त ऊर्जा की गणना के लिए तरीकों की समीक्षा और समाधान में सिस्टम की मॉडलिंग" (PDF). Phys Chem Chem Phys. 17 (9): 6174–91. Bibcode:2015PCCP...17.6174S. doi:10.1039/C5CP00288E. PMID 25660403.
- ↑ Tomasi, J.; Mennucci, B.; Cammi, R. (2005). "क्वांटम मैकेनिकल कॉन्टिनम सॉल्वेशन मॉडल". Chemical Reviews. 105 (8): 2999–3093. doi:10.1021/cr9904009. PMID 16092826.
- ↑ Cramer, C. J.; Truhlar, D. G. (1999). "अंतर्निहित सॉल्वेशन मॉडल: संतुलन, संरचना, स्पेक्ट्रा और गतिशीलता". Chemical Reviews. 99 (8): 2161–2200. doi:10.1021/cr960149m. PMID 11849023.
- ↑ 29.0 29.1 Abramov, Y. A. (2015). "QSPR में त्रुटि का प्रमुख स्रोत दवाओं की आंतरिक थर्मोडायनामिक घुलनशीलता की भविष्यवाणी: ठोस बनाम गैर-ठोस राज्य योगदान?". Molecular Pharmaceutics. 12 (6): 2126–2141. doi:10.1021/acs.molpharmaceut.5b00119. PMID 25880026.
- ↑ McDonagh, J. L. (2015). ऑर्गेनिक ड्रग-लाइक मॉलिक्यूल्स की जलीय घुलनशीलता की गणना करना और हाइड्रोफोबिसिटी को समझना (Thesis). University of St Andrews. hdl:10023/6534.
- ↑ 31.0 31.1 31.2 Palmer, D. S.; McDonagh, J. L.; Mitchell, J. B. O.; van Mourik, T.; Fedorov, M. V. (2012). "प्रथम-सिद्धांत क्रिस्टलीय ड्रगलाइक अणुओं की आंतरिक जलीय विलेयता की गणना". Journal of Chemical Theory and Computation. 8 (9): 3322–3337. doi:10.1021/ct300345m. hdl:10023/25470. PMID 26605739.
- ↑ Ran, Y.; N. Jain; S.H. Yalkowsky (2001). "सामान्य घुलनशीलता समीकरण (GSE) द्वारा कार्बनिक यौगिकों की जलीय घुलनशीलता की भविष्यवाणी". Journal of Chemical Information and Modeling. 41 (5): 1208–1217. doi:10.1021/ci010287z. PMID 11604020.
- ↑ 33.0 33.1 Cite error: Invalid
<ref>tag; no text was provided for refs namedMcDonagh_et_al - ↑ Yalkowsky, S.H.; Valvani, S.C. (1980). "घुलनशीलता और विभाजन I: पानी में गैर-इलेक्ट्रोलाइट्स की घुलनशीलता". Journal of Pharmaceutical Sciences. 69 (8): 912–922. doi:10.1002/jps.2600690814. PMID 7400936.
- ↑ 35.0 35.1 Jain, N.; Yalkowsky, S.H. (2001). "जलीय घुलनशीलता I का अनुमान: कार्बनिक गैर-इलेक्ट्रोलाइट्स के लिए आवेदन". Journal of Pharmaceutical Sciences. 90 (2): 234–252. doi:10.1002/1520-6017(200102)90:2<234::aid-jps14>3.0.co;2-v. PMID 11169540.
इस पेज में लापता आंतरिक लिंक की सूची
- दाढ़ एकाग्रता
- घुला हुआ पदार्थ
- एकाग्रता
- मिश्रणशीलता
- एन्ट्रापी
- अतिसंतृप्ति
- जीवविज्ञान
- औशेयनोग्रफ़ी
- आसन्न
- भौतिक विज्ञान
- दवा
- भूगर्भ शास्त्र
- खाना बनाना
- मोल (इकाई)
- मिलीलीटर
- मोलिटी
- मोलरता
- मोल - अंश
- टाइट्रेट करना
- समन्वय जटिल
- हदबंदी (रसायन विज्ञान)
- विलेयशील
- अवस्था (मामला)
- आम-आयन प्रभाव
- लिगेंड
- ईओण का शक्ति
- अंतराण्विक बल
- निरंतर साम्य
- पारद्युतिक स्थिरांक
- क्रांतिक तापमान
- शानदार
- क्रिस्टलीकरण का पानी
- पुनर्संरचना (रसायन विज्ञान)
- आंशिक दाढ़ मात्रा
- सार्वभौमिक गैस स्थिरांक
- द्रव बुलबुला
- बन्सन विलेयतागुणांक
- भूवैज्ञानिक समय
- कहावत
- मिश्रण की एन्ट्रापी
- परमाणु ईंधन खर्च किया
- बेढब
- दूरी बदलना
- विलेयता स्थिरांक
- विलेयताउत्पाद
- लोगारित्म
- विलयन की एन्थैल्पी
- जुदा करने वाली कीप
- छानने का काम
- ठोस उपाय
- धातुकर्म
- पदार्थ विज्ञान
- उच्च बनाने की क्रिया (अवस्था संक्रमण)