कैल्शियम हाइपोक्लोराइड
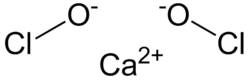
| |
| Names | |
|---|---|
| Other names
Hypochlorous acid calcium salt, bleaching powder, chloride of lime
| |
| Identifiers | |
3D model (JSmol)
|
|
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| EC Number |
|
| KEGG | |
PubChem CID
|
|
| RTECS number |
|
| UNII | |
| UN number | 1748 2208 |
| Properties | |
| Ca(ClO)2 | |
| Molar mass | 142.98 g/mol |
| Appearance | white/gray powder |
| Density | 2.35 g/cm3 (20 °C) |
| Melting point | 100 °C (212 °F; 373 K) |
| Boiling point | 175 °C (347 °F; 448 K) decomposes |
| 21 g/100 mL at 25 °C | |
| Solubility | reacts in alcohol |
| Hazards | |
| GHS labelling: | |
   
| |
| Danger | |
| H272, H302, H314, H400 | |
| P210, P220, P221, P260, P264, P270, P273, P280, P301+P312, P301+P330+P331, P303+P361+P353, P304+P340, P305+P351+P338, P310, P321, P330, P363, P370+P378, P391, P405, P501 | |
| NFPA 704 (fire diamond) | |
| Flash point | Non-flammable |
| Lethal dose or concentration (LD, LC): | |
LD50 (median dose)
|
850 mg/kg (oral, rat) |
| Safety data sheet (SDS) | ICSC 0638 |
| Related compounds | |
Other anions
|
Calcium chloride |
Other cations
|
Sodium hypochlorite |
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
| |
कैल्शियम हाइपोक्लोराइट ऐसा अकार्बनिक यौगिक है, जिसका रासायनिक सूत्र Ca(ClO)2 है। यह सफेद रंग का ठोस पदार्थ है, चूंकि व्यावसायिक प्रमाण पीले रंग के दिखाई देते हैं। इस प्रकार नम हवा में इसकी धीमी रासायनिक अपघटन के कारण इसमें क्लोरीन की तेज गंध आती है। यह यौगिक ठोस और समीकरण के रूप में अपेक्षाकृत स्थिर होता है, और इसमें सोडियम हाइपोक्लोराइट की तुलना में अधिक क्लोरीन उपलब्ध कराता है।[1] इस प्रकार शुद्ध प्रमाणों में 99.2% सक्रिय क्लोरीन होता है। सामान्य औद्योगिक शुद्धता को देखते हुए, 65-70% की सक्रिय क्लोरीन सामग्री विशिष्ट है।[2] यह ब्लीचिंग पाउडर नामक व्यावसायिक उत्पादों का मुख्य सक्रिय संघटक है,[lower-alpha 1] जल उपचार के लिए और विरंजन अभिकर्मक के रूप में उपयोग किया जाता है।[3]
इतिहास
चार्ल्स टेनेंट और चार्ल्स मैकिंटोश ने 18वीं शताब्दी के अंत में चूने के क्लोराइड के निर्माण के लिए औद्योगिक प्रक्रिया विकसित की गई हैं।[4] यह 1799 में पेटेंट कराया गया था और प्रथम विश्व युद्ध के समय खाइयों और घावों को कीटाणुरहित करने के लिए इसका भारी उपयोग किया गया था।
उपयोग
स्वच्छता
कैल्शियम हाइपोक्लोराइट सामान्यतः स्विमिंग पूल स्वच्छता और जल उपचार के लिए प्रयोग किया जाता है। सामान्यतः वाणिज्यिक पदार्थ 65% से 73% की शुद्धता के साथ अन्य रसायनों जैसे कैल्शियम क्लोराइड और कैल्शियम कार्बोनेट के साथ बेचे जाते हैं, जो निर्माण प्रक्रिया से उत्पन्न होते हैं। इस समीकरण को हल करने पर कैल्शियम हाइपोक्लोराइट का उपयोग सामान्य उद्देश्य वाले सैनिटाइज़र के रूप में किया जा सकता है,[5] अपितु कैल्शियम अवशेष (कठोर पानी बनाने) के कारण सामान्यतः सोडियम हाइपोक्लोराइट (ब्लीच) को प्राथमिकता दी जाती है।
कार्बनिक रसायन
कैल्शियम हाइपोक्लोराइट सामान्य ऑक्सीकरण अभिकर्मक है, और इसलिए कार्बनिक रसायन विज्ञान में इसका कुछ उपयोग होता है।[6] उदाहरण के लिए, यौगिक का उपयोग खंडित एल्डिहाइड या कार्बोज़ाइलिक तेजाब उत्पन्न करने के लिए बंधन दरार डायोल विसिनल डायोलस, अल्फा हाइड्रॉक्सी अम्ल या α-हाइड्रॉक्सी कार्बोक्जिलिक अम्ल और केटो अम्ल के लिए किया जाता है।[7] इस प्रकार कैल्शियम हाइपोक्लोराइट का उपयोग क्लोरोफार्म बनाने के लिए हालोफॉर्म प्रतिक्रिया में भी किया जा सकता है।[8]
कैल्शियम हाइपोक्लोराइट का उपयोग कार्बनिक संश्लेषण में थियोल और सल्फाइड बायप्रोडक्ट्स को ऑक्सीकरण करने के लिए किया जा सकता है और इस प्रकार उनकी गंध को कम किया जा सकता है, और उन्हें निपटाने के लिए सुरक्षित बनाया जा सकता है।[9] इस प्रकार कार्बनिक रसायन विज्ञान में प्रयुक्त अभिकर्मक ~ 70% शुद्धता पर सैनिटाइज़र के समान है।[10]
उत्पादन
कैल्शियम हाइपोक्लोराइट का उत्पादन औद्योगिक रूप से नम बुझे हुए चूने को क्लोरीन के साथ Ca(OH)2 के उपचार से किया जाता है। एक-चरण प्रतिक्रिया नीचे दिखाई गई है:[3]
- 2 Cl2 + 2 Ca(OH)2 → Ca(ClO)2 + CaCl2 + 2 H2O
औद्योगिक सेटअप विभिन्न रचनाओं को देने के लिए चरणों में प्रतिक्रिया करने की अनुमति देते हैं, प्रत्येक कैल्शियम हाइपोक्लोराइट, अपरिवर्तित चूने और कैल्शियम क्लोराइड के विभिन्न अनुपातों का उत्पादन करते हैं।[3] इस प्रक्रिया में क्लोराइड युक्त प्रथम चरण के पानी को छोड़ दिया जाता है, जबकि ठोस अवक्षेप को पानी के मिश्रण में घोल दिया जाता है और इस लक्ष्य की शुद्धता तक पहुँचने के लिए क्लोरीनीकरण के दूसरे चरण के लिए रखा जाता है।[2] इस प्रकार वाणिज्यिक कैल्शियम हाइपोक्लोराइट में निर्जल Ca(ClO)2 होता है, इस प्रकार डिबासिक कैल्शियम हाइपोक्लोराइट Ca3(CaO)2(OH)4 (Ca(ClO)2·2Ca(COH)2) के रूप में भी लिखा जाता है, और डिबासिक कैल्शियम क्लोराइड Ca3Cl2(OH)4 (CaCl2·2Ca(OH)2 के रूप में भी लिखा गया है।[11][12]
प्रतिक्रियाएं
कैल्शियम हाइपोक्लोराइट कैल्शियम क्लोराइड, क्लोरीन गैस और पानी बनाने वाले अम्ल के साथ तेजी से प्रतिक्रिया करता है:
- Ca(ClO)2 + 4HCl → CaCl2 + 2Cl2 + 2H2O
सुरक्षा
यह मुख्य रूप से शक्तिशाली ऑक्सीकरण अभिकर्मक है, क्योंकि इसमें वैलेंस +1 (रेडॉक्स स्थिति: Cl + 1) पर हाइपोक्लोराइट आयन होता है।
इस प्रकार कैल्शियम हाइपोक्लोराइट को गीला और गर्म या किसी अम्ल, कार्बनिक पदार्थ या धातु के पास नहीं रखना चाहिए। इसका निर्जलित रूप को संभालना सुरक्षित है।
यह भी देखें
- कैल्शियम हाइड्रोक्सीक्लोराइड
- सोडियम हाइपोक्लोराइट
- विनक्लोर
संदर्भ
- ↑ also chlorine powder, chloride of lime, chlorinated lime, "dry chlorine"
- ↑ Gerald F. Connell. "क्लोरीन कीटाणुशोधन ऑपरेटिंग सिस्टम के लिए प्रमुख संचालन रणनीतियाँ" (PDF). Retrieved 19 October 2014.
- ↑ Jump up to: 2.0 2.1 "Calcium Hypochlorite - 3V Tech". www.3v-tech.com (in English).
- ↑ Jump up to: 3.0 3.1 3.2 Vogt, H.; Balej, J; Bennett, J. E.; Wintzer, P.; Sheikh, S. A.; Gallone, P.; Vasudevan, S.; Pelin, K. (2010). "Chlorine Oxides and Chlorine Oxygen Acids". Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH. doi:10.1002/14356007.a06_483.pub2. ISBN 978-3527306732. S2CID 96905077.
- ↑ "कैल्शियम हाइपोक्लोराइड". Chemistry World.
- ↑ Chemical Products Synopsis: Calcium Hypochlorite (Technical report). Asbuiy Park, NJ: Mannsvile Chemical Products. 1987.
- ↑ Nwaukwa, Stephen; Keehn, Philip (1982). "The oxidation of aldehydes to acids with calcium hypochlorite [Ca(ClO)2]". Tetrahedron Letters. 23 (31): 3131–3134. doi:10.1016/S0040-4039(00)88577-9.
- ↑ Nwaukwa, Stephen; Keehn, Philip (1982). "Oxidative cleavage of α-diols, α-diones, α-hydroxy-ketones and α-hydroxy- and α-keto acids with calcium hypochlorite [Ca(ClO)2]". Tetrahedron Letters. 23 (31): 3135–3138. doi:10.1016/S0040-4039(00)88578-0.
- ↑ Cohen, Julius (1900). उन्नत छात्रों के लिए व्यावहारिक कार्बनिक रसायन. New York: Macmillan & Co. p. 63.
- ↑ National Research Council (1995). Prudent Practices in the Laboratory: Handling and Disposal of Chemicals. Washington, DC: The National Academies Press. p. 161. doi:10.17226/4911. ISBN 978-0-309-05229-0.
- ↑ "8.41799 Calcium hypochlorite for synthesis". Sigma-Aldrich.
Assay (iodometric): 67.0 - 75.0 %
- ↑ W.L Smith, Inorganic Bleaches, Production of Hypochlorite in Handbook of Detergents,Part F, (2009) Ed. U Zoller and Paul Sosis, CRC Press, ISBN 978-0-8247-0349-3
- ↑ Aleksandrova, M.M.; Dmitriev, G.A.; Avojan, R.L. (1968). "दो बेस कैल्शियम हाइपोक्लोराइट के क्रिस्टल संरचना का संभावित मॉडल". Armyanskii Khimicheskii Zhurnal. 21: 380-386.
{{cite journal}}: CS1 maint: multiple names: authors list (link)
