सीज़ियम: Difference between revisions
(Created page with "{{Distinguish|cerium}} {{Featured article}} {{Use Oxford spelling|date=January 2018}} {{Infobox caesium|engvar=en-OED}} सीज़ियम ([[ आईयूपीएसी ]...") |
No edit summary |
||
| (22 intermediate revisions by 4 users not shown) | |||
| Line 1: | Line 1: | ||
{{Distinguish| | {{Distinguish|सीरियम}} | ||
{{Infobox caesium|engvar=en-OED}} | {{Infobox caesium|engvar=en-OED}} | ||
1990 के दशक के बाद से, सबसे बड़ा | सीज़ियम ([[ आईयूपीएसी |IUPAC]] वर्तनी<ref>{{cite web|url=https://iupac.org/what-we-do/periodic-table-of-elements/|title=IUPAC Periodic Table of Elements|website=International Union of Pure and Applied Chemistry}}</ref>) (या [[ अमेरिकी अंग्रेजी |अमेरिकी अंग्रेजी]] में सीज़ियम){{refn|''Caesium'' is the spelling recommended by the [[International Union of Pure and Applied Chemistry]] (IUPAC).<ref>{{RedBook2005|pages=248–49}}.</ref> The [[American Chemical Society]] (ACS) has used the spelling ''cesium'' since 1921,<ref>{{Cite book|editor1-first = Anne M.|editor1-last = Coghill|editor2-first = Lorrin R.|editor2-last = Garson|date = 2006|title = The ACS Style Guide: Effective Communication of Scientific Information|edition = 3rd|publisher = American Chemical Society|location = Washington, D.C.|isbn = 978-0-8412-3999-9|page = [https://archive.org/details/acsstyleguideeff0000unse/page/127 127]|url = https://archive.org/details/acsstyleguideeff0000unse/page/127}}</ref><ref>{{Cite journal|journal=Pure Appl. Chem.|volume=70|issue=1|last1=Coplen|pages = 237–257|date = 1998|first1=T. B.|url = http://old.iupac.org/reports/1998/7001coplen/history.pdf|last2=Peiser|first2=H. S.|title = History of the recommended atomic-weight values from 1882 to 1997: a comparison of differences from current values to the estimated uncertainties of earlier values|doi = 10.1351/pac199870010237|s2cid=96729044}}</ref> following ''Webster's New International Dictionary''. The element was named after the Latin word ''[[wikt:caesius#Adjective|caesius]]'', meaning "bluish grey".<ref>[http://www.oed.com/view/Entry/26023 OED entry for "caesium"]. Second edition, 1989; online version June 2012. Retrieved 07 September 2012. Earlier version first published in ''New English Dictionary'', 1888.</ref> In medieval and early modern writings ''caesius'' was spelled with the [[Typographic ligature|ligature]] ''[[Æ#Latin and Greek|æ]]'' as ''cæsius''; hence, an alternative but now old-fashioned orthography is ''cæsium''. More spelling explanation at [[American and British English spelling differences#ae and oe|ae/oe vs e]].|group=note}} एक [[ रासायनिक तत्व |रासायनिक तत्व]] है जिसका प्रतीक Cs और परमाणु क्रमांक 55 होता है। यह एक नरम, चांदी की तरह चमकती-सुनहरी क्षार धातु होती है जिसका गलनांक {{convert|28.5|C}} होता है, जो इसे केवल पांच मौलिक [[ धातु |धातु]]ओं में से एक बनाते है जो कमरे के तापमान पर या उसके पास [[ तरल |तरल]] अवस्था में होते है।{{refn|Along with [[rubidium]] ({{convert|39|C|F|disp=sqbr}}), [[francium]] (estimated at {{convert|27|C|F|disp=sqbr}}), [[mercury (element)|mercury]] ({{convert|−39|C|F|disp=sqbr}}), and [[gallium]] ({{convert|30|C|F|disp=sqbr}}); bromine is also liquid at room temperature (melting at {{convert|−7.2|C|F|disp=sqbr}}), but it is a [[halogen]] and not a metal. Preliminary work with [[copernicium]] and [[flerovium]] suggests that they are gaseous metals at room temperature.|group=note}} सीज़ियम में भौतिक और रासायनिक गुण [[ रूबिडीयाम |रूबिडीयाम]] और [[ पोटैशियम |पोटैशियम]] के समान होते हैं। सभी धातुओं में सबसे अधिक अभिक्रियाशील, यह [[ आतिशबाज़ी |स्वतः ज्वलनी]] (पायरोफोरिक) है और {{convert|−116|C}} पर भी जल के साथ अभिक्रिया करता है। [[ पॉलिंग स्केल |पॉलिंग पैमाने]] पर 0.79 के मान के साथ यह सबसे कम [[ वैद्युतीयऋणात्मकता |विद्युत ऋणात्मक]] तत्व है।<!--PLEASE DO NOT CHANGE THIS, IT IS CORRECT. SEE THE FRANCIUM ARTICLE. FRANCIUM IS VERY HEAVY, SO THE 7S ELECTRON MOVES SO FAST THAT YOU MUST INCLUDE RELATIVITY! THE EFFECT IS A STABILIZATION OF THE 7S ORBITAL, ENOUGH TO BRING THE ELECTRONEGATIVITY UP ABOVE CAESIUM'S!--> इसमें केवल एक स्थायी समस्थानिक, सीज़ियम -133 है। सीज़ियम का मुख्य रूप से पॉल्युसाइट से खनन किया जाता है। सबसे अधिक समस्थानिक वाले तत्वों में से एक सीज़ियम तत्व में [[ बेरियम |बेरियम]] और [[ पारा (तत्व) |पारा]] के साथ 40 ज्ञात समस्थानिक हैं।<ref name="Cs-ptable">{{cite web |url=http://www.ptable.com/#Isotope |title=Isotopes |publisher=Ptable}}</ref> [[ सीज़ियम-137 |सीज़ियम-137]], [[ परमाणु रिएक्टर प्रौद्योगिकी |परमाणु रिएक्टरों]] परमाणु द्वारा उत्पादित अपशिष्ट से प्राप्त [[ विखंडन उत्पाद |विखंडन उत्पाद]] है।{{why|date=July 2022}} | ||
जर्मन रसायन वैज्ञानिक [[ रॉबर्ट बन्सेन |रॉबर्ट बन्सेन]] और भौतिक विज्ञानी [[ गुस्ताव किरचॉफ |गुस्ताव किरचॉफ]] ने 1860 में लौ स्पेक्ट्रोस्कोपी की नई विकसित विधि द्वारा सीज़ियम की खोज की। सीज़ियम के लिए पहले छोटे पैमाने पर अनुप्रयोग निर्वात नलिका (वैक्यूम ट्यूबों) और [[ सौर सेल |सौर सेल]] में "[[ प्राप्त करनेवाला |गेट्टर]]" के रूप में थे। 1967 में, अल्बर्ट आइंस्टीन के इस प्रमाण पर कार्य करते हुए कि ब्रह्मांड में प्रकाश की गति सबसे स्थिर आयाम है, [[ इकाइयों की अंतर्राष्ट्रीय प्रणाली |इकाइयों की अंतर्राष्ट्रीय प्रणाली]] ने सेकंड और [[ मीटर |मीटर]] को सह-परिभाषित करने के लिए सीज़ियम -133 के उत्सर्जन वर्णक्रम (स्पेक्ट्रम) से दो विशिष्ट तरंग गणना का उपयोग किया। अतः उस समय से सीज़ियम का उपयोग व्यापक रूप से अत्यधिक यथार्थ परमाण्विक घड़ियों मे किया जाने लगा। | |||
1990 के दशक के बाद से, तत्व का सबसे बड़ा अनुप्रयोग [[ खोदने वाला द्रव |प्रवेधन तरल]] पदार्थ के लिए सीज़ियम प्रारूप के रूप में रहा है, लेकिन इसमें बिजली के उत्पादन, इलेक्ट्रॉनिक्स में और रसायन विज्ञान में कई तरह के अनुप्रयोग हैं। रेडियोधर्मी समस्थानिक सीज़ियम-137 का अर्ध आयु लगभग 30 वर्ष होती है और इसका उपयोग चिकित्सा अनुप्रयोगों, औद्योगिक गेज और जल विज्ञान (हाइड्रोलॉजी) में किया जाता है। गैर-रेडियोधर्मी सीज़ियम यौगिक केवल हल्के से विषाक्त होते हैं, लेकिन शुद्ध धातु की जल के साथ विस्फोटक अभिक्रिया करने की प्रवृत्ति अर्थात सीज़ियम को एक खतरनाक सामग्री माना जाता है, और रेडियोसमस्थानिक पर्यावरण में एक महत्वपूर्ण आरोग्य और पारिस्थितिक विपत्ति प्रस्तुत करते हैं। | |||
==विशेषताएं== | ==विशेषताएं== | ||
| Line 12: | Line 12: | ||
=== भौतिक गुण === | === भौतिक गुण === | ||
[[File:CsCrystals.JPG|left|thumb|उच्च शुद्धता सीज़ियम-133 [[ आर्गन ]] में संग्रहित।]] | [[File:CsCrystals.JPG|left|thumb|उच्च शुद्धता सीज़ियम-133 [[ आर्गन ]] में संग्रहित।]] | ||
कमरे के तापमान पर ठोस | कमरे के तापमान पर सभी तत्व ठोस अवस्था में होते है जिनमे से सीज़ियम सबसे नरम होता है इसकी कठोरता 0.2 Mohs की कठोरता होती है। यह एक बहुत ही तन्य, पीली धातु है, जो थोड़ी मात्रा में [[ ऑक्सीजन |ऑक्सीजन]] की उपस्थिति में काली हो जाती है।<ref name="USGS">{{cite web|url=http://pubs.usgs.gov/of/2004/1432/2004-1432.pdf |publisher=United States Geological Survey |access-date=2009-12-27 |title=Mineral Commodity Profile: Cesium |first1=William C. |last1=Butterman |first2=William E. |last2=Brooks |first3=Robert G. |last3=Reese Jr. |date=2004 |url-status=dead |archive-url=https://web.archive.org/web/20070207015229/http://pubs.usgs.gov/of/2004/1432/2004-1432.pdf |archive-date=February 7, 2007 }}</ref><ref>{{cite book|title = Exploring Chemical Elements and their Compounds|author = Heiserman, David L.|publisher = McGraw-Hill|date = 1992|isbn = 978-0-8306-3015-8|pages = [https://archive.org/details/exploringchemica00heis/page/201 201]–203|url-access = registration|url = https://archive.org/details/exploringchemica00heis}}</ref><ref>{{cite book |title=The Chemistry of the Liquid Alkali Metals |last=Addison |first=C. C. |date=1984 |publisher=Wiley|isbn= 978-0-471-90508-0|access-date=2012-09-28 |url=http://www.cs.rochester.edu/users/faculty/nelson/cesium/cesium_color.html}}</ref> जब [[ खनिज तेल |खनिज तेल]] (जहां इसे परिवहन के दौरान सबसे अच्छे से रखा जाता है) की उपस्थिति में, यह अपनी धात्विक चमक खो देता है एक नीरस, स्लेटी (ग्रे) रूप धारण कर लेता है। यह [[ गलनांक |गलनांक]] {{convert|28.5|C}}, कमरे के तापमान पर तरल अवस्था में होता है। पारा एकमात्र स्थायी तत्व धातु है जिसका गलनांक सीज़ियम से कम होता है।<ref name="autogenerated1">{{cite web|url=http://pubs.acs.org/cen/80th/print/cesium.html |title=C&EN: It's Elemental: The Periodic Table – Cesium |publisher=American Chemical Society|access-date=2010-02-25|author=Kaner, Richard|date = 2003}}</ref> इसके अलावा, धातु का [[ क्वथनांक |क्वथनांक]] {{convert|641|C}}, काफी कम होता है, पारे के अलावा अन्य सभी धातुओं में सबसे कम।<ref name="RSC">{{cite web|url=http://www.rsc.org/periodic-table/element/55/caesium|access-date=2010-09-27|publisher=Royal Society of Chemistry|title=Chemical Data – Caesium – Cs}}</ref> इसके यौगिक नीले<ref name="CRC74">{{cite book|url=https://books.google.com/books?id=QdU-lRMjOsgC&pg=PA13|page=13|first=Charles T.|last=Lynch|publisher=CRC Press|date=1974|title=CRC Handbook of Materials Science|isbn=978-0-8493-2321-8}}</ref><ref name="flametests">{{cite web |url=http://www.chemguide.co.uk/inorganic/group1/flametests.html |title=Flame Tests |author=Clark, Jim |date=2005 |work=chemguide |access-date=2012-01-29}}</ref> या बैंगनी<ref name="flametests" /> रंग की ज्वाला के साथ जलते हैं। | ||
[[File:Rb&Cs crystals.jpg|left|thumb|रूबिडियम क्रिस्टल (चांदी) की तुलना में सीज़ियम क्रिस्टल (सुनहरा)]] | [[File:Rb&Cs crystals.jpg|left|thumb|रूबिडियम क्रिस्टल (चांदी) की तुलना में सीज़ियम क्रिस्टल (सुनहरा)]] | ||
सीज़ियम | सीज़ियम [[ सोना |सोना]] और पारा ([[ अमलगम (रसायन विज्ञान) |अमलगम]]), अन्य क्षार धातुओं के साथ [[ मिश्र धातु |मिश्र धातु]] बनाता है। यह {{convert|650|°C}} से कम तापमान पर, [[ कोबाल्ट |कोबाल्ट]], [[ लोहा |लोहा]], [[ मोलिब्डेनम |मोलिब्डेनम]], [[ निकल |निकल]], [[ प्लैटिनम |प्लैटिनम]], टैंटलम या टंगस्टन के साथ मिश्र धातु नहीं बनाता। यह [[ सुरमा |ऐन्टिमनी]], [[ गैलियम |गैलियम]], [[ ईण्डीयुम |ईण्डीयम]] और थोरियम के साथ सुनिश्चित [[ इंटरमेटेलिक्स |अंतरधात्विक यौगिक]] बनाता है, जो प्रकाश संश्लेषक होते है।<ref name="USGS" /> यह अन्य सभी क्षार धातुओं (लिथियम को छोड़कर) के साथ मिश्रित हो जाता है, 41% सीज़ियम, 47% पोटेशियम और 12% [[ सोडियम |सोडियम]] के मोलर वितरण के मिश्र धातु में {{convert|−78|C}} पर किसी भी ज्ञात मिश्र धातु का सबसे कम गलनांक होता है।<ref name="autogenerated1" /><ref>{{cite web|url=http://symp15.nist.gov/pdf/p564.pdf |title=Density of melts of alkali metals and their Na-K-Cs and Na-K-Rb ternary systems |author=Taova, T. M. |work=Fifteenth symposium on thermophysical properties, Boulder, Colorado, United States |date=June 22, 2003 |access-date=2010-09-26 |display-authors=etal |url-status=dead |archive-url=https://web.archive.org/web/20061009133313/http://symp15.nist.gov/pdf/p564.pdf |archive-date=October 9, 2006 }}</ref> कुछ मिश्रणों का अध्ययन किया गया है: {{chem|CsHg|2}} बैंगनी धात्विक चमक के साथ काले रंग का होता है, जबकि CsHg धात्विक चमक के साथ सुनहरे रंग का होता है।<ref>{{cite journal|doi=10.1016/S0079-6786(97)81004-7|journal = Progress in Solid State Chemistry|volume = 25|date = 1997|pages = 73–123|title = Alkali metal amalgams, a group of unusual alloys|first = H. J.|last = Deiseroth|issue = 1–2}}</ref> | ||
सीज़ियम का सुनहरा रंग समूह के अवरोही होने पर क्षार धातुओं के इलेक्ट्रॉनों को उत्तेजित करने के लिए आवश्यक प्रकाश की घटती आवृत्ति | |||
सीज़ियम का सुनहरा रंग समूह के अवरोही होने पर क्षार धातुओं के इलेक्ट्रॉनों को उत्तेजित करने के लिए आवश्यक प्रकाश की घटती आवृत्ति के कारन प्राप्त होता है। रूबिडियम से लिथियम के लिए यह आवृत्ति पराबैंगनी क्षेत्र में होती है, लेकिन सीज़ियम के लिए यह वर्णक्रम (स्पेक्ट्रम) के अंत में नीले-बैंगनी क्षेत्र में प्रवेश करती है, दूसरे शब्दों में, क्षार धातुओं की [[ प्लाज्मा दोलन |प्लाज्मा आवृति]] लिथियम से सीज़ियम तक कम हो जाती है। इस प्रकार सीज़ियम बैंगनी प्रकाश को प्रेषित करता है और आंशिक रूप से अवशोषित करता है जबकि अन्य रंग (कम आवृत्ति वाले) परावर्तित होते हैं; इसलिए यह पीले रंग का दिखाई देता है।<ref>{{cite book |last=Addison |first=C. C. |date=1984 |title=The chemistry of the liquid alkali metals |publisher=Wiley |page=7 |isbn=9780471905080}}</ref> | |||
===रासायनिक गुण === | ===रासायनिक गुण === | ||
[[File:Cesium water.theora.ogv|left|thumb|ठंडे | [[File:Cesium water.theora.ogv|left|thumb|ठंडे जल में सीज़ियम की थोड़ी मात्रा मिलाना विस्फोटक होता है।|alt=एक व्यक्ति पेट्री डिश में ठंडे पानी के साथ थोड़ी मात्रा में धातु मिलाता है जिससे एक छोटा विस्फोट होता है।]] | ||
सीज़ियम धातु अत्यधिक | सीज़ियम धातु अत्यधिक अभिक्रियाशील और स्वत: ज्वलनशील होती है। यह हवा में स्वतः प्रज्वलित होता है, और कम तापमान पर भी जल के साथ अन्य क्षार धातुओं ([[ आवर्त सारणी |आवर्त सारणी]] के पहले वर्ग) की तुलना में अधिक विस्फोटक रूप से अभिक्रिया करता है।<!--YES INCLUDING FRANCIUM--><ref name="autogenerated1" /> यह {{convert|−116|C}} तक के न्यूनतम तापमान पर बर्फ के साथ अभिक्रिया करता है।<ref name="USGS" /> इस उच्च अभिक्रियाशीलता के कारण, सीज़ियम धातु को एक [[ खतरनाक सामग्री |खतरनाक सामग्री]] के रूप में वर्गीकृत किया गया है। इसे खनिज तेल जैसे शुष्क, संतृप्त हाइड्रोकार्बन में संग्रहीत और स्थानांतरित किया जाता है। इसे केवल [[ अक्रिय गैस |अक्रिय गैस]], जैसे आर्गन के तहत नियंत्रित किया जा सकता है। हालांकि, सीज़ियम-जल विस्फोट अक्सर सोडियम-जल के विस्फोट से कम शक्तिशाली होता है जिसमें सोडियम की समान मात्रा होती है। इसका कारण यह है कि जल के संपर्क में आने पर सीज़ियम शीघ्र ही विस्फोट कर जाता है, जिससे हाइड्रोजन को एकत्रित होने में बहुत कम समय लगता है।<ref>Gray, Theodore (2012) ''The Elements'', Black Dog & Leventhal Publishers, p. 131, {{ISBN|1-57912-895-5}}.</ref> सीज़ियम को निर्वात सील [[ बोरोसिल ग्लास |बोरोसिलिकेट ग्लास]] [[ ampoule |एम्पाउल्स]] में संग्रहित किया जा सकता है। लगभग {{convert|100|g|oz}} से अधिक मात्रा में, सीज़ियम को भली भांति बंद करके, जंगरोधी स्टील के पात्र में स्थानांतरित किया जाता है।<ref name="USGS" /> | ||
सीज़ियम की रसायन अन्य क्षार धातुओं के समान है, विशेष रूप से आवर्त सारणी में सीज़ियम से ऊपर के तत्व रूबिडियम के समान।<ref name="greenwood">{{cite book|last1 = Greenwood|first1 = N. N.|last2 = Earnshaw|first2 = A.|title = Chemistry of the Elements|publisher = Pergamon Press|place = Oxford, UK|date = 1984|isbn = 978-0-08-022057-4}}</ref> जैसा कि क्षार धातु के लिए अपेक्षित है, केवल +1 सामान्य ऑक्सीकरण अवस्था है।{{refn|It differs from this value in caesides, which contain the Cs<sup>−</sup> anion and thus have caesium in the −1 oxidation state.<ref name="caeside" /> Additionally, 2013 calculations by Mao-sheng Miao indicate that under conditions of extreme pressure (greater than 30 [[pascal (unit)|GPa]]), the inner 5p electrons could form chemical bonds, where caesium would behave as the seventh 5p element. This discovery indicates that higher caesium fluorides with caesium in oxidation states from +2 to +6 could exist under such conditions.<ref>{{cite web|last=Moskowitz|first=Clara|title=A Basic Rule of Chemistry Can Be Broken, Calculations Show|url=http://www.scientificamerican.com/article.cfm?id=chemical-bonds-inner-shell-electrons|work=Scientific American|access-date=2013-11-22}}</ref>|name=oxistates|group=note}} इस तथ्य से कुछ सधारण अंतर जैसे कि इसका परमाणु द्रव्यमान अधिक होता है और अन्य (गैर-रेडियोधर्मी) क्षार धातुओं की तुलना में अधिक विद्युत-धनात्मक होते है, उत्पन्न होते हैं।<ref name="HollemanAF">{{cite book|publisher = Walter de Gruyter|date = 1985|edition = 91–100|pages = 953–955|isbn = 978-3-11-007511-3|title = Lehrbuch der Anorganischen Chemie|first1 = Arnold F.|last1 = Holleman|last2 = Wiberg|first2 = Egon |last3 =Wiberg|first3 = Nils|chapter = Vergleichende Übersicht über die Gruppe der Alkalimetalle| language = de}}</ref> सीज़ियम सबसे विद्युत धनात्मक रासायनिक तत्व है।{{refn|[[Francium]]'s electropositivity has not been experimentally measured due to its high radioactivity. Measurements of the first [[ionization energy]] of francium suggest that its [[relativistic quantum chemistry|relativistic effects]] may lower its reactivity and raise its electronegativity above that expected from [[periodic trend]]s.<ref>{{cite journal|last1 = Andreev|first1 = S. V.|last2 = Letokhov|first2 =V. S. |last3 =Mishin|first3 =V. I.|title = Laser resonance photoionization spectroscopy of Rydberg levels in Fr|journal = [[Physical Review Letters]]|date = 1987|volume = 59|pages = 1274–76|doi = 10.1103/PhysRevLett.59.1274|pmid=10035190|bibcode=1987PhRvL..59.1274A|issue = 12}}</ref>|group=note}}<ref name="autogenerated1" /> सीज़ियम आयन भी हल्का क्षार धातुओं की तुलना में बड़ा और कम "कठोर" होता है। | |||
===यौगिक === | ===यौगिक === | ||
[[File:CsCl polyhedra.png|thumb|left|upright|CsCl| . में Cs और Cl के घन समन्वय का बॉल-एंड-स्टिक मॉडल alt=27 छोटे भूरे रंग के गोले, नौ की 3 समान दूरी वाली परतों में। 8 गोले एक नियमित घन बनाते हैं और उनमें से 8 घन एक बड़ा घन बनाते हैं। ग्रे गोले सीज़ियम परमाणुओं का प्रतिनिधित्व करते हैं। प्रत्येक छोटे घन के केंद्र में एक क्लोरीन परमाणु का प्रतिनिधित्व करने वाला एक छोटा हरा क्षेत्र होता है। इस प्रकार, प्रत्येक क्लोरीन सीज़ियम परमाणुओं द्वारा निर्मित घन के मध्य में होता है और प्रत्येक सीज़ियम क्लोरीन द्वारा बने घन के मध्य में होता है।]] | [[File:CsCl polyhedra.png|thumb|left|upright|CsCl| . में Cs और Cl के घन समन्वय का बॉल-एंड-स्टिक मॉडल alt=27 छोटे भूरे रंग के गोले, नौ की 3 समान दूरी वाली परतों में। 8 गोले एक नियमित घन बनाते हैं और उनमें से 8 घन एक बड़ा घन बनाते हैं। ग्रे गोले सीज़ियम परमाणुओं का प्रतिनिधित्व करते हैं। प्रत्येक छोटे घन के केंद्र में एक क्लोरीन परमाणु का प्रतिनिधित्व करने वाला एक छोटा हरा क्षेत्र होता है। इस प्रकार, प्रत्येक क्लोरीन सीज़ियम परमाणुओं द्वारा निर्मित घन के मध्य में होता है और प्रत्येक सीज़ियम क्लोरीन द्वारा बने घन के मध्य में होता है।]] | ||
अधिकांश सीज़ियम यौगिकों में तत्व धनायन | अधिकांश सीज़ियम यौगिकों में तत्व धनायन Cs<sup>+</sup> होता है, जो आयनिक रूप से विभिन्न प्रकार के [[ आयोनिक बंध |आयनों से बंधता]] है। एक उल्लेखनीय अपवाद केसाइड आयन ({{chem|Cs|−}}),<ref name="caeside">{{cite journal|journal = [[Angewandte Chemie|Angewandte Chemie International Edition]]|year = 1979|first = J. L.|last = Dye|title = Compounds of Alkali Metal Anions|volume = 18|issue = 8|pages = 587–598|doi = 10.1002/anie.197905871}}</ref> है और अन्य कई उपऑक्साइड हैं (नीचे ऑक्साइड पर अनुभाग देखें)। हाल ही में, सीज़ियम को [[ पी-ब्लॉक |पी-ब्लॉक]] तत्व के रूप में प्रस्तावितक रने की भविष्यवाणी की गई है और उच्च दाब के अंतर्गत उच्च [[ ऑक्सीकरण अवस्था |ऑक्सीकरण अवस्था]] (अर्थात, n> 1 के साथ CsF<sub>n</sub>) के साथ उच्च फ्लोराइड बनाने में सक्षम है।<ref>{{Cite journal |last=Miao |first=Mao-sheng |date=2013 |title=Caesium in high oxidation states and as a p-block element |url=https://www.nature.com/articles/nchem.1754 |journal=Nature Chemistry |language=en |volume=5 |issue=10 |pages=846–852 |doi=10.1038/nchem.1754 |pmid=24056341 |arxiv=1212.6290 |bibcode=2013NatCh...5..846M |s2cid=38839337 |issn=1755-4349}}</ref> इस भविष्यवाणी को और प्रयोगों द्वारा सत्यापित करने की आवश्यकता है।<ref>{{Cite journal |last1=Sneed |first1=D. |last2=Pravica |first2=M. |last3=Kim |first3=E. |last4=Chen |first4=N. |last5=Park |first5=C. |last6=White |first6=M. |date=2017-10-01 |title=Forcing Cesium into Higher Oxidation States Using Useful hard x-ray Induced Chemistry under High Pressure |url=https://www.osti.gov/biblio/1409108-forcing-cesium-higher-oxidation-states-using-useful-hard-ray-induced-chemistry-under-high-pressure |journal=Journal of Physics: Conference Series |language=ENGLISH |volume=950 |issue=11, 2017 |page=042055 |doi=10.1088/1742-6596/950/4/042055 |bibcode=2017JPhCS.950d2055S |osti=1409108 |s2cid=102912809 |issn=1742-6588}}</ref> | ||
Cs<sup>+</sup> के लवण आमतौर पर रंगहीन होते हैं, जब तक कि आयन स्वयं रंगीन न हो। कई साधारण लवण आर्द्रताग्राही ([[ हीड्रोस्कोपिक |हाइग्रोस्कोपिक]]) होते हैं, लेकिन हल्के क्षार धातुओं के संबंधित लवणों की तुलना में कम होते हैं। [[ फास्फेट |फास्फेट]],<ref>Hogan, C. M. (2011).{{cite web|url=http://www.eoearth.org/article/Phosphate?topic=49557 |title=Phosphate |access-date=2012-06-17|archive-url=https://web.archive.org/web/20121025180158/http://www.eoearth.org/article/Phosphate?topic=49557 |archive-date=2012-10-25 }} in ''Encyclopedia of Earth''. Jorgensen, A. and Cleveland, C.J. (eds.). National Council for Science and the Environment. Washington DC</ref> [[ एसीटेट |एसीटेट]], [[ कार्बोनेट |कार्बोनेट]], [[ halide |हैलाइड्स]], [[ ऑक्साइड |ऑक्साइड]], [[ नाइट्रेट |नाइट्रेट]], और सल्फेट लवण जल में घुलनशील होते हैं। द्विक लवण अक्सर कम घुलनशील होते हैं, और सीज़ियम एल्युमिनियम सल्फेट की कम घुलनशीलता का उपयोग अयस्कों से Cs के शोधन में किया जाता है। ऐन्टिमनी (जैसे {{chem|CsSbCl|4}}), [[ विस्मुट |बिस्मथ]], [[ कैडमियम |कैडमियम]], तांबा, लोहा और सीसा के साथ [[ दोहरा नमक |द्विक लवण]] भी बहुत कम घुलनशील होते है।<ref name="USGS" /> | |||
[[ सीज़ियम हाइड्रॉक्साइड |सीज़ियम हाइड्रॉक्साइड]] (CsOH) आर्द्रताग्राही (हाइग्रोस्कोपिक) और अत्यधिक [[ आधार (रसायन विज्ञान) |क्षारीय]] होता है।<ref name="greenwood" /> यह [[ सिलिकॉन |सिलिकॉन]] जैसे अर्धचालकों की सतह को तेजी से उकेरता है।<ref>{{cite book|url = https://books.google.com/books?id=F-8SltAKSF8C&pg=PA90|title = Etching in microsystem technology|author = Köhler, Michael J.|page = 90|publisher = Wiley-VCH|isbn = 978-3-527-29561-6|date = 1999}}</ref> CsOH को पहले रसायनज्ञों द्वारा "सबसे प्रबल क्षार" माना जाता था, जो बड़े Cs<sup>+</sup> आयन और OH<sup>−</sup> के बीच अपेक्षाकृत कमजोर आकर्षण को दर्शाता है,<ref name="CRC74" /> यह वास्तव में सबसे प्रबल अरहेनियस क्षार है, हालाँकि, कई यौगिक जैसे n-ब्यूटिलिथियम, [[ सोडियम एमाइड |सोडियम एमाइड]], [[ सोडियम हाइड्राइड |सोडियम हाइड्राइड]], [[ सीज़ियम हाइड्राइड |सीज़ियम हाइड्राइड]] आदि, जो इसके साथ तीव्र अभिक्रिया के रूप में जल में घुल नहीं सकता, बल्कि केवल कुछ [[ निर्जल |निर्जल]] [[ ध्रुवीय aprotic सॉल्वैंट्स |ध्रुवीय ऐप्रोटिक विलायक]] में उपयोग किया जाता है, यह ब्रोंस्टेड-लोरी अम्ल-क्षार सिद्धांत के आधार पर अत्यधिक क्षारीय होते हैं।<ref name="greenwood" /> | |||
सीज़ियम और सोने का स्टोइकोमीट्रिक मिश्रण गर्म करने पर पीला सीज़ियम ऑराइड (Cs<sup>+</sup>Au<sup>−</sup>) बनाने के लिए अभिक्रिया करता है। यहाँ का ऑराइड आयन एक आभासी हैलोजन ([[ स्यूडोहैलोजन |स्यूडोहैलोजन]]) की तरह व्यवहार करता है। यौगिक जल के साथ तीव्रता से अभिक्रिया करता है, जिससे सीज़ियम हाइड्रॉक्साइड, धातु सोना और हाइड्रोजन गैस निकलती है, तरल अमोनिया में टेट्रामेथाइलमोनियम ऑराइड का उत्पादन करने के लिए इसे सीज़ियम-विशिष्ट आयन विनिमय रेज़िन के साथ अभिक्रिया दी जा सकती है। समान प्लेटिनम यौगिक, लाल सीज़ियम प्लैटिनाइड (Cs<sub>2</sub>Pt), में प्लैटिनाइड आयन होता है जो एक स्यूडोचालकोजन के रूप में व्यवहार करता है।<ref>{{cite journal|title=Effects of relativistic motion of electrons on the chemistry of gold and platinum|journal=Solid State Sciences|date=2005-11-30|volume=7|issue=12|pages=1464–1474|doi=10.1016/j.solidstatesciences.2005.06.015|last=Jansen|first=Martin|bibcode = 2005SSSci...7.1464J |doi-access=free}}</ref> | |||
==== संकुल ==== | |||
सभी धातु धनायनों की तरह, Cs<sup>+</sup> विलयन में लुईस क्षार के साथ संकुल बनाता है। अपने बड़े आकार के कारण, Cs<sup>+</sup> आमतौर पर 6 से अधिक [[ समन्वय संख्या |समन्वय संख्या]] रखता है, जो छोटे क्षार धातु उद्धरणों के लिए विशिष्ट संख्या है। CsCl के 8-समन्वय में यह अंतर स्पष्ट है। यह उच्च समन्वय संख्या और कोमलता (सहसंयोजक बंधन बनाने की प्रवृत्ति) नाभिकीय अपशिष्ट के उपचार में Cs<sup>+</sup> को अन्य धनायनों से अलग करने में उपयोग किए जाने वाले गुण हैं, जहाँ <sup>137</sup>Cs<sup>+</sup> को बड़ी मात्रा में गैर-रेडियोधर्मी K<sup>+</sup> से अलग किया जाना चाहिए।<sup><ref>{{cite book |last1=Moyer |first1=Bruce A. |last2=Birdwell |first2=Joseph F. |last3=Bonnesen |first3=Peter V. |last4=Delmau |first4=Laetitia H. |journal=Macrocyclic Chemistry |pages=383–405 |date=2005 |doi=10.1007/1-4020-3687-6_24 |isbn=978-1-4020-3364-3|title=Use of Macrocycles in Nuclear-Waste Cleanup: A Realworld Application of a Calixcrown in Cesium Separation Technology }}.</ref> | |||
====हैलाइड्स==== | ====हैलाइड्स==== | ||
[[File:CsX@DWNT.jpg|thumb|upright|डबल-वॉल [[ कार्बन नैनोट्यूब ]] (ट्रांसमिशन इलेक्ट्रॉन माइक्रोस्कोपी) के अंदर उगाए गए मोनैटोमिक सीज़ियम हलाइड तार।<ref name="chains">{{cite journal|doi=10.1038/ncomms8943|pmid=26228378|pmc=4532884|title=Single-atom electron energy loss spectroscopy of light elements|journal=Nature Communications|volume=6|pages=7943|year=2015|last1=Senga|first1=Ryosuke|last2=Suenaga|first2=Kazu|bibcode=2015NatCo...6.7943S}}</ref>]] | [[ फ्लोराइड |सीज़ियम फ्लोराइड]] (CsF) एक आर्द्रताग्राही (हाइग्रोस्कोपिक) सफेद ठोस है जिसका व्यापक रूप से फ्लोराइड आयनों के स्रोत के रूप में [[ ऑर्गनोफ्लोरीन रसायन शास्त्र |ऑर्गनोफ्लोरीन रसायन विज्ञान]] में उपयोग किया जाता है।<ref>{{cite journal|author=Evans, F. W. |author2=Litt, M. H. |author3=Weidler-Kubanek, A. M. |author4=Avonda, F. P. |title=Reactions Catalyzed by Potassium Fluoride. 111. The Knoevenagel Reaction|date=1968|journal=Journal of Organic Chemistry|volume=33|pages=1837–1839|doi=10.1021/jo01269a028|issue=5}}</ref> सीज़ियम फ्लोराइड में हैलाइट संरचना होती है, जिसका अर्थ है कि Cs<sup>+</sup> और F<sup>−</sup> एक [[ घन निकटतम पैक |घन निकटतम पैक्ड]] सरणी में पैक होते हैं जैसे [[ सोडियम क्लोराइड |सोडियम क्लोराइड]] में Na<sup>+</sup> और Cl<sup>−</sup> करते हैं।<ref name="greenwood" /> विशेष रूप से, सभी ज्ञात तत्वों में सीज़ियम और फ्लोरीन में क्रमशः सबसे कम और उच्चतम विद्युतऋणात्मकता होती है।[[File:CsX@DWNT.jpg|thumb|upright|डबल-वॉल [[ कार्बन नैनोट्यूब ]] (ट्रांसमिशन इलेक्ट्रॉन माइक्रोस्कोपी) के अंदर उगाए गए मोनैटोमिक सीज़ियम हलाइड तार।<ref name="chains">{{cite journal|doi=10.1038/ncomms8943|pmid=26228378|pmc=4532884|title=Single-atom electron energy loss spectroscopy of light elements|journal=Nature Communications|volume=6|pages=7943|year=2015|last1=Senga|first1=Ryosuke|last2=Suenaga|first2=Kazu|bibcode=2015NatCo...6.7943S}}</ref>]] | ||
[[ सीज़ियम क्लोराइड |सीज़ियम क्लोराइड]] (CsCl) साधारण [[ घन क्रिस्टल प्रणाली |घन क्रिस्टल प्रणाली]] में क्रिस्टलीकृत होता है। इसे "सीज़ियम क्लोराइड संरचना" भी कहा जाता है,<ref name="HollemanAF" /> यह संरचनात्मक रूपांकन दो-परमाणु आधार के साथ एक आदिम घन जाली से बना है, प्रत्येक आठ गुना समन्वय के साथ, क्लोराइड परमाणु घन के किनारों पर जाली बिंदुओं पर स्थित होते हैं, जबकि सीज़ियम परमाणु घनो के केंद्र में छिद्र में होते हैं। इस संरचना को [[ सीज़ियम ब्रोमाइड |CsBr]] और [[ सीज़ियम आयोडाइड |CsI]], और कई अन्य यौगिकों के साथ साझा किया जाता है जिनमें Cs नहीं होता है। इसके विपरीत, अधिकांश अन्य क्षारीय हैलाइड में सोडियम क्लोराइड (NaCl) संरचना होती है।<ref name="HollemanAF" /> CsCl संरचना को प्राथमिकता दी जाती है क्योंकि Cs<sup>+</sup> की [[ आयनिक त्रिज्या |आयनिक त्रिज्या]] 174 [[ पिकोमीटर |pm]] और Cl<sup>−</sup> 181 pm है।<ref>{{cite book|last=Wells|first = A. F.| date=1984| title=Structural Inorganic Chemistry| edition=5th|publisher=Oxford Science Publications|isbn=978-0-19-855370-0}}</ref> | |||
==== ऑक्साइड ==== | |||
[[File:Cs11O3 cluster.png|thumb|left|upright=0.7|{{chem|Cs|11|O|3}} क्लस्टर | ऑल्ट = स्टिक और बॉल आरेख तीन नियमित अष्टफलक दिखाता है, जो अगले एक से एक सतह से जुड़े होते हैं और आखिरी वाला एक सतह को पहले के साथ साझा करता है। तीनों में एक बढ़त समान है। सभी ग्यारह कोने सीज़ियम का प्रतिनिधित्व करने वाले बैंगनी रंग के गोले हैं, और प्रत्येक ऑक्टाहेड्रोन के केंद्र में ऑक्सीजन का प्रतिनिधित्व करने वाला एक छोटा लाल क्षेत्र है।]] | |||
अन्य क्षार धातुओं की तुलना में, सीज़ियम ऑक्सीजन के साथ कई द्वयंगी यौगिक बनाता है। जब सीज़ियम हवा में जलता है, तो सुपरऑक्साइड {{chem|CsO|2}} मुख्य उत्पाद प्राप्त होता है।<ref name="cotton">{{cite book|last = Cotton|first = F. Albert |author2=Wilkinson, G.|title =Advanced Inorganic Chemistry|date =1962 |publisher = John Wiley & Sons, Inc.|page = 318|isbn = 978-0-471-84997-1}}</ref> "सामान्य" [[ सीज़ियम ऑक्साइड |सीज़ियम ऑक्साइड]] ({{chem|Cs|2|O}}) पीले-नारंगी [[ हेक्सागोनल क्रिस्टल सिस्टम |हेक्सागोनल क्रिस्टल]] बनाता है,<ref name="CRC">{{RubberBible87th|pages=451, 514}}</ref> और {{chem|CdCl|2}} विरोधी प्रकार का एकमात्र ऑक्साइड है।<ref name="ReferenceA">{{cite journal|doi = 10.1021/j150537a022|date = 1956|last1 = Tsai|first1 = Khi-Ruey|last2 = Harris|first2 = P. M.|last3 = Lassettre|first3 = E. N.|journal = Journal of Physical Chemistry|volume = 60|pages = 338–344|title = The Crystal Structure of Cesium Monoxide|issue = 3|url = http://www.dtic.mil/get-tr-doc/pdf?AD=AD0026963|archive-url = https://web.archive.org/web/20170924131429/http://www.dtic.mil/get-tr-doc/pdf?AD=AD0026963|url-status = dead|archive-date = September 24, 2017}}</ref> यह {{convert|250|°C}} पर वाष्पीकृत हो जाता है और {{convert|400|°C}} से ऊपर के तापमान पर सीज़ियम धातु और [[ पेरोक्साइड |परऑक्साइड]] {{chem|Cs|2|O|2}} को विघटित कर देता है। सुपरऑक्साइड और [[ ओजोन का |ओजोनाइड]] {{chem|CsO|3}},<ref>{{cite journal|doi =10.1007/BF00845494|title =Synthesis of cesium ozonide through cesium superoxide|date =1963|last1 =Vol'nov|first1 =I. I.|last2 =Matveev|first2 =V. V.|journal =Bulletin of the Academy of Sciences, USSR Division of Chemical Science|volume =12|pages =1040–1043|issue =6}}</ref><ref>{{cite journal|doi =10.1070/RC1971v040n02ABEH001903|title =Alkali and Alkaline Earth Metal Ozonides|date =1971|last1 =Tokareva|first1 =S. A.|journal =Russian Chemical Reviews|volume =40|pages =165–174|bibcode = 1971RuCRv..40..165T|issue =2|s2cid =250883291}}</ref> के अलावा कई चमकीले रंग के उपऑक्साइड का भी अध्ययन किया गया है।<ref name="Simon">{{Cite journal|last = Simon|first = A.|title = Group 1 and 2 Suboxides and Subnitrides — Metals with Atomic Size Holes and Tunnels|journal = Coordination Chemistry Reviews |date = 1997|volume = 163|pages = 253–270|doi = 10.1016/S0010-8545(97)00013-1}}</ref> इनमें {{chem|Cs|7|O}}, {{chem|Cs|4|O}}, {{chem|Cs|11|O|3}}, {{chem|Cs|3|O}} (गहरा-हरा<ref>{{cite journal|doi =10.1021/j150537a023|date =1956|last1 =Tsai|first1 =Khi-Ruey|last2 =Harris|first2 =P. M.|last3 =Lassettre|first3 =E. N.|journal =Journal of Physical Chemistry|volume =60|pages =345–347|title=The Crystal Structure of Tricesium Monoxide|issue =3}}</ref>), CsO, {{chem|Cs|3|O|2}},<ref>{{cite journal|doi =10.1007/s11669-009-9636-5|title =Cs-O (Cesium-Oxygen)|date =2009|last1 =Okamoto|first1 =H.|journal =Journal of Phase Equilibria and Diffusion|volume =31|pages =86–87|s2cid =96084147}}</ref> और साथ ही {{chem|Cs|7|O|2}} शामिल हैं।<ref>{{cite journal|doi = 10.1021/jp036432o|title = Characterization of Oxides of Cesium|date = 2004|last1 = Band|first1 = A.|last2 = Albu-Yaron|first2 = A.|last3 = Livneh|first3 = T.|last4 = Cohen|first4 = H.|last5 = Feldman|first5 = Y.|last6 = Shimon|first6 = L.|last7 = Popovitz-Biro|first7 = R.|last8 = Lyahovitskaya|first8 = V.|last9 = Tenne|first9 = R.|journal = The Journal of Physical Chemistry B|volume = 108|pages = 12360–12367|issue = 33}}</ref><ref>{{cite journal|doi =10.1002/zaac.19472550110|title =Untersuchungen ber das System Csium-Sauerstoff|date =1947|last1 =Brauer|first1 =G.|journal =Zeitschrift für Anorganische Chemie|volume =255|issue =1–3|pages =101–124}}</ref> उत्तरार्द्ध को {{chem|Cs|2|O}} उत्पन्न करने के लिए निर्वात में गर्म किया जाता है।<ref name="ReferenceA" /> सल्फर, [[ सेलेनियम |सेलेनियम]], और टेल्यूरियम के साथ द्वयंगी यौगिक भी उपस्थित होते है।<ref name="USGS" /> | |||
=== समस्थानिक === | |||
{{Main|सीज़ियम के समस्थानिक}} | |||
सीज़ियम में 40 ज्ञात समस्थानिक हैं, जिनकी द्रव्यमान संख्या (अर्थात् नाभिक में [[ न्युक्लियोन |न्यूक्लियंस]] की संख्या) 112 से 151 तक है। इनमें से कई पुराने सितारों के अंदर मंद न्यूट्रॉन कैप्चर प्रक्रिया ([[ एस-प्रक्रिया |S-प्रक्रिया]]) द्वारा हल्के तत्वों से संश्लेषित किए जाते हैं<ref>{{cite journal|doi=10.1146/annurev.astro.37.1.239|author=Busso, M.|author2=Gallino, R.|author3=Wasserburg, G. J.|title=Nucleosynthesis in Asymptotic Giant Branch Stars: Relevance for Galactic Enrichment and Solar System Formation|journal=Annual Review of Astronomy and Astrophysics|volume=37|date=1999|pages=239–309|url=http://authors.library.caltech.edu/1194/1/BUSaraa99.pdf|access-date=2010-02-20|bibcode=1999ARA&A..37..239B}}</ref> और सुपरनोवा विस्फोटों में [[ आर-प्रक्रिया |R-प्रक्रिया]] द्वारा।<ref>{{cite book|first=David|last=Arnett|date=1996|title=Supernovae and Nucleosynthesis: An Investigation of the History of Matter, from the Big Bang to the Present|publisher=Princeton University Press|page=527|isbn=978-0-691-01147-9}}</ref> 78 [[ न्यूट्रॉन |न्यूट्रॉन]] के साथ एकमात्र स्थायी सीज़ियम समस्थानिक <sup>133</sup>Cs है। यद्यपि इसमें एक बड़ा [[ परमाणु स्पिन |नाभिकीय स्पिन]] ({{sfrac|7|2}}+) है, नाभिकीय चुंबकीय अनुनाद अध्ययन इस समस्थानिक का उपयोग 11.7 [[ हेटर्स |MHz]] की प्रतिध्वनि आवृत्ति पर कर सकता है।<ref name="NMR">{{cite journal|doi=10.1016/0277-5387(96)00018-6|title=Complexation of caesium and rubidium cations with crown ethers in N,N-dimethylformamide|date=1996|last1=Goff|first1=C.|journal=Polyhedron|volume=15|pages=3897–3903|last2=Matchette|first2=Michael A.|last3=Shabestary|first3=Nahid|last4=Khazaeli|first4=Sadegh|issue=21}}</ref> | |||
[[ सीज़ियम | [[File:Cs-137-decay.svg|thumb|सीज़ियम-137 का क्षय|alt=सीज़ियम-137 की ऊर्जाओं को दर्शाने वाला एक ग्राफ (परमाणु स्पिन: I={{sfrac|7|2}}+, लगभग 30 वर्षों का आधा जीवन) क्षय। 94.6% संभावना के साथ, यह 512 केवी बीटा उत्सर्जन से बेरियम-137m (I=11/2-, t=2.55मिनट) में कम हो जाता है; यह बेरियम-137 (I=) में 85.1% संभावना के साथ 662 केवी गामा उत्सर्जन से और कम हो जाता है{{sfrac|3|2}}+)। वैकल्पिक रूप से, सीज़ियम-137 0.4% संभाव्यता बीटा उत्सर्जन द्वारा सीधे बेरियम-137 में क्षय हो सकता है।]] | ||
रेडियोधर्मी <sup>135</sup>Cs का लगभग 2.3 मिलियन वर्षों की बहुत लंबा अर्ध आयु होती है, जो सीज़ियम के सभी रेडियोधर्मी समस्थानिकों में सबसे लंबा है। <sup>137</sup>Cs और <sup>134</sup>Cs में क्रमशः 30 और दो वर्ष की अर्ध आयु होती है। <sup>137</sup>Cs [[ बीटा क्षय |बीटा क्षय]] द्वारा अल्पकालिक <sup>137m</sup>Ba और फिर गैर-रेडियोधर्मी बेरियम में विघटित हो जाता है, जबकि <sup>134</sup>Cs सीधे <sup>134</sup>Ba में बदल जाता है। 129, 131, 132 और 136 की द्रव्यमान संख्या वाले समस्थानिकों का अर्ध आयु एक दिन और दो सप्ताह के बीच होता है, जबकि अधिकांश अन्य समस्थानिकों का अर्ध आयु कुछ सेकंड से लेकर एक सेकंड के अंश तक होता है। कम से कम 21 मितस्थायी (मेटास्टेबल) नाभिकीय समायवयव मौजूद हैं। <sup>134m</sup>Cs के अलावा (सिर्फ 3 घंटे से कम के अर्ध आयु के साथ), सभी बहुत अस्थिर हैं और कुछ मिनटों या उससे कम के अर्ध आयु के साथ क्षय होते हैं।<ref>{{cite journal|doi = 10.1016/0022-1902(55)80027-9|title = The half-life of Cs137|date = 1955|last1 = Brown|first1 = F.|last2 = Hall|first2 = G. R.|last3 = Walter|first3 = A. J.|journal = Journal of Inorganic and Nuclear Chemistry|volume = 1|pages = 241–247|issue = 4–5|bibcode = 1955PhRv...99..188W}}</ref><ref name="nuclidetable">{{cite web|url=http://www.nndc.bnl.gov/chart/|title=Interactive Chart of Nuclides|publisher=Brookhaven National Laboratory|author=Sonzogni, Alejandro|location=National Nuclear Data Center|access-date=2008-06-06|archive-date=2008-05-22|archive-url=https://web.archive.org/web/20080522125027/http://www.nndc.bnl.gov/chart|url-status=dead}}</ref> | |||
समस्थानिक <sup>135</sup>Cs परमाणु रिएक्टरों में उत्पादित यूरेनियम के [[ लंबे समय तक रहने वाले विखंडन उत्पाद |दीर्घकालिक विखंडन उत्पादों]] में से एक है।<ref>{{cite conference|conference = Seventh Information Exchange Meeting on Actinide and Fission Product Partitioning and Transmutation|date = 14–16 October 2002|place = Jeju, Korea|first1 = Shigeo|last1 = Ohki|first2 = Naoyuki|last2 = Takaki|title = Transmutation of Cesium-135 with Fast Reactors|url = http://www.oecd-nea.org/pt/docs/iem/jeju02/session6/SessionVI-08.pdf|access-date = 2010-09-26|archive-date = 2011-09-28|archive-url = https://web.archive.org/web/20110928005357/http://www.oecd-nea.org/pt/docs/iem/jeju02/session6/SessionVI-08.pdf|url-status = dead}}</ref> हालांकि, अधिकांश रिएक्टरों में इस विखंडन उत्पाद की उपज कम हो जाती है क्योंकि पूर्ववर्ती, <sup>135</sup>Xe, प्रभावकारी [[ न्यूट्रॉन जहर |न्यूट्रॉन घातक]] है और <sup>135</sup>Cs तक क्षय होने से पहले अक्सर स्थिर <sup>136</sup>Xe में परिवर्तित हो जाता है।<ref>{{cite report|chapter-url=http://canteach.candu.org/library/20040720.pdf |title=CANDU Fundamentals |publisher=[[CANDU Owners Group]] Inc. |chapter=20 Xenon: A Fission Product Poison |access-date=2010-09-15 |url-status=dead |archive-url=https://web.archive.org/web/20110723231319/http://canteach.candu.org/library/20040720.pdf |archive-date=July 23, 2011 }}</ref><ref>{{cite journal|journal = Journal of Environmental Radioactivity|title = Preliminary evaluation of <sup>135</sup>Cs/<sup>137</sup>Cs as a forensic tool for identifying source of radioactive contamination|first1 = V. F.|last1= Taylor|first2 = R. D.|last2 = Evans|first3 = R. J.|last3= Cornett|doi = 10.1016/j.jenvrad.2007.07.006 |volume = 99 |issue = 1|date = 2008|pages = 109–118|pmid = 17869392}}</ref> | |||
<sup>137</sup>Cs से <sup>137m</sup>Ba तक बीटा क्षय [[ गामा किरण |गामा विकिरण]] का एक प्रबल उत्सर्जन होता है।<ref>{{cite web|url=http://www.epa.gov/rpdweb00/radionuclides/cesium.html |title=Cesium {{pipe}} Radiation Protection |publisher=U.S. Environmental Protection Agency |date=2006-06-28 |access-date=2010-02-15 |url-status=dead |archive-url=https://web.archive.org/web/20110315034747/http://www.epa.gov/rpdweb00/radionuclides/cesium.html |archive-date=March 15, 2011 }}</ref> <sup>137</sup>Cs और <sup>90</sup>Sr [[ परमाणु विखंडन |परमाणु विखंडन]] के प्रमुख [[ मध्यम-जीवित विखंडन उत्पाद |मध्यम-जीवित]] उत्पाद हैं, और कई सौ वर्षों तक चलने वाले शीतलन के कई वर्षों के बाद खर्च किए गए परमाणु ईंधन से [[ रेडियोधर्मी क्षय |रेडियोधर्मिता]] के प्रमुख स्रोत हैं।<ref>{{cite report|url=http://www.ieer.org/reports/transm/hisham.html |title=IEER Report: Transmutation – Nuclear Alchemy Gamble |publisher=Institute for Energy and Environmental Research |date=2000-05-24 |access-date=2010-02-15|first=Hisham|last=Zerriffi}}</ref> [[ चेरनोबिल आपदा |चेरनोबिल आपदा]] के क्षेत्र में वे दो समस्थानिक अवशिष्ट रेडियोधर्मिता का सबसे बड़ा स्रोत हैं।<ref>{{cite report|url=http://www.iaea.org/Publications/Booklets/Chernobyl/chernobyl.pdf |title=Chernobyl's Legacy: Health, Environmental and Socia-Economic Impacts and Recommendations to the Governments of Belarus, Russian Federation and Ukraine |publisher=International Atomic Energy Agency |access-date=2010-02-18 |url-status=dead |archive-url=https://web.archive.org/web/20100215212227/http://www.iaea.org/Publications/Booklets/Chernobyl/chernobyl.pdf |archive-date=2010-02-15 }}</ref> कम कैप्चर दर के कारण, [[ न्यूट्रॉन कैप्चर |न्यूट्रॉन कैप्चर]] के माध्यम से <sup>137</sup>Cs प्रवृत्त करना संभव नहीं है और इसका एकमात्र वर्तमान समाधान समय के साथ इसे क्षय होने देना है।<ref>{{cite journal|doi=10.3327/jnst.30.911| title = Transmutation of Cesium-137 Using Proton Accelerator|first1 = Takeshi|last1= Kase|first2 = Kenji|last2= Konashi|first3 = Hiroshi|last3 = Takahashi|first4 = Yasuo|last4= Hirao|volume = 30|issue = 9|date = 1993|pages = 911–918|journal = Journal of Nuclear Science and Technology|doi-access = free}}</ref> | |||
वे सीज़ियम जो नाभिकीय विखंडन से उत्पादित है, मूल रूप से अधिक न्यूट्रॉन युक्त विखंडन उत्पादों के बिटा क्षय से प्राप्त होते है, जो ज़िनॉन और [[ क्सीनन के समस्थानिक |आयोडीन के विभिन्न समस्थानिकों]] से गुजरते हैं।<ref>{{cite book|isbn = 978-1-56032-088-3|publisher = Taylor & Francis|date = 1992|first = Ronald Allen|last = Knief|chapter-url = https://books.google.com/books?id=EpuaUEQaeoUC&pg=PA43|page= 42|chapter = Fission Fragments|title = Nuclear engineering: theory and technology of commercial nuclear power}}</ref> क्योंकि आयोडीन और ज़िनॉन अस्थिर होते हैं और परमाणु ईंधन या वायु के माध्यम से फैल सकते हैं, रेडियोधर्मी सीज़ियम अक्सर विखंडन की मूल साइट से बहुत दूर बनाया जाता है।<ref>{{cite journal|title = Release of xenon-137 and iodine-137 from UO2 pellet by pulse neutron irradiation at NSRR|last1 = Ishiwatari|first1 = N.|last2 = Nagai|first2 = H.|pages = 843–850|volume = 23|issue = 11|journal = Nippon Genshiryoku Gakkaishi|osti = 5714707}}</ref> 1950 के दशक में 1980 के दशक में परमाणु हथियारों के परीक्षण के साथ, <sup>137</sup>Cs को वायुमंडल में छोड़ा गया और रेडियोधर्मी अवपात के एक घटक के रूप में पृथ्वी की सतह पर लौट आया। यह उस समय से मिट्टी और तलछट की गति का एक तैयार अंकन (मार्कर) है।<ref name="USGS" /> | |||
=== | === उपस्थिति === | ||
[[File:Pollucite-RoyalOntarioMuseum-Jan18-09.jpg|thumb|पोलुसाइट, एक सीज़ियम खनिज|alt=एक सफेद खनिज, जिसमें से सफेद और हल्के गुलाबी क्रिस्टल निकलते हैं]] | [[File:Pollucite-RoyalOntarioMuseum-Jan18-09.jpg|thumb|पोलुसाइट, एक सीज़ियम खनिज|alt=एक सफेद खनिज, जिसमें से सफेद और हल्के गुलाबी क्रिस्टल निकलते हैं]] | ||
{{See also|: | {{See also|:श्रेणी:सीज़ियम खनिज|l1=सीज़ियम खनिज}} | ||
सीज़ियम एक अपेक्षाकृत दुर्लभ तत्व है, जिसका अनुमान | सीज़ियम एक अपेक्षाकृत दुर्लभ तत्व है, जिसका अनुमान भू पर्पटी में प्रति मिलियन औसतन 3 भाग है।<ref>{{cite journal|last1=Turekian|first1=K. K.|last2=Wedepohl|first2=K. H.|title=Distribution of the elements in some major units of the Earth's crust|journal=Geological Society of America Bulletin|volume=72|issue=2|pages=175–192|doi=10.1130/0016-7606(1961)72[175:DOTEIS]2.0.CO;2|issn=0016-7606|bibcode = 1961GSAB...72..175T |year=1961|doi-access=free}}</ref> यह 45वां सबसे प्रचुर तत्व है और धातुओं में 36वां है। फिर भी, यह ऐन्टिमनी, कैडमियम, टिन और टंगस्टन जैसे तत्वों की तुलना में अधिक प्रचुर मात्रा में होता है, और पारा और [[ चांदी |चांदी]] की तुलना में परिमाण के दो क्रम अधिक प्रचुर मात्रा में हैं, यह रुबिडियम के रूप में 3.3% प्रचुर मात्रा में है, जिसके साथ यह रासायनिक रूप से निकटता से जुड़ा हुआ है।<ref name="USGS" /> | ||
अपने बड़े आयनिक त्रिज्या के कारण, सीज़ियम [[ असंगत तत्व ]] | अपने बड़े आयनिक त्रिज्या के कारण, सीज़ियम "[[ असंगत तत्व |असंगत तत्वों]]" में से एक है।<ref>{{cite web|url=http://www.asi.org/adb/02/13/02/cesium-occurrence-uses.html|title=Cesium as a Raw Material: Occurrence and Uses|first=Simon|last=Rowland|publisher=Artemis Society International|date=1998-07-04|access-date=2010-02-15}}</ref> [[ आंशिक क्रिस्टलीकरण (भूविज्ञान) |मैग्मा क्रिस्टलीकरण]] के दौरान, सीज़ियम तरल प्रावस्था में सांद्रित होता है और अंतिम क्रिस्टलीकरण करता है। इसलिए, सीज़ियम का सबसे बड़ा भंडार इस संवर्धन प्रक्रिया द्वारा गठित ज़ोन [[ पेग्माटाइट |पेग्माटाइट]] अयस्क निकाय हैं। चूंकि सीज़ियम पोटाशियम को उतनी आसानी से प्रतिस्थापित नहीं करता जितना रूबिडियम करता है, क्षार वाष्पित खनिज सिल्वाइट (KCl) और [[ कार्नेलाइट |कार्नेलाइट]] ({{chem|KMgCl|3|·6H|2|O}}) में केवल 0.002% सीज़ियम हो सकता है। परिणामस्वरूप, सीज़ियम कुछ खनिजों में पाया जाता है। सीज़ियम की प्रतिशत मात्रा बेरिल ({{chem|Be|3|Al|2|(SiO|3|)|6}}) और [[ अवोगाद्राइट |अवोगाद्राइट]] ({{chem|(K,Cs)BF|4}}) में पाई जा सकती है, 15 wt% Cs<sub>2</sub>O तक बारीकी से संबंधित खनिज [[ pezzottaite |पेज़ोटाटाइट]] ({{chem|Cs|(Be|2|Li)|Al|2|Si|6|O|18}}) में, 8.4 तक wt% Cs2O दुर्लभ खनिज [[ लंदन |लोंडोनाईट]] में ({{chem|(Cs,K)Al|4|Be|4|(B,Be)|12|O|28}}), और अधिक व्यापक [[ रोडोडेंड्रोन |रोडिज़ाइट]] में कम।<ref name="USGS" /> सीज़ियम के लिए एकमात्र आर्थिक रूप से महत्वपूर्ण अयस्क पॉल्युसाइट {{chem|Cs(AlSi|2|O|6|)}} है, जो दुनिया भर में कुछ स्थानों पर ज़ोनड पेगमाटाइट्स में पाया जाता है, जो कि अधिक व्यावसायिक रूप से महत्वपूर्ण [[ लिथियम |लिथियम]] खनिजों, [[ लेपिडोलाइट |लेपिडोलाइट]] और [[ पंखुड़ी |पेटलाइट]] से जुड़ा है। पेग्माटाइट्स के भीतर, बड़े अनाज के आकार और खनिजों के मजबूत पृथक्करण के परिणामस्वरूप खनन के लिए उच्च श्रेणी का अयस्क प्राप्त होता है।<ref name="Cerny">{{cite journal|title=The Tanco Pegmatite at Bernic Lake, Manitoba: X. Pollucite|first1=Petr|last1=Černý|author-link1=Petr Černý|first2=F. M.|last2=Simpson|journal=Canadian Mineralogist|volume=16|pages=325–333|date=1978|url=http://rruff.geo.arizona.edu/doclib/cm/vol38/CM38_877.pdf|access-date=2010-09-26}}</ref> | ||
सीज़ियम का दुनिया का सबसे महत्वपूर्ण और सबसे समृद्ध ज्ञात स्रोत, [[ मैनिटोबा |मैनिटोबा]], कनाडा में [[ बर्निक झील |बर्निक झील]] में टैंको खदान है, जिसमें अनुमानित रूप से 350,000 मीट्रिक टन पॉल्युसाइट अयस्क है, जो दुनिया के आरक्षित क्षार के दो-तिहाई से अधिक का प्रतिनिधित्व करता है।<ref name="Cerny" /><ref name="USGS-Cs2">{{cite web|title=Cesium|last=Polyak|first=Désirée E.|url=http://minerals.usgs.gov/minerals/pubs/commodity/cesium/mcs-2009-cesiu.pdf|publisher=U.S. Geological Survey|access-date = 2009-10-17}}</ref> हालांकि पॉल्युसाइट में सीज़ियम की स्टोइकोमेट्रिक सामग्री 42.6% है, इस एकत्रित से शुद्ध पॉल्युसाइट नमूनों में केवल 34% सीज़ियम होता है, जबकि औसत सामग्री 24 wt% होती है।<ref name="USGS-Cs2" /> वाणिज्यिक पॉल्युसाइट में 19% से अधिक सीज़ियम होता है।<ref>{{cite book|last=Norton|first=J. J.|date=1973|chapter=Lithium, cesium, and rubidium—The rare alkali metals|editor=Brobst, D. A.|editor2=Pratt, W. P.|title=United States mineral resources|publisher=U.S. Geological Survey Professional|volume=Paper 820|pages=365–378|chapter-url=https://pubs.er.usgs.gov/usgspubs/pp/pp820|access-date=2010-09-26|archive-date=2010-07-21|archive-url=https://web.archive.org/web/20100721060544/http://pubs.er.usgs.gov/usgspubs/pp/pp820|url-status=dead}}</ref> ज़िम्बाब्वे में [[ बिकिता जिला |बिकिता]] पेगमाटाइट एकत्रित को इसके पेटलाइट के लिए खनन किया जाता है, लेकिन इसमें महत्वपूर्ण मात्रा में प्रदूषण भी होता है। पॉल्युसाइट का एक और उल्लेखनीय स्रोत [[ नामिबिया |नामिबिया]] के [[ एरोंगो क्षेत्र |करीबिब रेगिस्तान]] में है।<ref name="USGS-Cs2" /> प्रति वर्ष 5 से 10 मीट्रिक टन की विश्व खदान उत्पादन की वर्तमान दर पर, भंडार हजारों वर्षों तक चलेगा।<ref name="USGS" /> | |||
==उत्पादन== | |||
पॉल्युसाइट अयस्क का खनन और शोधन छोटे पैमाने पर किया जाता है जो की एक चयनात्मक प्रक्रिया है। अयस्क को बारीक टुकड़ो में तोड़ा जाता है, हाथ से छांटा जाता है, लेकिन आमतौर पर सांद्रित नहीं किया जाता है, और फिर जमीन में डाला जाता है। तब सीज़ियम को मुख्य रूप से तीन तरीकों से पॉल्युसाइट निकाला जाता है: अम्ल पाचन, क्षारीय अपघटन, और प्रत्यक्ष अपचयन।<ref name="USGS" /><ref name="Burt">{{cite book|last = Burt|first = R. O.|date = 1993|chapter = Caesium and cesium compounds|title = Kirk-Othmer encyclopedia of chemical technology|edition = 4th|place = New York|publisher = John Wiley & Sons, Inc.|volume = 5|pages = 749–764|isbn = 978-0-471-48494-3}}</ref> | |||
अम्ल पाचन में, [[ सिलिकेट |सिलिकेट]] पॉलुसाइट रॉक [[ हाइड्रोक्लोरिक एसिड |हाइड्रोक्लोरिक]] (HCl), सल्फ्यूरिक ({{chem|H|2|SO|4}}), [[ हाइड्रोब्रोमिक एसिड |हाइड्रोब्रोमिक]] (HBr), या [[ हाइड्रोफ्लुओरिक अम्ल |हाइड्रोफ्लोरिक]] (HF) जैसे प्रबल अम्ल के साथ विलीन किया जाता है। हाइड्रोक्लोरिक अम्ल के साथ, घुलनशील क्लोराइड का मिश्रण तैयार किया जाता है, और सीज़ियम के अघुलनशील क्लोराइड द्विक लवण को सीज़ियम एंटीमोनी क्लोराइड ({{chem|Cs|4|SbCl|7}}), सीज़ियम आयोडीन क्लोराइड ({{chem|Cs|2|ICl}}), या सीज़ियम हेक्साक्लोरोसेरेट ({{chem|Cs|2|(CeCl|6|)}}) के रूप में अवक्षेपित किया जाता है। अलग होने के बाद, शुद्ध अवक्षेपित द्विक लवण विघटित हो जाता है, और शुद्ध CsCl जल को वाष्पित करके अवक्षेपित हो जाता है। | |||
सल्फ्यूरिक | सल्फ्यूरिक अम्ल विधि से अघुलनशील द्विक लवण सीधे सीज़ियम फिटकरी ({{chem|CsAl(SO|4|)|2|·12H|2|O}}) के रूप में प्राप्त होता है। फिटकरी को [[ कार्बन |कार्बन]] के साथ भर्जित [[ एल्यूमीनियम सल्फेट |एल्यूमीनियम सल्फेट]] घटक अघुलनशील [[ अल्यूमिनियम ऑक्साइड |अल्यूमिनियम ऑक्साइड]] में परिवर्तित हो जाता है, और परिणामी उत्पाद को {{chem|Cs|2|SO|4}} मिश्रण प्राप्त करने के लिए जल से निक्षालित किया जाता है।<ref name="USGS" /> | ||
पॉल्युसाइट को [[ कैल्शियम कार्बोनेट ]] और [[ कैल्शियम क्लोराइड ]] के साथ | पॉल्युसाइट को [[ कैल्शियम कार्बोनेट |कैल्शियम कार्बोनेट]] और [[ कैल्शियम क्लोराइड |कैल्शियम क्लोराइड]] के साथ भर्जन से अघुलनशील कैल्शियम सिलिकेट और घुलनशील सीज़ियम क्लोराइड प्राप्त होता है। जल या तनु [[ अमोनिया |अमोनिया]] ({{chem|NH|4|OH}}) के साथ लीचिंग करने से तनु क्लोराइड (CsCl) मिश्रण प्राप्त होता है। सीज़ियम क्लोराइड का उत्पादन करने के लिए इस मिश्रण को वाष्पित किया जा सकता है या सीज़ियम फिटकरी या सीज़ियम कार्बोनेट में परिवर्तित किया जा सकता है। हालांकि व्यावसायिक रूप से साध्य नहीं है, अयस्क को सीधे सीज़ियम धातु का उत्पादन करने के लिए निर्वात में पोटेशियम, सोडियम, या कैल्शियम के साथ सीधे कम किया जा सकता है।<ref name="USGS" /> | ||
अधिकांश खनन किए गए सीज़ियम (लवण के रूप में) | अधिकांश खनन किए गए सीज़ियम (लवण के रूप में) को [[ तेल कुएं में ड्रिलिंग |तेल प्रवेधन]] जैसे अनुप्रयोगों के लिए सीधे सीज़ियम प्रारूप (HCOO<sup>−</sup>Cs<sup>+</sup>) में बदल दिया जाता है। विकासशील व्यापार की आपूर्ति के लिए, [[ कैबोट कॉर्पोरेशन |कैबोट निगम]] ने 1997 में मैनिटोबा में बर्निक झील के पास टैंको खदान में {{convert|12000|oilbbl|m3}} प्रति वर्ष सीज़ियम प्रारूप समाधान की क्षमता के साथ एक उत्पादन संयंत्र बनाया।<ref>{{cite journal|last1 = Benton|first1 = William|last2 = Turner| first2 = Jim|date = 2000|title = Cesium formate fluid succeeds in North Sea HPHT field trials|journal = Drilling Contractor|issue = May/June|pages = 38–41|url = http://www.iadc.org/dcpi/dc-mayjun00/m-cabot.pdf|access-date=2010-09-26}}</ref> सीज़ियम के प्राथमिक छोटे पैमाने के व्यावसायिक यौगिक [[ सीज़ियम नाइट्रेट |सीज़ियम नाइट्रेट]] और क्लोराइड हैं।<ref name="CEC">{{cite book|isbn = 978-3-11-011451-5|url = https://books.google.com/books?id=Owuv-c9L_IMC&pg=PA198|page = 198|others = Eagleson, Mary |editor=Eagleson, Mary |year = 1994|publisher = de Gruyter|location = Berlin|title = Concise encyclopedia chemistry}}</ref> | ||
वैकल्पिक रूप से, अयस्क से प्राप्त शुद्ध यौगिकों से | वैकल्पिक रूप से, सीज़ियम धातु अयस्क से प्राप्त शुद्ध यौगिकों से प्राप्त की जा सकती है। सीज़ियम क्लोराइड और अन्य [[ सीज़ियम हैलाइड |सीज़ियम हलाइड्स]] को कैल्शियम या बेरियम के साथ {{convert|700|to|800|°C|°F}} तक कम किया जा सकता है, और सीज़ियम धातु परिणाम से आसुत हो सकती है। उसी तरह, [[ मैग्नीशियम |मैग्नीशियम]] द्वारा एल्यूमिनेट, कार्बोनेट या हाइड्रोक्साइड को कम किया जा सकता है।<ref name="USGS" /> | ||
संगलित (फ़्यूज़्ड) सीज़ियम [[ साइनाइड |साइनाइड]] (CsCN) के [[ इलेक्ट्रोलीज़ |विद्युत् अपघटन]] द्वारा धातु को भी अलग किया जा सकता है। असाधारण रूप से शुद्ध और गैस मुक्त सीज़ियम का उत्पादन सीज़ियम एज़ाइड {{chem|CsN|3}} के 390 °C (734 °F) ऊष्मीय अपघटन द्वारा किया जा सकता है, जिसे जलीय [[ सीज़ियम सल्फेट |सीज़ियम सल्फेट]] और [[ बेरियम एज़ाइड |बेरियम एज़ाइड]] से उत्पादित किया जा सकता है।<ref name="Burt" /> निर्वात अनुप्रयोगों में, अन्य गैसीय उत्पादों के बिना शुद्ध सीज़ियम धातु का उत्पादन करने के लिए ज़िरकोनियम के साथ सीज़ियम [[ डाइक्रोमेट |डाइक्रोमेट]] की अभिक्रिया की जा सकती है।<ref name="CEC" /> | |||
:{{chem|Cs|2|Cr|2|O|7}} + 2 {{chem|Zr}} → 2 {{chem|Cs}} + 2 {{chem|ZrO|2}}+ {{chem|Cr|2|O|3}} | :{{chem|Cs|2|Cr|2|O|7}} + 2 {{chem|Zr}} → 2 {{chem|Cs}} + 2 {{chem|ZrO|2}}+ {{chem|Cr|2|O|3}} | ||
2009 में 99.8% शुद्ध सीज़ियम (धातु आधार) की कीमत लगभग | 2009 में 99.8% शुद्ध सीज़ियम (धातु आधार) की कीमत लगभग {{convert|10|$/g|$/oz|-1}} थी, लेकिन यौगिक काफी सस्ते हैं।<ref name="USGS-Cs2" /> | ||
==इतिहास== | ==इतिहास== | ||
[[File:Kirchhoff Bunsen Roscoe.jpg|thumb|गुस्ताव किरचॉफ (बाएं) और रॉबर्ट बन्सन (बीच में) ने अपने नए आविष्कृत स्पेक्ट्रोस्कोप से सीज़ियम की खोज की। alt= तीन मध्यम आयु वर्ग के पुरुष, जिनमें से एक बीच में बैठा है। सभी लंबी जैकेट पहनते हैं, और बाईं ओर छोटे आदमी की दाढ़ी है।]] | [[File:Kirchhoff Bunsen Roscoe.jpg|thumb|गुस्ताव किरचॉफ (बाएं) और रॉबर्ट बन्सन (बीच में) ने अपने नए आविष्कृत स्पेक्ट्रोस्कोप से सीज़ियम की खोज की। alt= तीन मध्यम आयु वर्ग के पुरुष, जिनमें से एक बीच में बैठा है। सभी लंबी जैकेट पहनते हैं, और बाईं ओर छोटे आदमी की दाढ़ी है।]] | ||
1860 में, रॉबर्ट | 1860 में, रॉबर्ट बुन्सेन और गुस्ताव किरचॉफ ने जर्मनी के दुर्खीम से खनिज जल में सीज़ियम की खोज की। उत्सर्जन वर्णक्रम (स्पेक्ट्रम) में चमकदार नीली रेखाओं के कारण, उन्होंने यह नाम [[ लैटिन |लैटिन]] शब्द कैसियस से लिया है, जिसका अर्थ है आकाश-नीला।<ref group="note">Bunsen quotes [[Aulus Gellius|Aulus Gellius Noctes Atticae]] II, 26 by [[Nigidius Figulus]]: ''Nostris autem veteribus caesia dicts est quae Graecis, ut Nigidus ait, de colore coeli quasi coelia.''</ref><ref>[[Oxford English Dictionary]], 2nd Edition</ref><ref name="BuKi1861">{{cite journal |title = Chemische Analyse durch Spectralbeobachtungen |pages = 337–381 |first1 = G.|last1 = Kirchhoff |first2 = R.|last2 = Bunsen|author-link1 = Gustav Kirchhoff|author-link2 = Robert Bunsen|doi = 10.1002/andp.18611890702 |journal = [[Annalen der Physik|Annalen der Physik und Chemie]] |volume = 189 |issue = 7|date = 1861|bibcode = 1861AnP...189..337K|url = http://archiv.ub.uni-heidelberg.de/volltextserver/15657/1/spektral.pdf|hdl = 2027/hvd.32044080591324 }}</ref><ref name="Weeks">{{cite journal |title = The discovery of the elements. XIII. Some spectroscopic discoveries |pages = 1413–1434|last = Weeks|first = Mary Elvira |author-link=Mary Elvira Weeks|doi=10.1021/ed009p1413|journal = [[Journal of Chemical Education]] |volume =9 |issue =8 |date = 1932|bibcode = 1932JChEd...9.1413W}}</ref> सीज़ियम पहला तत्व था जिसे [[ स्पेक्ट्रोस्कोपी |स्पेक्ट्रोस्कोप]] के साथ खोजा गया था , जिसका आविष्कार बन्सन और किरचॉफ ने एक साल पहले ही किया था।<ref name="autogenerated1" /> | ||
सीज़ियम का शुद्ध नमूना प्राप्त करने के लिए, {{convert|44,000|litre}} खनिज जल को {{convert|240|kg}} सांद्रित लवण मिश्रण प्राप्त करने के लिए वाष्पित किया जाता है। क्षारीय मृदा धातुओं को या तो सल्फेट्स या [[ ऑक्सालेट |ऑक्सालेट]] के रूप में अवक्षेपित किया जा सकता है, क्षार धातु को विलयन में छोड़ देते है। नाइट्रेट्स में रूपांतरण और [[ इथेनॉल |इथेनॉल]] के साथ निष्कर्षण के बाद, सोडियम मुक्त मिश्रण प्राप्त होता है। इस मिश्रण से लिथियम [[ अमोनियम कार्बोनेट |अमोनियम कार्बोनेट]] द्वारा अवक्षेपित होता है। पोटेशियम, रूबिडियम और सीज़ियम [[ क्लोरोप्लाटिनिक अम्ल |क्लोरोप्लाटिनिक अम्ल]] के साथ अघुलनशील लवण बनाते हैं, लेकिन ये लवण गर्म जल में घुलनशीलता में थोड़ा अंतर दिखाते हैं, और कम घुलनशील सीज़ियम और रूबिडियम हेक्साक्लोरोप्लाटिनेट ((Cs,Rb)<sub>2</sub>PtCl<sub>6</sub>) [[ भिन्नात्मक क्रिस्टलीकरण (रसायन विज्ञान) |भिन्नात्मक क्रिस्टलीकरण]] द्वारा प्राप्त किए जाते है। [[ हाइड्रोजन |हाइड्रोजन]] के साथ हेक्साक्लोरोप्लाटिनेट की कमी के बाद, सीज़ियम और रूबिडियम को एल्कोहल में उनके कार्बोनेट की घुलनशीलता के अंतर से अलग किया गया। इस प्रक्रिया से शुरुआती 44,000 लीटर खनिज जल से {{convert|9.2|g}} [[ रूबिडियम क्लोराइड |रूबिडियम क्लोराइड]] और {{convert|7.3|g}} सीज़ियम क्लोराइड प्राप्त होता है।<ref name="BuKi1861" /> | |||
सीज़ियम क्लोराइड से, दोनों वैज्ञानिकों ने नए तत्व के परमाणु भार का अनुमान 123.35 (वर्तमान में स्वीकृत 132.9 की तुलना में) पर लगाया।<ref name="BuKi1861" /> उन्होंने पिघले हुए सीज़ियम क्लोराइड के विद्युत् अपघटन द्वारा मौलिक सीज़ियम उत्पन्न करने का प्रयास किया, लेकिन एक धातु के बजाय, उन्होंने एक नीला सजातीय पदार्थ प्राप्त किया, जो "न तो नग्न आंखों के नीचे और न ही माइक्रोस्कोप के तहत धातु पदार्थ का साधारण चिन्ह दिखाया", परिणामस्वरूप, उन्होंने इसे एक सबक्लोराइड ({{chem|Cs|2|Cl}}) के रूप में निर्दिष्ट किया। वास्तव में, उत्पाद संभवतः धातु और सीज़ियम क्लोराइड का एक [[ कोलाइड |कोलाइडयन]] मिश्रण था।<ref>{{cite book|last=Zsigmondy|first=Richard |title=Colloids and the Ultra Microscope|publisher=Read books|date=2007|isbn=978-1-4067-5938-9|page=69|url=https://books.google.com/books?id=Ac2mGhqjgUkC&pg=PAPA69}}</ref> एक पारा कैथोड के साथ क्लोराइड के जलीय मिश्रण के इलेक्ट्रोलिसिस ने एक सीज़ियम अमलगम का उत्पादन किया जो जलीय परिस्थितियों में आसानी से विघटित हो गया।<ref name="BuKi1861" /> शुद्ध धातु को अंततः जर्मन रसायनज्ञ [[ कार्ल सेटरबर्ग |कार्ल सेटरबर्ग]] द्वारा केकुले और बन्सन के साथ डॉक्टरेट की उपाधि प्राप्त करने के दौरान अलग कर दिया गया था।<ref name="Weeks" /> 1882 में, उन्होंने [[ सीज़ियम साइनाइड |सीज़ियम साइनाइड]] के इलेक्ट्रोलाइज़िंग द्वारा सीज़ियम धातु का उत्पादन किया, क्लोराइड के साथ समस्याओं से बचा।<ref name="Sett">{{cite journal |title =Ueber die Darstellung von Rubidium- und Cäsiumverbindungen und über die Gewinnung der Metalle selbst|doi =10.1002/jlac.18822110105 |date =1882 |last1 =Setterberg |first1 =Carl |journal =Justus Liebig's Annalen der Chemie |volume =211 |pages =100–116|url =https://zenodo.org/record/1447367 }}</ref> | |||
ऐतिहासिक रूप से, सीज़ियम का सबसे महत्वपूर्ण उपयोग अनुसंधान और विकास में किया गया है, मुख्य रूप से रासायनिक और विद्युत क्षेत्रों में। 1920 के दशक तक सीज़ियम के लिए बहुत कम अनुप्रयोग मौजूद थे, जब यह रेडियो निर्वात नलिका में उपयोग में आया, जहां इसके दो कार्य थे, एक गेट्टर के रूप में, यह निर्माण के बाद अतिरिक्त ऑक्सीजन को हटा देता है, और गर्म [[ कैथोड |कैथोड]] पर एक कोटिंग के रूप में, यह विद्युत चालकता में वृद्धि करता है। 1950 के दशक तक सीज़ियम को उच्च प्रदर्शन वाली औद्योगिक धातु के रूप में मान्यता नहीं दी गई थी।<ref>{{cite journal|last = Strod|first = A. J.|date = 1957|title = Cesium—A new industrial metal|journal = American Ceramic Bulletin|volume = 36|issue = 6| pages = 212–213}}</ref> गैर-रेडियोधर्मी सीज़ियम के अनुप्रयोगों में प्रकाश विद्युत सेल, [[ फोटोमल्टीप्लायर |प्रकाश इलेक्ट्रॉनी संवर्धन]] नलिका, [[ अवरक्त स्पेक्ट्रोस्कोपी |अवरक्त स्पेक्ट्रम प्रकाशमापी]] के प्रकाशिक घटक, कई कार्बनिक अभिक्रियाओं के लिए उत्प्रेरक, [[ जगमगाहट काउंटर |किरणोत्सर्गी प्रस्फुरण गणित्र]] के लिए क्रिस्टल और [[ एमएचडी जनरेटर |चुंबक द्रवगतिकी पावर जनरेटर]] शामिल हैं।<ref name="USGS" /> सीज़ियम का उपयोग द्वितीयक आयन मास स्पेक्ट्रोमेट्री (SIMS) में धनात्मक आयनों के स्रोत के रूप में भी किया जाता है। | |||
ऐतिहासिक रूप से, सीज़ियम का सबसे महत्वपूर्ण उपयोग अनुसंधान और विकास में किया गया है, | |||
1967 से, | 1967 के बाद से, मापन की अंतर्राष्ट्रीय प्रणाली ने समय की प्राथमिक इकाई, दूसरी, सीज़ियम के गुणों पर आधारित है। अंतर्राष्ट्रीय इकाई पद्धति (SI) दूसरे को 9,192,631,770 चक्रों की अवधि के रूप में परिभाषित करता है, जो कि सीज़ियम-133 की जमीनी अवस्था के दो [[ अति सूक्ष्म संरचना |अति सूक्ष्म]] [[ ऊर्जा स्तर |ऊर्जा स्तरों]] के बीच संक्रमण के अनुरूप [[ वर्णक्रमीय रेखा |वर्णक्रमीय रेखा]] की [[ माइक्रोवेव |माइक्रोवेव]] [[ आवृत्ति |आवृत्ति]] पर होता है।<ref name="USNO">{{cite web|title=Cesium Atoms at Work |publisher=Time Service Department—U.S. Naval Observatory—Department of the Navy |url=http://tycho.usno.navy.mil/cesium.html |access-date=2009-12-20 |url-status=dead |archive-url=https://web.archive.org/web/20150223231150/http://tycho.usno.navy.mil/cesium.html |archive-date=February 23, 2015 }}</ref> 1967 के वज़न और माप पर 13वें साधारण सम्मेलन ने एक सेकंड को इस प्रकार परिभाषित किया: "9,192,631,770 चक्रों की माइक्रोवेव प्रकाश की अवधि, सीज़ियम-133 परमाणुओं के अति सूक्ष्म संक्रमण द्वारा उनकी जमीनी अवस्था में बाहरी क्षेत्रों द्वारा अबाधित अवशोषित या उत्सर्जित होती है।" | ||
== आवेदन == | == आवेदन == | ||
===पेट्रोलियम की खोज ===<!-- linked from "Formate" article --> | ===पेट्रोलियम की खोज ===<!-- linked from "Formate" article --> | ||
गैर-रेडियोधर्मी सीज़ियम का सबसे बड़ा | गैर-रेडियोधर्मी सीज़ियम का वर्तमान में सबसे बड़ा उपयोग निकालने वाले तेल उद्योग के लिए सीज़ियम प्रारूप प्रवेधन तरल पदार्थ में है।<ref name="USGS" /> सीज़ियम फ़ॉर्मेट (HCOO<sup>−</sup>Cs<sup>+</sup>) के जलीय मिश्रण - जो कि [[ चींटी का तेजाब |फॉर्मिक अम्ल]] के साथ सीज़ियम हाइड्रॉक्साइड की अभिक्रिया से बने होते हैं - 1990 के दशक के मध्य में तेल के कुएं की प्रवेधन और पूरा करने वाले तरल पदार्थ के रूप में उपयोग के लिए विकसित किए गए थे। प्रवेधन तरल पदार्थ का कार्य ड्रिल बिट्स को चिकनाई देना, रॉक कटिंग को सतह पर लाना और कुएं की प्रवेधन के दौरान गठन पर दाब बनाए रखना है। समापन तरल प्रवेधन के बाद लेकिन उत्पादन से पहले दाब को बनाए रखते हुए नियंत्रण हार्डवेयर को स्थापित करने में सहायता करते हैं।<ref name="USGS" /> | ||
सीज़ियम का उच्च घनत्व लवण जल (2.3 g/cm<sup>3</sup> या 19.2 पाउंड प्रति गैलन तक) बनाता है,<ref name="Down">{{cite conference|conference= IADC/SPE Drilling Conference |date=February 2006|location = Miami, Florida, USASociety of Petroleum Engineers|first1 = J. D.|last1 = Downs|first2 = M.|last2 = Blaszczynski|first3 = J.|last3 = Turner|first4 = M.|last4 = Harris|doi = 10.2118/99068-MS|url = http://www.spe.org/elibinfo/eLibrary_Papers/spe/2006/06DC/SPE-99068-MS/SPE-99068-MS.htm|archive-url = https://web.archive.org/web/20071012122901/http://spe.org/elibinfo/eLibrary_Papers/spe/2006/06DC/SPE-99068-MS/SPE-99068-MS.htm|archive-date = 2007-10-12|title = Drilling and Completing Difficult HP/HT Wells With the Aid of Cesium Formate Brines-A Performance Review}}</ref> अधिकांश सीज़ियम यौगिकों की अपेक्षाकृत सौम्य प्रकृति के साथ मिलकर, प्रवेधन तरल पदार्थ में हानिकारक उच्च घनत्व वाले निलंबित ठोस पदार्थों की आवश्यकता को कम करता है-एक महत्वपूर्ण तकनीकी, अभियांत्रिकी और पर्यावरणीय लाभ। कई अन्य भारी तरल पदार्थों के घटकों के विपरीत, सीज़ियम प्रारूप अपेक्षाकृत पर्यावरण के अनुकूल होता है।<ref name="Down" /> जल के घनत्व को कम करने के लिए सीज़ियम प्रारूप लवण जल को पोटेशियम और सोडियम प्रारूप के साथ मिश्रित किया जा सकता है (1.0 g/cm<sup>3</sup>, या प्रति गैलन 8.3 पाउंड)। इसके अलावा, यह जैवनिम्नीकरणीय है और इसका पुनर्चक्रण किया जा सकता है, जो इसकी उच्च लागत (2001 में लगभग 4,000 डॉलर प्रति बैरल) को देखते हुए महत्वपूर्ण है।<ref>{{cite journal|last = Flatern|first = Rick|date = 2001|title = Keeping cool in the HPHT environment|journal = Offshore Engineer|issue = February|pages = 33–37}}</ref> क्षार प्रारूपों को संभालना सुरक्षित है और उत्पादक गठन या डाउनहोल धातुओं को संक्षारक विकल्प के रूप में नुकसान नहीं पहुंचाता है, उच्च घनत्व वाली लवण जल (जैसे जस्ता ब्रोमाइड {{Chem|ZnBr|2}} समाधान) कभी-कभी करते हैं, उन्हें कम सफाई की भी आवश्यकता होती है और निष्कासन लागत भी कम होती है।<ref name="USGS" /> | |||
=== परमाणु घड़ियां === | === परमाणु घड़ियां === | ||
[[File:Usno-mc.jpg|thumb|यू.एस. नेवल ऑब्जर्वेटरी में परमाणु घड़ी की टुकड़ी|alt= अग्रभूमि में एक ब्लैक बॉक्स वाला कमरा और प्रत्येक में पांच से छह रैक के लिए जगह के साथ छह नियंत्रण कैबिनेट। अधिकांश, लेकिन सभी नहीं, अलमारियाँ सफेद बक्से से भरी हुई हैं।]] | [[File:Usno-mc.jpg|thumb|यू.एस. नेवल ऑब्जर्वेटरी में परमाणु घड़ी की टुकड़ी|alt= अग्रभूमि में एक ब्लैक बॉक्स वाला कमरा और प्रत्येक में पांच से छह रैक के लिए जगह के साथ छह नियंत्रण कैबिनेट। अधिकांश, लेकिन सभी नहीं, अलमारियाँ सफेद बक्से से भरी हुई हैं।]] | ||
[[File:FOCS-1.jpg|thumb|FOCS-1, स्विट्जरलैंड में एक निरंतर ठंडी सीज़ियम फव्वारा परमाणु घड़ी, 2004 में 30 मिलियन वर्षों में एक सेकंड की अनिश्चितता पर काम करना शुरू कर दिया। Alt = कुछ ऑप्टिकल उपकरणों के साथ एक प्रयोगशाला तालिका।]] | [[File:FOCS-1.jpg|thumb|FOCS-1, स्विट्जरलैंड में एक निरंतर ठंडी सीज़ियम फव्वारा परमाणु घड़ी, 2004 में 30 मिलियन वर्षों में एक सेकंड की अनिश्चितता पर काम करना शुरू कर दिया। Alt = कुछ ऑप्टिकल उपकरणों के साथ एक प्रयोगशाला तालिका।]] | ||
सीज़ियम-आधारित परमाणु घड़ियाँ एक | सीज़ियम-आधारित परमाणु घड़ियाँ एक निर्देश बिंदु के रूप में सीज़ियम-133 परमाणुओं की अति सूक्ष्म संरचना में विद्युतचुंबकीय संक्रमण का उपयोग करती हैं। पहली परिशुद्ध सीज़ियम घड़ी का निर्माण [[ लुई एसेन |लुइस एसेन]] ने 1955 में यूके में नराष्ट्रीय भौतिक प्रयोगशाला में किया था।<ref>{{Cite journal |first1=L.|last1=Essen|first2=J. V. L.|last2=Parry |date=1955 |title=An Atomic Standard of Frequency and Time Interval: A Caesium Resonator |journal=[[Nature (journal)|Nature]] |volume=176 |pages=280–282 |doi=10.1038/176280a0|bibcode = 1955Natur.176..280E |issue=4476|s2cid=4191481}}</ref> पिछली आधी सदी में सीज़ियम घड़ियों में सुधार हुआ है और इसे "एक इकाई का सबसे सटीक अहसास माना जाता है जिसे मानव जाति ने अभी तक हासिल किया है।"<ref name="USNO" /> ये घड़ियाँ 10<sup>14</sup> में 2 से 3 भागों की त्रुटि के साथ आवृत्ति को मापती हैं, जो प्रति दिन 2 [[ नैनोसेकंड |नैनोसेकंड]], या 1.4 मिलियन वर्षों में एक सेकंड की सटीकता के अनुरूप है। नवीनतम संस्करण 10<sup>15</sup> में 1 भाग की तुलना में अधिक सटीक हैं, 20 मिलियन वर्षों में लगभग 1 सेकंड।<ref name="USGS" /> सीज़ियम मानक मानक-अनुपालक समय और आवृत्ति माप के लिए प्राथमिक मानक है।<ref>{{Cite journal | last1 = Markowitz | first1 = W. | last2 = Hall | first2 = R. | last3 = Essen | first3 = L. | last4 = Parry | first4 = J. | title = Frequency of Cesium in Terms of Ephemeris Time | doi = 10.1103/PhysRevLett.1.105 | journal = Physical Review Letters | volume = 1 | issue = 3 | pages = 105–107 | year = 1958 |bibcode = 1958PhRvL...1..105M }}</ref> सीज़ियम घड़ियाँ सेल फोन नेटवर्क और इंटरनेट के समय को नियंत्रित करती हैं।<ref>{{cite news|first = Monte|last = Reel|date = 2003-07-22|title = Where timing truly is everything|newspaper = The Washington Post|page = B1|url = http://www.highbeam.com/doc/1P2-284155.html|access-date = 2010-01-26|archive-url = https://web.archive.org/web/20130429044454/http://www.highbeam.com/doc/1P2-284155.html|archive-date = 2013-04-29|url-status = dead}}</ref> | ||
==== दूसरे की परिभाषा ==== | ==== दूसरे की परिभाषा ==== | ||
दूसरा, प्रतीक s, समय | दूसरा, प्रतीक s, समय का SI मात्रक है। इसे सीज़ियम आवृत्ति {{math|Δ''ν''<sub>Cs</sub>}} का निश्चित संख्यात्मक मान, सीज़ियम-133 परमाणु की अप्रभावित ग्राउंड-स्टेट अतिसूक्ष्म संक्रमण आवृत्ति, {{val|9192631770}} जब इकाई [[ Hz |Hz]] में व्यक्त किया जाता है, जो s−1 के बराबर है, लेकर परिभाषित किया गया है। | ||
=== बिजली और इलेक्ट्रॉनिक्स === | === बिजली और इलेक्ट्रॉनिक्स === | ||
सीज़ियम वाष्प | सीज़ियम वाष्प तापायनिक जनित्र कम-शक्ति वाले उपकरण हैं जो उष्मीय ऊर्जा को विद्युत ऊर्जा में परिवर्तित करते हैं। दो-इलेक्ट्रोड निर्वात नलिका परिवर्तक में, सीज़ियम कैथोड के पास अंतरिक्ष आवेश को निष्प्रभावित करता है और विद्युत धारा प्रवाह को बढ़ाता है।<ref>{{cite journal| last1 = Rasor| first1 = Ned S.| first2 = Charles|last2 =Warner| title = Correlation of Emission Processes for Adsorbed Alkali Films on Metal Surfaces| journal = Journal of Applied Physics| volume = 35| issue = 9| pages = 2589–2600| date = September 1964|doi = 10.1063/1.1713806|bibcode = 1964JAP....35.2589R}}</ref> | ||
सीज़ियम अपने [[ प्रकाश विद्युत प्रभाव |प्रकाश उत्सर्जक गुणों]] के लिए भी महत्वपूर्ण है, जो प्रकाश को इलेक्ट्रॉन प्रवाह में परिवर्तित करते हैं। इसका उपयोग प्रकाश विद्युत सेल में किया जाता है क्योंकि सीज़ियम आधारित कैथोड, जैसे कि अंतराधात्विक योगिक {{chem|K|2|CsSb}}, में [[ इलेक्ट्रॉन |इलेक्ट्रॉनों]] के उत्सर्जन के लिए कम देहली वोल्टेज होता है।<ref>{{cite web|url=http://www.americanelements.com/cs.html |title=Cesium Supplier & Technical Information |publisher=American Elements |access-date=2010-01-25}}</ref> सीज़ियम का उपयोग करने वाले प्रकाश इलेक्ट्रॉन उत्सर्जक उपकरण की श्रेणी में [[ ऑप्टिकल कैरेक्टर मान्यता |प्रकाशिक संप्रतीक अभिज्ञान]] उपकरण, प्रकाश इलेक्ट्रॉनी संवर्धन नलिका और वीडियो कैमरा नलिका शामिल हैं।<ref>{{cite journal |doi=10.1063/1.3215593|title = K<sub>2</sub>CsSb Cathode Development| journal = AIP Conference Proceedings |date = 2009|volume = 1149|issue = 1| pages = 1062–1066|first1 =John|last1 = Smedley| first2 =Triveni|last2 = Rao| first3 =Erdong|last3 = Wang|bibcode = 2009AIPC.1149.1062S}}</ref><ref>{{cite journal|first = P.|last = Görlich|title = Über zusammengesetzte, durchsichtige Photokathoden|journal = Zeitschrift für Physik|volume = 101|pages = 335–342|date =1936|doi =10.1007/BF01342330|bibcode = 1936ZPhy..101..335G|issue = 5–6|s2cid = 121613539}}</ref> फिर भी, [[ जर्मेनियम |जर्मेनियम]], रूबिडियम, सेलेनियम, सिलिकॉन, टेल्यूरियम, और कई अन्य तत्वों को प्रकाश संवेदनशील सामग्री में सीज़ियम के लिए प्रतिस्थापित किया जा सकता है।<ref name="USGS" /> | |||
सीज़ियम आयोडाइड (CsI), ब्रोमाइड (CsBr) और सीज़ियम फ्लोराइड (CsF) क्रिस्टल गामा और एक्स-रे विकिरण का पता लगाने के लिए खनिज अन्वेषण और कण भौतिकी अनुसंधान में व्यापक रूप से उपयोग किए जाने वाले किरणोत्सर्गी प्रस्फुरण गणित्र में [[ सिंटिलेटर |स्किंटिलेटर्स]] के लिए कार्यरत हैं। भारी तत्व होने के कारण, सीज़ियम बेहतर डिटेक्शन के साथ अच्छी रोक शक्ति प्रदान करता है। सीज़ियम यौगिक एक तेज़ अभिक्रिया (CsF) प्रदान कर सकते हैं और कम हीड्रोस्कोपिक (CsI) होते हैं। | |||
सीज़ियम वाष्प का उपयोग कई सामान्य [[ मैग्नेटोमीटर |मैग्नेटोमीटर]] में किया जाता है।<ref>{{cite journal|doi = 10.1007/s00340-005-1773-x|title = Comparison of discharge lamp and laser pumped cesium magnetometers|date = 2005|last1 = Groeger|first1 = S.|first2 = A. S.|first3 = A.|journal = Applied Physics B|volume = 80|pages = 645–654|last2 = Pazgalev|last3 = Weis|arxiv = physics/0412011 |bibcode = 2005ApPhB..80..645G|issue = 6|s2cid = 36065775}}</ref> | |||
सीज़ियम | |||
तत्व का प्रयोग [[ स्पेक्ट्रोफोटोमेट्री |स्पेक्ट्रोफोटोमेट्री]] में एक [[ आंतरिक मानक |आंतरिक मानक]] के रूप में किया जाता है।<ref>{{cite book|chapter-url = https://books.google.com/books?id=z9SzvsSCHv4C&pg=PA108|page = 108|isbn = 978-0-471-28572-4|chapter = Internal Standards|date = 1994|first1=Mary C.|last1=Haven|first2=Gregory A.|last2=Tetrault|first3=Jerald R.|last3=Schenken|publisher = John Wiley and Sons|location = New York|title = Laboratory instrumentation}}</ref> अन्य क्षार धातुओं की तरह, सीज़ियम में ऑक्सीजन के लिए बहुत अधिक आत्मीयता होती है और इसे निर्वात नलिका में "गेट्टर" के रूप में प्रयोग किया जाता है।<ref>{{cite book|url=https://books.google.com/books?id=1o1WECNJkscC&pg=PA391 |title=Photo-electronic image devices: proceedings of the fourth symposium held at Imperial College, London, September 16–20, 1968|volume = 1|publisher = Academic Press|date = 1969|first = James D.|last = McGee|page = 391|isbn=978-0-12-014528-7}}</ref> धातु के अन्य उपयोगों में उच्च-ऊर्जा [[ लेज़र |लेज़र]], [[ फ्लोरोसेंट लैंप |वाष्प चमक लैंप]], और वाष्प [[ सही करनेवाला |दिष्टकारी]] शामिल हैं।<ref name="USGS" /> | |||
=== अपकेंद्रीकरण तरल पदार्थ === | |||
सीज़ियम आयन का उच्च घनत्व, घनत्व प्रवणता द्रुतअपकेंद्रण (अल्ट्रासेंट्रीफ्यूजेशन) के लिए आणविक जीव विज्ञान में उपयोगी सीज़ियम क्लोराइड, सीज़ियम सल्फेट और सीज़ियम ट्राइफ़्लोरोसेटेट ({{chem|Cs(O|2|CCF|3|)}}) का मिश्रण बनाता है।<ref>Manfred Bick, Horst Prinz, "Cesium and Cesium Compounds" in Ullmann's Encyclopedia of Industrial Chemistry 2005, Wiley-VCH, Weinheim. {{doi|10.1002/14356007.a06_153}}.</ref> इस तकनीक का उपयोग मुख्य रूप से विषाणुज कणों, उपकोशिकीय जीवों और अंशों और जैविक नमूनों से [[ न्यूक्लिक अम्ल |न्यूक्लिक अम्ल]] को अलग करने में किया जाता है।<ref>{{cite book|chapter-url = https://books.google.com/books?id=1kn89nI2gUsC&pg=PA61|pages = 61–62|isbn = 978-0-89603-564-5|chapter = Gradient Materials|editor =Desai, Mohamed A.|date = 2000|publisher = Humana Press|location = Totowa, N.J.|title = Downstream processing methods}}</ref> | |||
===रासायनिक और चिकित्सा उपयोग === | ===रासायनिक और चिकित्सा उपयोग === | ||
[[File:Caesium chloride.jpg|thumb|alt=Some fine white powder on a laboratory watch glassसीज़ियम क्लोराइड पाउडर]] | [[File:Caesium chloride.jpg|thumb|alt=Some fine white powder on a laboratory watch glassसीज़ियम क्लोराइड पाउडर]] | ||
अपेक्षाकृत कम रासायनिक | अपेक्षाकृत कम रासायनिक अनुप्रयोगों में सीज़ियम का उपयोग किया जाता है।<ref>{{cite book |last = Burt|first =R. O.|date = 1993|chapter= Cesium and cesium compounds|title = Kirk-Othmer encyclopedia of chemical technology|edition = 4th|place = New York|publisher = John Wiley & Sons|volume = 5|page =759|isbn = 978-0-471-15158-6}}</ref> सीज़ियम यौगिकों के साथ डोपिंग रासायनिक संश्लेषण के लिए कई धातु-आयन उत्प्रेरकों की प्रभावशीलता को बढ़ाता है, जैसे [[ एक्रिलिक एसिड |एक्रिलिक अम्ल]], [[ anthraquinones |एन्थ्राक्विनोन]], [[ इथिलीन ऑक्साइड |एथिलीन ऑक्साइड]], [[ मेथनॉल |मेथनॉल]], [[ फ्थेलिक एनहाइड्राइड |फ़ेथलिक एनहाइड्राइड]], स्टाइरीन, [[ मिथाइल मेथाक्रायलेट |मिथाइल मेथैक्रिलेट]] एकलक और विभिन्न [[ अल्केन |ओलेफ़िन]]। इसका उपयोग सल्फ्यूरिक अम्ल के उत्पादन में सल्फर डाइऑक्साइड के सल्फर ट्रायऑक्साइड में उत्प्रेरक रूपांतरण में भी किया जाता है।<ref name="USGS" /> | ||
सीज़ियम फ्लोराइड एक आधार | |||
Friestad, Gregory K.; Branchaud, Bruce P.; Navarrini, Walter and Sansotera, Maurizio (2007) "Cesium Fluoride" in ''Encyclopedia of Reagents for Organic Synthesis'', John Wiley & Sons. {{doi|10.1002/047084289X.rc050.pub2}}</ref> सीज़ियम लवण कभी-कभी [[ कार्बनिक संश्लेषण ]] में पोटेशियम या सोडियम लवण की जगह लेते हैं, जैसे [[ चक्रीय यौगिक ]], [[ एस्टरीफिकेशन ]] और [[ बहुलकीकरण ]] सीज़ियम का उपयोग थर्मोल्यूमिनसेंट | सीज़ियम फ्लोराइड कार्बनिक रसायन विज्ञान में एक आधार के रूप में<ref name="greenwood" /> और फ्लोराइड आयन के निर्जल स्रोत के रूप में एक विशिष्ट उपयोग का आनंद लेता है।<ref> | ||
Friestad, Gregory K.; Branchaud, Bruce P.; Navarrini, Walter and Sansotera, Maurizio (2007) "Cesium Fluoride" in ''Encyclopedia of Reagents for Organic Synthesis'', John Wiley & Sons. {{doi|10.1002/047084289X.rc050.pub2}}</ref> सीज़ियम लवण कभी-कभी [[ कार्बनिक संश्लेषण |कार्बनिक संश्लेषण]] में पोटेशियम या सोडियम लवण की जगह लेते हैं, जैसे [[ चक्रीय यौगिक |चक्रीकरण]], [[ एस्टरीफिकेशन |एस्टरीफिकेशन]] और [[ बहुलकीकरण |बहुलकीकरण]]। सीज़ियम का उपयोग तापसंदीप्त (थर्मोल्यूमिनसेंट) विकिरण [[ मात्रामापी |विकिरणमापी]] (TLD) में भी किया गया है: जब विकिरण के संपर्क में आता है, तो यह क्रिस्टल दोष प्राप्त करता है, जो गर्म होने पर प्राप्त खुराक के अनुपात में प्रकाश के उत्सर्जन के साथ वापस आ जाता है। इस प्रकार, एक [[ फोटोमल्टीप्लायर ट्यूब |प्रकाश इलेक्ट्रॉनी संवर्धन नलिका]] के साथ प्रकाश स्पंद को मापने से संचित विकिरण की मात्रा निर्धारित की जाती है। | |||
=== परमाणु और समस्थानिक अनुप्रयोग === | === परमाणु और समस्थानिक अनुप्रयोग === | ||
सीज़ियम-137 एक [[ रेडियोन्यूक्लाइड ]] है | सीज़ियम-137 एक [[ रेडियोन्यूक्लाइड |रेडियो-समस्थानिक]] है जो आमतौर पर औद्योगिक अनुप्रयोगों में गामा-एमिटर के रूप में उपयोग किया जाता है। इसके लाभों में लगभग 30 वर्षों का अर्ध आयु, [[ परमाणु ईंधन चक्र |परमाणु ईंधन चक्र]] से इसकी उपलब्धता और एक स्थायी अंत उत्पाद के रूप में <sup>137</sup>Ba शामिल हैं। जल में उच्च घुलनशीलता एक हानि है जो इसे भोजन और चिकित्सा आपूर्ति के लिए बड़े पूल विकिरणकों के साथ असंगत बनाता है।<ref name="Takeshi">{{cite web|url=http://earth1.epa.gov/radiation/docs/source-management/csfinallongtakeshi.pdf |title=The material flow of radioactive cesium-137 in the U.S. 2000 |first=Takeshi |last=Okumura |date=2003-10-21 |access-date=2009-12-20 |publisher=United States Environmental Protection Agency |url-status=dead |archive-url=https://web.archive.org/web/20110720163223/http://earth1.epa.gov/radiation/docs/source-management/csfinallongtakeshi.pdf |archive-date=July 20, 2011 }}</ref> इसका उपयोग कृषि, कैंसर के उपचार, और भोजन के रोगाणुनाशन, सीवेज कीचड़, और शल्य चिकित्सा उपकरणों में किया गया है।<ref name="USGS" /><ref>{{cite book|last = Jensen|first = N. L.|date = 1985|chapter=Cesium|title = Mineral facts and problems|publisher = U.S. Bureau of Mines|volume = Bulletin 675|pages = 133–138}}</ref> विकिरण उपकरणों में सीज़ियम के रेडियोधर्मी समस्थानिकों का उपयोग चिकित्सा क्षेत्र में कुछ प्रकार के कैंसर के इलाज के लिए किया जाता था,<ref>{{cite web|url=http://www.medicalnewstoday.com/releases/91994.php|title=IsoRay's Cesium-131 Medical Isotope Used In Milestone Procedure Treating Eye Cancers At Tufts-New England Medical Center|date= 2007-12-17 |work=Medical News Today |access-date=2010-02-15}}</ref> लेकिन बेहतर विकल्पों का उद्भव और स्रोतों में जल में घुलनशील सीज़ियम क्लोराइड का उपयोग, जो धीरे-धीरे व्यापक संदूषण पैदा कर सकता था। इन सीज़ियम स्रोतों में से कुछ को उपयोग से बाहर कर दें।<ref>{{Cite book|chapter-url = https://books.google.com/books?id=bk0go_-FO5QC&pg=PA22|isbn = 978-0-07-005115-7|chapter = Caesium-137 Machines|title = Radiation therapy planning|first = Gunilla Carleson|last = Bentel|publisher = McGraw-Hill Professional|date = 1996|access-date=2010-09-26|pages = 22–23}}</ref><ref>{{Cite book|isbn = 978-0-309-11014-3| url =https://books.google.com/books?id=3cT2REdXJ98C|title = Radiation source use and replacement: abbreviated version|author = National Research Council (U.S.). Committee on Radiation Source Use and Replacement|publisher = National Academies Press|date = 2008}}</ref> सीज़ियम-137 को नमी, घनत्व, समतलीकरण और मोटाई गेज सहित विभिन्न औद्योगिक मापन गेजों में नियोजित किया गया है।<ref name="gauges">{{cite book|chapter = Level and density measurement using non-contact nuclear gauges|isbn = 978-0-412-53400-3|chapter-url =https://books.google.com/books?id=RwsoQbHYjvwC&pg=PA82|pages = 82–85|editor= Loxton, R.|editor2= Pope, P.|date = 1995|publisher = Chapman & Hall|location = London|title = Instrumentation : A Reader}}</ref> इसका उपयोग रॉक संरचनाओं के [[ इलेक्ट्रॉन घनत्व |इलेक्ट्रॉन घनत्व]] को मापने के लिए वेल लॉगिंग उपकरणों में भी किया गया है, जो संरचनाओं के थोक घनत्व के अनुरूप है।<ref>{{cite journal|doi = 10.1146/annurev.ea.13.050185.001531|title = Downhole Geophysical Logging|date = 1985|last1 = Timur|first1 = A.|last2 = Toksoz|first2 = M. N.|journal = Annual Review of Earth and Planetary Sciences|volume = 13|pages = 315–344|bibcode = 1985AREPS..13..315T}}</ref> | ||
सीज़ियम-137 का उपयोग ट्रिटियम वाले [[ जल विज्ञान |हाइड्रोलॉजिकल]] अध्ययनों में किया गया है। 1950 के दशक से 1980 के दशक के मध्य तक विखंडन बम परीक्षण के एक छोटे उत्पाद के रूप में, सीज़ियम -137 को वातावरण में छोड़ा गया, जहाँ इसे आसानी से मिश्रण में अवशोषित किया गया। उस अवधि के भीतर ज्ञात साल-दर-साल भिन्नता मिट्टी और तलछट परतों के साथ सहसंबंध की अनुमति देती है। सीज़ियम-134, और कुछ हद तक सीज़ियम-135, का उपयोग जल विज्ञान में भी नाभिकीय ऊर्जा उद्योग द्वारा सीज़ियम उत्पादन को मापने के लिए किया गया है। जबकि वे सीज़ियम-133 या सीज़ियम-137 की तुलना में कम प्रचलित हैं, ये बेलवेदर समस्थानिक केवल मानवजनित स्रोतों से उत्पन्न होते हैं।<ref>{{Cite web|first=Carol|last=Kendall |author-link=Carol Kendall (scientist)|url=http://wwwrcamnl.wr.usgs.gov/isoig/period/cs_iig.html |title=Isotope Tracers Project – Resources on Isotopes – Cesium|publisher=National Research Program – U.S. Geological Survey |access-date=2010-01-25}}</ref><!--https://books.google.com/books?id=pWDQnxd-r1UC&pg=PT360 &pg=PT12 --> | |||
=== अन्य उपयोग === | === अन्य उपयोग === | ||
[[File:Electrostatic ion thruster-en.svg|thumb|upright=1.4|सीज़ियम या मरकरी फ्यूल के साथ प्रयोग के लिए विकसित इलेक्ट्रोस्टैटिक आयन थ्रस्टर की योजनाएँ|alt=इलेक्ट्रॉन गन हिट से बीमित इलेक्ट्रॉन और तटस्थ ईंधन परमाणुओं को आयनित करते हैं; चुम्बकों से घिरे एक कक्ष में, सकारात्मक आयनों को एक नकारात्मक ग्रिड की ओर निर्देशित किया जाता है जो उन्हें गति प्रदान करता है। इंजन का बल उच्च वेग से पीछे से आयनों को बाहर निकालकर बनाया जाता है। बाहर निकलने पर, सकारात्मक आयनों को एक अन्य इलेक्ट्रॉन गन से निष्प्रभावी कर दिया जाता है, यह सुनिश्चित करते हुए कि न तो जहाज और न ही निकास विद्युत रूप से चार्ज होता है और आकर्षित नहीं होता है।]] | [[File:Electrostatic ion thruster-en.svg|thumb|upright=1.4|सीज़ियम या मरकरी फ्यूल के साथ प्रयोग के लिए विकसित इलेक्ट्रोस्टैटिक आयन थ्रस्टर की योजनाएँ|alt=इलेक्ट्रॉन गन हिट से बीमित इलेक्ट्रॉन और तटस्थ ईंधन परमाणुओं को आयनित करते हैं; चुम्बकों से घिरे एक कक्ष में, सकारात्मक आयनों को एक नकारात्मक ग्रिड की ओर निर्देशित किया जाता है जो उन्हें गति प्रदान करता है। इंजन का बल उच्च वेग से पीछे से आयनों को बाहर निकालकर बनाया जाता है। बाहर निकलने पर, सकारात्मक आयनों को एक अन्य इलेक्ट्रॉन गन से निष्प्रभावी कर दिया जाता है, यह सुनिश्चित करते हुए कि न तो जहाज और न ही निकास विद्युत रूप से चार्ज होता है और आकर्षित नहीं होता है।]] | ||
सीज़ियम और पारा का उपयोग प्रारंभिक [[ आयन थ्रस्टर ]] में एक प्रणोदक के रूप में किया गया था | सीज़ियम और पारा का उपयोग प्रारंभिक [[ आयन थ्रस्टर |आयन इंजनों]] में एक प्रणोदक के रूप में किया गया था, जो कि बहुत लंबे अंतराग्रहीय (इंटरप्लेनेट्री) या अतिग्रहीय (एक्स्ट्राप्लानेटरी) मिशन पर [[ अंतरिक्ष यान प्रणोदन |अंतरिक्ष यान प्रणोदन]] के लिए डिज़ाइन किया गया था। एक आवेशित टंगस्टन के संपर्क से ईंधन को आयनित किया गया। लेकिन अंतरिक्ष यान के घटकों पर सीज़ियम द्वारा जंग ने विकास को अक्रिय गैस प्रणोदक की दिशा में धकेल दिया है, जैसे कि ज़िनॉन, जो जमीन पर आधारित परीक्षणों में संभालना आसान है और अंतरिक्ष यान को कम संभावित नुकसान पहुंचाता है।<ref name="USGS" /> 1998 में प्रक्षेपित प्रायोगिक अंतरिक्ष यान [[ डीप स्पेस 1 |डीप स्पेस 1]] में ज़िनॉन का उपयोग किया गया था।<ref>{{cite journal|doi =10.1063/1.1150468|title =NSTAR Xenon Ion Thruster on Deep Space 1: Ground and flight tests (invited)|date =2000|last1 =Marcucci|first1 =M. G.|last2 =Polk|first2 =J. E.|journal =Review of Scientific Instruments|volume =71|pages =1389–1400|bibcode = 2000RScI...71.1389M|issue =3}}</ref><ref>{{cite web|url=http://gltrs.grc.nasa.gov/reports/1999/TM-1999-209439.pdf |title=A Synopsis of Ion Propulsion Development Projects in the United States: SERT I to Deep Space I |first1=James S. |last1=Sovey |first2=Vincent K. |last2=Rawlin |first3=Michael J. |last3=Patterson |publisher=NASA |access-date=2009-12-12 |url-status=dead |archive-url=https://web.archive.org/web/20090629225625/http://gltrs.grc.nasa.gov/reports/1999/TM-1999-209439.pdf |archive-date=June 29, 2009 }}</ref> फिर भी, सीज़ियम जैसे तरल धातु आयनों को गति देने वाले [[ क्षेत्र-उत्सर्जन विद्युत प्रणोदन |क्षेत्र-उत्सर्जन विद्युत प्रणोदन]] प्रणोदक बनाए गए हैं।<ref>{{cite conference|url=http://trs-new.jpl.nasa.gov/dspace/handle/2014/11649|title=In-FEEP Thruster Ion Beam Neutralization with Thermionic and Field Emission Cathodes|format=PDF|access-date=2010-01-25|conference=27th International Electric Propulsion Conference|place=Pasadena, California|date=October 2001|pages=1–15|author=Marrese, C.|author2=Polk, J.|author3=Mueller, J.|author4=Owens, A.|author5=Tajmar, M.|author6=Fink, R.|author7=Spindt, C.|name-list-style=amp|url-status=dead|archive-url=https://web.archive.org/web/20100527071653/http://trs-new.jpl.nasa.gov/dspace/handle/2014/11649|archive-date=2010-05-27}}</ref> | ||
सीज़ियम नाइट्रेट का उपयोग [[ ऑक्सीकरण एजेंट ]] के रूप में | |||
सीज़ियम नाइट्रेट का उपयोग [[ ऑक्सीकरण एजेंट |ऑक्सीकारक]] और पाइरोतकनीक रंजक के रूप में [[ अवरक्त |अवरक्त]] झिलमिलाती हुई चमक (फ्लेयर्स) में सिलिकॉन को जलाने के लिए किया जाता है,<ref>{{cite web|url=http://www.freepatentsonline.com/6230628.html |work=United States Patent 6230628|title=Infrared illumination compositions and articles containing the same |publisher=Freepatentsonline.com |access-date=2010-01-25}}</ref> जैसे कि LUU-19 फ्लेयर,<ref>{{cite web|url = https://fas.org/man/dod-101/sys/dumb/luu19.htm|title = LUU-19 Flare|publisher = Federation of American Scientists|date = 2000-04-23|access-date = 2009-12-12|url-status = dead|archive-url = https://web.archive.org/web/20100806093502/http://www.fas.org/man/dod-101/sys/dumb/luu19.htm|archive-date = 2010-08-06}}</ref> क्योंकि यह अपने अधिकांश प्रकाश को निकट अवरक्त वर्णक्रम (स्पेक्ट्रम) में उत्सर्जित करता है।<ref>{{cite journal|doi = 10.1016/j.tca.2006.04.002|title = Determination of the temperature and enthalpy of the solid–solid phase transition of caesium nitrate by differential scanning calorimetry|date = 2006|last1 = Charrier|first1 = E.|first2 = E. L.|first3 = P. G.|first4 = H. M.|first5 = B.|first6 = T. T.|journal = Thermochimica Acta|volume = 445|pages = 36–39 |last2 = Charsley|last3 = Laye|last4 = Markham|last5 = Berger|last6 = Griffiths}}</ref> [[ लॉकहीड ए-12 |लॉकहीड ए-12]] [[ सीआईए |CIA]] टोही विमान में [[ निकास गैस |एग्जॉस्ट प्लम]] के [[ रडार क्रॉस-सेक्शन |रडार संकेत धुन]] को कम करने के लिए सीज़ियम यौगिकों का उपयोग ईंधन योजक के रूप में किया जाता है।<ref>{{cite book|isbn = 978-1-84176-098-8|page = 47|title=Lockheed SR-71: the secret missions exposed|last=Crickmore|first = Paul F.|publisher=Osprey|date=2000}}</ref> सीज़ियम और रूबिडियम को कांच में कार्बोनेट के रूप में जोड़ा गया है क्योंकि वे विद्युत चालकता को कम करते हैं और (तंतु प्रकाशिकी) [[ प्रकाशित तंतु |फाइबर ऑप्टिक्स]] और [[ रात्रि दृष्टि |रात्रि दृष्टि]] उपकरणों की स्थिरता और स्थायित्व में सुधार करते हैं। सीज़ियम फ्लोराइड या सीज़ियम [[ अल्युमीनियम |एल्यूमीनियम]] फ्लोराइड का उपयोग मैग्नीशियम युक्त एल्यूमीनियम मिश्र धातुओं को जोड़ने के लिए तैयार फ्लक्स में किया जाता है।<ref name="USGS" /> | |||
चुंबक द्रवगतिकी (मैग्नेटोहाइड्रोडायनामिक) (MHD) बिजली पैदा करने वाली प्रणालियों पर शोध किया गया, लेकिन व्यापक स्वीकृति हासिल करने में विफल रहे।<ref>{{cite book|author = National Research Council (U.S.)| publisher = National Academy Press| date = 2001|title = Energy research at DOE—Was it worth it?|access-date=2010-09-26|url = http://books.nap.edu/openbook.php?isbn=0309074487&page=52|isbn =978-0-309-07448-3|pages = 190–194| doi = 10.17226/10165}}</ref> सीज़ियम धातु को उच्च-तापमान [[ रैंकिन चक्र |रैंकिन चक्र]] टर्बोइलेक्ट्रिक जेनरेटर में कार्यशील तरल पदार्थ के रूप में भी माना जाता है।<ref>{{cite book|title =Economics of Caesium and Rubidium (Reports on Metals & Minerals)|publisher = Roskill Information Services|date = 1984|place = London, United Kingdom|author = Roskill Information Services |page = 51|isbn = 978-0-86214-250-6}}</ref> | |||
[[ आर्सेनिक विषाक्तता |आर्सेनिक दवाओं]] के प्रशासन के बाद सीज़ियम लवण को एंटीशॉक अभिकर्मकों के रूप में मूल्यांकन किया गया है। दिल की लय पर उनके प्रभाव के कारण, हालांकि, पोटेशियम या रूबिडियम लवण की तुलना में उनके उपयोग की संभावना कम होती है। उनका उपयोग मिर्गी के इलाज के लिए भी किया जाता रहा है।<ref name="USGS" /> | |||
सीज़ियम-133 [[ लेजर कूलिंग ]] | सीज़ियम-133 को [[ लेजर कूलिंग |लेजर शीतलित]] किया जाता है और [[ क्वांटम यांत्रिकी |क्वांटम यांत्रिकी]] में मौलिक और तकनीकी समस्याओं की जांच के लिए इस्तेमाल किया जा सकता है। इसमें विशेष रूप से सुविधाजनक फेशबैक वर्णक्रम (स्पेक्ट्रम) है जो ट्यून करने योग्य अंतःक्रियाओं की आवश्यकता वाले अल्ट्राकोल्ड परमाणुओं के अध्ययन को सक्षम बनाता है।<ref>{{Cite journal|last1=Chin|first1=Cheng|last2=Grimm|first2=Rudolf|last3=Julienne|first3=Paul|last4=Tiesinga|first4=Eite|date=2010-04-29|title=Feshbach resonances in ultracold gases|journal=Reviews of Modern Physics|volume=82|issue=2|pages=1225–1286|doi=10.1103/RevModPhys.82.1225|arxiv=0812.1496|bibcode=2010RvMP...82.1225C|s2cid=118340314}}</ref> | ||
| Line 167: | Line 167: | ||
}} | }} | ||
[[File:AirDoseChernobylVector.svg|thumb|right|upright=1.4|alt=Graph of percentage of the radioactive output by each nuclide that form after a nuclear fallout vs. घटना के बाद समय का लघुगणक। विभिन्न रंगों के वक्रों में, विकिरण के प्रमुख स्रोत को क्रम में दर्शाया गया है: पहले पांच या इतने दिनों के लिए Te-132/I-132; I-131 अगले पांच के लिए; संक्षेप में बीए-140/ला-140; Zr-95/Nb-95 दिन 10 से दिन 200 तक; और अंत में सीएस-137। रेडियोधर्मिता का उत्पादन करने वाले अन्य न्यूक्लाइड, लेकिन एक प्रमुख घटक के रूप में चरम पर नहीं हैं, आरयू, लगभग 50 दिनों में, और सीएस-134 लगभग 600 दिनों में। चेरनोबिल आपदा। दुर्घटना के लगभग 200 दिन बाद सीज़ियम-137 विकिरण का प्राथमिक स्रोत बन गया।<ref>Data from [https://archive.org/details/TheRadiochemicalManual The Radiochemical Manual] and Wilson, B. J. (1966) ''The Radiochemical Manual'' (2nd ed.).</ref>]] | [[File:AirDoseChernobylVector.svg|thumb|right|upright=1.4|alt=Graph of percentage of the radioactive output by each nuclide that form after a nuclear fallout vs. घटना के बाद समय का लघुगणक। विभिन्न रंगों के वक्रों में, विकिरण के प्रमुख स्रोत को क्रम में दर्शाया गया है: पहले पांच या इतने दिनों के लिए Te-132/I-132; I-131 अगले पांच के लिए; संक्षेप में बीए-140/ला-140; Zr-95/Nb-95 दिन 10 से दिन 200 तक; और अंत में सीएस-137। रेडियोधर्मिता का उत्पादन करने वाले अन्य न्यूक्लाइड, लेकिन एक प्रमुख घटक के रूप में चरम पर नहीं हैं, आरयू, लगभग 50 दिनों में, और सीएस-134 लगभग 600 दिनों में। चेरनोबिल आपदा। दुर्घटना के लगभग 200 दिन बाद सीज़ियम-137 विकिरण का प्राथमिक स्रोत बन गया।<ref>Data from [https://archive.org/details/TheRadiochemicalManual The Radiochemical Manual] and Wilson, B. J. (1966) ''The Radiochemical Manual'' (2nd ed.).</ref>]] | ||
गैर-रेडियोधर्मी सीज़ियम यौगिक केवल हल्के | गैर-रेडियोधर्मी सीज़ियम यौगिक केवल हल्के से विषाक्त होते हैं, और गैर-रेडियोधर्मी सीज़ियम एक महत्वपूर्ण पर्यावरणीय खतरा नहीं है। क्योंकि जैव रासायनिक प्रक्रियाएं सीज़ियम को पोटेशियम के साथ भ्रमित और प्रतिस्थापित कर सकती हैं, अतिरिक्त सीज़ियम से [[ hypokalemia |हाइपोकैलिमिया]], [[ हृदय अतालता |वितालता]], और तीव्र हृदय गति रुक सकती है, लेकिन ऐसी मात्रा प्राकृतिक स्रोतों में सामान्य रूप से सामने नहीं आएगी।<ref>{{cite journal|last1=Melnikov|first1=P.|last2=Zanoni|first2=L. Z.|title=Clinical effects of cesium intake.|journal=Biological Trace Element Research|date=June 2010|volume=135|issue=1–3|pages=1–9|pmid=19655100|doi=10.1007/s12011-009-8486-7|s2cid=19186683}}</ref><ref>{{cite journal|doi = 10.1080/10934528109375003|title = Cesium in mammals: Acute toxicity, organ changes and tissue accumulation|date = 1981|last1 = Pinsky|first1 = Carl|first2 = Ranjan|first3 = J. R.|first4 = Jasper|first5 = Claude|first6 = James|journal = Journal of Environmental Science and Health, Part A|volume = 16|pages = 549–567 |last2 = Bose|last3 = Taylor|last4 = McKee|last5 = Lapointe|last6 = Birchall|issue = 5}}</ref> | ||
[[ औसत घातक खुराक ]] ( | |||
चूहों में सीज़ियम क्लोराइड के लिए [[ औसत घातक खुराक |औसत घातक खुराक]] (LD<sub>50</sub>) 2.3 ग्राम प्रति किलोग्राम है, जो [[ पोटेशियम क्लोराइड |पोटेशियम क्लोराइड]] और सोडियम क्लोराइड के LD<sub>50</sub> मूल्यों के बराबर है।<ref>{{cite journal|doi = 10.1016/0041-008X(75)90216-1|title = Acute toxicity of cesium and rubidium compounds|date = 1975|last1 = Johnson|first1 = Garland T.|journal = [[Toxicology and Applied Pharmacology]]|volume = 32|pages = 239–245|pmid = 1154391|first2 = Trent R.|first3 = D. Wagner|issue = 2|last2 = Lewis|last3 = Wagner}}</ref> गैर-रेडियोधर्मी सीज़ियम का मुख्य उपयोग पेट्रोलियम प्रवेधन तरल पदार्थों में सीज़ियम प्रारूप के रूप में होता है क्योंकि यह विकल्पों की तुलना में बहुत कम विषैला होता है, हालांकि यह अधिक महंगा होता है।<ref name="Down" /> | |||
सीज़ियम धातु सबसे अभिक्रियाशील तत्वों में से एक है और जल की उपस्थिति में अत्यधिक [[ विस्फोटक सामग्री |विस्फोटक]] है। अभिक्रिया से उत्पन्न हाइड्रोजन गैस एक ही समय में निकलने वाली उष्मीय ऊर्जा से गर्म होती है, जिससे प्रज्वलन और एक ीव्रव िस्फोट होता है। यह अन्य क्षार धातुओं के साथ हो सकता है, लेकिन सीज़ियम इतना शक्तिशाली होता है कि यह विस्फोटक अभिक्रिया ठंडे जल से भी शुरू हो सकती है।<ref name="USGS" /> | |||
सीज़ियम | यह अत्यधिक स्वत: ज्वलनशील (पायरोफोरिक) है: सीज़ियम का स्वतः प्रज्वलन तापमान {{convert|−116|C}} होता है, और यह सीज़ियम हाइड्रॉक्साइड और विभिन्न ऑक्साइड बनाने के लिए हवा में विस्फोटक रूप से प्रज्वलित करता है। सीज़ियम हाइड्रॉक्साइड एक बहुत प्रबल क्षार है, और यह कांच को तेजी से खराब कर देता है।<ref name="RSC" /> | ||
जीवमंडल में समस्थानिक [[ सीज़ियम-134 |134]] और 137 मानव गतिविधियों से थोड़ी मात्रा में मौजूद हैं, जो स्थान के अनुसार भिन्न हैं। रेडियोकैसियम शरीर में अन्य विखंडन उत्पादों (जैसे रेडियोआयोडीन और रेडियोस्ट्रोंटियम) की तरह आसानी से एकत्रित नहीं होता है। अवशोषित रेडियोकेशियम का लगभग 10% पसीने और मूत्र में अपेक्षाकृत जल्दी शरीर से निकल जाता है। शेष 90% में 50 और 150 दिनों के बीच जैविक अर्ध आयु होता है।<ref>{{cite journal|journal=British Journal of Radiology|title=A Survey of the Metabolism of Caesium in Man|date=1964|last1=Rundo|issue=434|pages=108–114|doi=10.1259/0007-1285-37-434-108|pmid=14120787|first1=J.|volume=37}}</ref> रेडियोकैशियम पोटेशियम का अनुसरण करता है और फलों और सब्जियों सहित पौधों के ऊतकों में एकत्रित होने लगता है।<ref>{{cite journal|doi = 10.1007/BF01376226|title = Accumulation of Cs and K and growth of bean plants in nutrient solution and soils|date = 1962|last1 = Nishita|first1 = H.|last2 = Dixon|first2 = D.|last3 = Larson|first3 = K. H.|journal = Plant and Soil|volume = 17|pages = 221–242|issue = 2|s2cid = 10293954}}</ref><ref>{{cite journal|doi = 10.1016/0265-931X(96)89276-9|title = Fate of caesium in the environment: Distribution between the abiotic and biotic components of aquatic and terrestrial ecosystems|date = 1996|last1 = Avery|first1 = S.|journal = Journal of Environmental Radioactivity|volume = 30|pages = 139–171|issue = 2}}</ref><ref>{{cite journal|doi=10.1039/AN9921700487|title = Availability of caesium isotopes in vegetation estimated from incubation and extraction experiments|journal = Analyst|date = 1992| volume = 117|pages = 487–491|first1 =Brit |last1 =Salbu|first2 =Georg |last2 =Østby|first3 =Torstein H. |last3 =Garmo|first4 =Knut |last4 =Hove|pmid=1580386|issue=3|bibcode = 1992Ana...117..487S}}</ref> सीज़ियम के अवशोषण में पौधे व्यापक रूप से भिन्न होते हैं, कभी-कभी इसके प्रति बहुत प्रतिरोध प्रदर्शित करते हैं। यह भी अच्छी तरह से प्रलेखित है कि दूषित जंगलों से मशरूम कवक [[ स्पोरोकार्प (कवक) |बीजाणु फलिका (स्पोरोकार्प्स)]] में रेडियोकैसियम (सीज़ियम-137) एकत्रित करते हैं।<ref>{{cite journal|url=https://www.researchgate.net/publication/42541094 |doi=10.1016/j.scitotenv.2010.02.024|pmid=20334900|title=Accumulation of potassium, rubidium and caesium (<sup>133</sup>Cs and <sup>137</sup>Cs) in various fractions of soil and fungi in a Swedish forest|journal=Science of the Total Environment|volume =408|issue =12|year=2010|pages =2543–2548 | last1 = Vinichuk | first1 = M.|bibcode=2010ScTEn.408.2543V}}</ref> चेरनोबिल आपदा के बाद झीलों में सीज़ियम-137 का एकत्रित होना एक बड़ी चिंता का विषय रहा है।<ref name="smithber05">{{cite book|first1 = Jim T.|last1 = Smith| first2 = Nicholas A.|last2 = Beresford|title = Chernobyl: Catastrophe and Consequences|date=2005|publisher = Springer|place = Berlin|isbn = 978-3-540-23866-9}}</ref><ref>{{cite journal|doi=10.1007/BF02197418|title =Radioactive isotopes of caesium in the waters and near-water atmospheric layer of the Black Sea|first1 =V. N. |last1 = Eremeev|first2 =T. V. |last2 =Chudinovskikh|first3 =G. F. |last3 =Batrakov|first4 =T. M. |last4 =Ivanova|volume = 2|issue = 1|date = 1991|journal = Physical Oceanography |pages = 57–64|s2cid =127482742}}</ref> कुत्तों के साथ किए गए प्रयोगों से पता चला है कि 3.8 [[ क्यूरी (इकाई) |मिलीक्यूरीज़]] (140 [[ Becquerel |MBq]], 4.1 μg सीज़ियम-137) की एक खुराक (डोज़) तीन सप्ताह के भीतर घातक है,<ref>{{cite journal |title =Toxicity of 137-CsCl in the Beagle. Early Biological Effects|first1 =H. C. |last1 = Redman|first2 =R. O.|last2 =McClellan|first3 =R. K. |last3 =Jones|first4 =B. B. |last4 =Boecker|first5 =T. L. |last5 =Chiffelle|first6 =J. A. |last6 =Pickrell|first7 =E. W. |last7 =Rypka|volume = 50|issue = 3|date = 1972|journal = Radiation Research |pages = 629–648|doi=10.2307/3573559|pmid=5030090|jstor=3573559|bibcode =1972RadR...50..629R }}</ref> कम मात्रा में ऊसरता और कैंसर हो सकता है।<ref>{{cite news|url=http://news.bbc.co.uk/2/hi/asia-pacific/7967285.stm |title=Chinese 'find' radioactive ball |work=BBC News |date=2009-03-27 |access-date=2010-01-25}}</ref> अंतर्राष्ट्रीय परमाणु ऊर्जा संस्था और अन्य स्रोतों ने चेतावनी दी है कि रेडियोधर्मी सामग्री, जैसे कि सीज़ियम-137, का उपयोग रेडियोलॉजिकल फैलाव उपकरणों, या "डर्टी बम" में किया जा सकता है।<ref>{{cite news|last = Charbonneau|first = Louis|title = IAEA director warns of 'dirty bomb' risk|newspaper = The Washington Post|page = A15|url = http://www.highbeam.com/doc/1P2-250680.html|agency = Reuters|date = 2003-03-12|access-date = 2010-04-28|archive-url = https://web.archive.org/web/20081205004052/http://www.highbeam.com/doc/1P2-250680.html|archive-date = 2008-12-05|url-status = dead}}</ref> | |||
[[ सीज़ियम-134 ]] और 137 | <!-- 10.1016/S0098-8472(01)00124-1--> | ||
==यह भी देखें== | ==यह भी देखें== | ||
* गोइआनिया दुर्घटना, 1987 में एक प्रमुख रेडियोधर्मी संदूषण घटना जिसमें सीज़ियम-137 शामिल था। | * गोइआनिया दुर्घटना, 1987 में एक प्रमुख रेडियोधर्मी संदूषण घटना जिसमें सीज़ियम-137 शामिल था। | ||
* [[ क्रामाटोर्स्क रेडियोलॉजिकल दुर्घटना ]], | * [[ क्रामाटोर्स्क रेडियोलॉजिकल दुर्घटना |क्रामाटोर्स्क रेडियोलॉजिकल दुर्घटना]], 1980 और 1989 के बीच एक और 137Cs घटना। | ||
* | * 1998 में एसरिनॉक्स दुर्घटना, सीज़ियम-137 संदूषण दुर्घटना। | ||
{{Subject bar | {{Subject bar | ||
|portal=Chemistry | |portal=Chemistry | ||
| Line 364: | Line 366: | ||
*अनुकूली फिल्टर | *अनुकूली फिल्टर | ||
*अध्यारोपण सिद्धांत | *अध्यारोपण सिद्धांत | ||
*कदम की | *कदम की अभिक्रिया | ||
*राज्य स्थान (नियंत्रण) | *राज्य स्थान (नियंत्रण) | ||
*नियंत्रण प्रणाली | *नियंत्रण प्रणाली | ||
| Line 590: | Line 592: | ||
*शैक्षिक | *शैक्षिक | ||
*आपूर्ती बंद करने की आवृत्ति | *आपूर्ती बंद करने की आवृत्ति | ||
* | *अभिक्रिया (इलेक्ट्रॉनिक्स) | ||
*अण्डाकार फिल्टर | *अण्डाकार फिल्टर | ||
*सीरिज़ सर्किट) | *सीरिज़ सर्किट) | ||
| Line 682: | Line 684: | ||
*डाउनस्ट्रीम (कंप्यूटर विज्ञान) | *डाउनस्ट्रीम (कंप्यूटर विज्ञान) | ||
*आवृत्ति द्वैध | *आवृत्ति द्वैध | ||
*आवृत्ति | *आवृत्ति अभिक्रिया | ||
*आकड़ों की योग्यता | *आकड़ों की योग्यता | ||
*परीक्षण के अंतर्गत उपकरण | *परीक्षण के अंतर्गत उपकरण | ||
| Line 725: | Line 727: | ||
*निरंतर संकेत | *निरंतर संकेत | ||
*व्यावर्तित जोड़ी | *व्यावर्तित जोड़ी | ||
*आवृत्ति स्पेक्ट्रम | *आवृत्ति वर्णक्रम (स्पेक्ट्रम) | ||
*जुड़वां सीसा | *जुड़वां सीसा | ||
*नेटवर्क विश्लेषण (विद्युत सर्किट) | *नेटवर्क विश्लेषण (विद्युत सर्किट) | ||
| Line 744: | Line 746: | ||
*ऊर्जा का रूप | *ऊर्जा का रूप | ||
*repeatability | *repeatability | ||
* | *अभिक्रिया (इंजीनियरिंग) | ||
*बिजली का शोर | *बिजली का शोर | ||
*संचार प्रणाली | *संचार प्रणाली | ||
| Line 993: | Line 995: | ||
*विरल करना | *विरल करना | ||
*समतल लहर | *समतल लहर | ||
*ध्वनि का | *ध्वनि का दाब | ||
*ध्वनि तीव्रता | *ध्वनि तीव्रता | ||
*रुद्धोष्म प्रक्रिया | *रुद्धोष्म प्रक्रिया | ||
| Line 1,099: | Line 1,101: | ||
*पदार्थ विज्ञान | *पदार्थ विज्ञान | ||
*परमाणु क्रमांक | *परमाणु क्रमांक | ||
* | *समस्थानिक | ||
*श्वसन संबंधी रोग | *श्वसन संबंधी रोग | ||
*तत्व का पता लगाएं | *तत्व का पता लगाएं | ||
| Line 1,169: | Line 1,171: | ||
*नापाक | *नापाक | ||
*दूसरा | *दूसरा | ||
* | *रेडियोसमस्थानिक | ||
*उत्सर्जन चित्र | *उत्सर्जन चित्र | ||
*लचीलापन | *लचीलापन | ||
| Line 1,178: | Line 1,180: | ||
*कटियन | *कटियन | ||
*ऋणायन | *ऋणायन | ||
*अरहेनियस | *अरहेनियस क्षार | ||
*काल्कोजन | *काल्कोजन | ||
*लुईस | *लुईस क्षार | ||
*सीज़ियम फ्लोराइड | *सीज़ियम फ्लोराइड | ||
*आदिम कोशिका | *आदिम कोशिका | ||
| Line 1,194: | Line 1,196: | ||
*फिटकिरी | *फिटकिरी | ||
*निक्षालन (धातु विज्ञान) | *निक्षालन (धातु विज्ञान) | ||
*शुद्ध | *शुद्ध जल | ||
*एल्कलाइन अर्थ मेटल | *एल्कलाइन अर्थ मेटल | ||
*परमाण्विक भार | *परमाण्विक भार | ||
| Line 1,226: | Line 1,228: | ||
{{Caesium compounds}} | {{Caesium compounds}} | ||
{{Authority control}} | {{Authority control}} | ||
[[Category: | [[Category:AC with 0 elements]] | ||
[[Category:Articles containing Latin-language text]] | |||
[[Category:Articles with hAudio microformats]] | |||
[[Category:Articles with hatnote templates targeting a nonexistent page]] | |||
[[Category:Articles with invalid date parameter in template]] | |||
[[Category:Articles with short description]] | |||
[[Category:CS1]] | |||
[[Category:CS1 Deutsch-language sources (de)]] | |||
[[Category:CS1 English-language sources (en)]] | |||
[[Category:CS1 maint]] | |||
[[Category:Collapse templates]] | |||
[[Category:Created On 05/09/2022]] | [[Category:Created On 05/09/2022]] | ||
[[Category:Machine Translated Page]] | |||
[[Category:Navigational boxes| ]] | |||
[[Category:Navigational boxes without horizontal lists]] | |||
[[Category:Pages with empty portal template]] | |||
[[Category:Pages with script errors]] | |||
[[Category:Portal templates with redlinked portals]] | |||
[[Category:Short description with empty Wikidata description]] | |||
[[Category:Sidebars with styles needing conversion]] | |||
[[Category:Spoken articles]] | |||
[[Category:Template documentation pages|Documentation/doc]] | |||
[[Category:Templates generating microformats]] | |||
[[Category:Templates that are not mobile friendly]] | |||
[[Category:Templates used by AutoWikiBrowser|Cite web]] | |||
[[Category:Templates using TemplateData]] | |||
[[Category:WikiProject Elements pages using ENGVAR|OED]] | |||
[[Category:Wikipedia articles needing clarification from July 2022]] | |||
[[Category:Wikipedia metatemplates]] | |||
[[Category:कम करने वाले एजेंट]] | |||
[[Category:क्षार धातु]] | |||
[[Category:ग्लाइसिन रिसेप्टर एगोनिस्ट]] | |||
[[Category:रासायनिक तत्व]] | |||
[[Category:वीडियो क्लिप वाले लेख]] | |||
[[Category:शरीर-केंद्रित घन संरचना वाले रासायनिक तत्व]] | |||
[[Category:सीज़ियम| ]] | |||
Latest revision as of 22:38, 11 October 2022
 | ||||||||||||||||||||||||||||
| Caesium | ||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| उच्चारण | /ˈsiːziəm/ | |||||||||||||||||||||||||||
| Alternative name | cesium (US) | |||||||||||||||||||||||||||
| दिखावट | pale gold | |||||||||||||||||||||||||||
| Standard atomic weight Ar°(Cs) |
| |||||||||||||||||||||||||||
| Caesium in the periodic table | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
| Atomic number (Z) | 55 | |||||||||||||||||||||||||||
| समूह | group 1: hydrogen and alkali metals | |||||||||||||||||||||||||||
| अवधि | period 6 | |||||||||||||||||||||||||||
| ब्लॉक | s-block | |||||||||||||||||||||||||||
| ऋणावेशित सूक्ष्म अणु का विन्यास | [Xe] 6s1 | |||||||||||||||||||||||||||
| प्रति शेल इलेक्ट्रॉन | 2, 8, 18, 18, 8, 1 | |||||||||||||||||||||||||||
| भौतिक गुण | ||||||||||||||||||||||||||||
| Phase at STP | solid | |||||||||||||||||||||||||||
| गलनांक | 301.7 K (28.5 °C, 83.3 °F) | |||||||||||||||||||||||||||
| क्वथनांक | 944 K (671 °C, 1240 °F) | |||||||||||||||||||||||||||
| Density (near r.t.) | 1.93 g/cm3 | |||||||||||||||||||||||||||
| when liquid (at m.p.) | 1.843 g/cm3 | |||||||||||||||||||||||||||
| क्रिटिकल पॉइंट | 1938 K, 9.4 MPa[2] | |||||||||||||||||||||||||||
| संलयन की गर्मी | 2.09 kJ/mol | |||||||||||||||||||||||||||
| Heat of vaporization | 63.9 kJ/mol | |||||||||||||||||||||||||||
| दाढ़ गर्मी क्षमता | 32.210 J/(mol·K) | |||||||||||||||||||||||||||
Vapour pressure
| ||||||||||||||||||||||||||||
| परमाणु गुण | ||||||||||||||||||||||||||||
| ऑक्सीकरण राज्य | −1, +1[3] (a strongly basic oxide) | |||||||||||||||||||||||||||
| इलेक्ट्रोनगेटिविटी | Pauling scale: 0.79 | |||||||||||||||||||||||||||
| Ionization energies |
| |||||||||||||||||||||||||||
| परमाणु का आधा घेरा | empirical: 265 pm | |||||||||||||||||||||||||||
| सहसंयोजक त्रिज्या | 244±11 pm | |||||||||||||||||||||||||||
| [वैन डेर वाल्स रेडियस]] | 343 pm | |||||||||||||||||||||||||||
| Spectral lines of caesium | ||||||||||||||||||||||||||||
| अन्य गुण | ||||||||||||||||||||||||||||
| प्राकृतिक घटना | primordial | |||||||||||||||||||||||||||
| क्रिस्टल की संरचना | body-centred cubic (bcc) | |||||||||||||||||||||||||||
| थर्मल विस्तार | 97 µm/(m⋅K) (at 25 °C) | |||||||||||||||||||||||||||
| ऊष्मीय चालकता | 35.9 W/(m⋅K) | |||||||||||||||||||||||||||
| विद्युत प्रतिरोधकता | 205 nΩ⋅m (at 20 °C) | |||||||||||||||||||||||||||
| चुंबकीय आदेश | paramagnetic[4] | |||||||||||||||||||||||||||
| यंग मापांक | 1.7 GPa | |||||||||||||||||||||||||||
| थोक मापांक | 1.6 GPa | |||||||||||||||||||||||||||
| मोहन कठोरता | 0.2 | |||||||||||||||||||||||||||
| ब्रिनेल हार्डनेस | 0.14 MPa | |||||||||||||||||||||||||||
| CAS नंबर | 7440-46-2 | |||||||||||||||||||||||||||
| History | ||||||||||||||||||||||||||||
| नामी | from Latin caesius, sky blue, for its spectral colours | |||||||||||||||||||||||||||
| खोज] | Robert Bunsen and Gustav Kirchhoff (1860) | |||||||||||||||||||||||||||
| पहला अलगाव | Carl Setterberg (1882) | |||||||||||||||||||||||||||
| Main isotopes of caesium | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
सीज़ियम (IUPAC वर्तनी[6]) (या अमेरिकी अंग्रेजी में सीज़ियम)[note 1] एक रासायनिक तत्व है जिसका प्रतीक Cs और परमाणु क्रमांक 55 होता है। यह एक नरम, चांदी की तरह चमकती-सुनहरी क्षार धातु होती है जिसका गलनांक 28.5 °C (83.3 °F) होता है, जो इसे केवल पांच मौलिक धातुओं में से एक बनाते है जो कमरे के तापमान पर या उसके पास तरल अवस्था में होते है।[note 2] सीज़ियम में भौतिक और रासायनिक गुण रूबिडीयाम और पोटैशियम के समान होते हैं। सभी धातुओं में सबसे अधिक अभिक्रियाशील, यह स्वतः ज्वलनी (पायरोफोरिक) है और −116 °C (−177 °F) पर भी जल के साथ अभिक्रिया करता है। पॉलिंग पैमाने पर 0.79 के मान के साथ यह सबसे कम विद्युत ऋणात्मक तत्व है। इसमें केवल एक स्थायी समस्थानिक, सीज़ियम -133 है। सीज़ियम का मुख्य रूप से पॉल्युसाइट से खनन किया जाता है। सबसे अधिक समस्थानिक वाले तत्वों में से एक सीज़ियम तत्व में बेरियम और पारा के साथ 40 ज्ञात समस्थानिक हैं।[11] सीज़ियम-137, परमाणु रिएक्टरों परमाणु द्वारा उत्पादित अपशिष्ट से प्राप्त विखंडन उत्पाद है।[why?]
जर्मन रसायन वैज्ञानिक रॉबर्ट बन्सेन और भौतिक विज्ञानी गुस्ताव किरचॉफ ने 1860 में लौ स्पेक्ट्रोस्कोपी की नई विकसित विधि द्वारा सीज़ियम की खोज की। सीज़ियम के लिए पहले छोटे पैमाने पर अनुप्रयोग निर्वात नलिका (वैक्यूम ट्यूबों) और सौर सेल में "गेट्टर" के रूप में थे। 1967 में, अल्बर्ट आइंस्टीन के इस प्रमाण पर कार्य करते हुए कि ब्रह्मांड में प्रकाश की गति सबसे स्थिर आयाम है, इकाइयों की अंतर्राष्ट्रीय प्रणाली ने सेकंड और मीटर को सह-परिभाषित करने के लिए सीज़ियम -133 के उत्सर्जन वर्णक्रम (स्पेक्ट्रम) से दो विशिष्ट तरंग गणना का उपयोग किया। अतः उस समय से सीज़ियम का उपयोग व्यापक रूप से अत्यधिक यथार्थ परमाण्विक घड़ियों मे किया जाने लगा।
1990 के दशक के बाद से, तत्व का सबसे बड़ा अनुप्रयोग प्रवेधन तरल पदार्थ के लिए सीज़ियम प्रारूप के रूप में रहा है, लेकिन इसमें बिजली के उत्पादन, इलेक्ट्रॉनिक्स में और रसायन विज्ञान में कई तरह के अनुप्रयोग हैं। रेडियोधर्मी समस्थानिक सीज़ियम-137 का अर्ध आयु लगभग 30 वर्ष होती है और इसका उपयोग चिकित्सा अनुप्रयोगों, औद्योगिक गेज और जल विज्ञान (हाइड्रोलॉजी) में किया जाता है। गैर-रेडियोधर्मी सीज़ियम यौगिक केवल हल्के से विषाक्त होते हैं, लेकिन शुद्ध धातु की जल के साथ विस्फोटक अभिक्रिया करने की प्रवृत्ति अर्थात सीज़ियम को एक खतरनाक सामग्री माना जाता है, और रेडियोसमस्थानिक पर्यावरण में एक महत्वपूर्ण आरोग्य और पारिस्थितिक विपत्ति प्रस्तुत करते हैं।
विशेषताएं
भौतिक गुण

कमरे के तापमान पर सभी तत्व ठोस अवस्था में होते है जिनमे से सीज़ियम सबसे नरम होता है इसकी कठोरता 0.2 Mohs की कठोरता होती है। यह एक बहुत ही तन्य, पीली धातु है, जो थोड़ी मात्रा में ऑक्सीजन की उपस्थिति में काली हो जाती है।[12][13][14] जब खनिज तेल (जहां इसे परिवहन के दौरान सबसे अच्छे से रखा जाता है) की उपस्थिति में, यह अपनी धात्विक चमक खो देता है एक नीरस, स्लेटी (ग्रे) रूप धारण कर लेता है। यह गलनांक 28.5 °C (83.3 °F), कमरे के तापमान पर तरल अवस्था में होता है। पारा एकमात्र स्थायी तत्व धातु है जिसका गलनांक सीज़ियम से कम होता है।[15] इसके अलावा, धातु का क्वथनांक 641 °C (1,186 °F), काफी कम होता है, पारे के अलावा अन्य सभी धातुओं में सबसे कम।[16] इसके यौगिक नीले[17][18] या बैंगनी[18] रंग की ज्वाला के साथ जलते हैं।
सीज़ियम सोना और पारा (अमलगम), अन्य क्षार धातुओं के साथ मिश्र धातु बनाता है। यह 650 °C (1,202 °F) से कम तापमान पर, कोबाल्ट, लोहा, मोलिब्डेनम, निकल, प्लैटिनम, टैंटलम या टंगस्टन के साथ मिश्र धातु नहीं बनाता। यह ऐन्टिमनी, गैलियम, ईण्डीयम और थोरियम के साथ सुनिश्चित अंतरधात्विक यौगिक बनाता है, जो प्रकाश संश्लेषक होते है।[12] यह अन्य सभी क्षार धातुओं (लिथियम को छोड़कर) के साथ मिश्रित हो जाता है, 41% सीज़ियम, 47% पोटेशियम और 12% सोडियम के मोलर वितरण के मिश्र धातु में −78 °C (−108 °F) पर किसी भी ज्ञात मिश्र धातु का सबसे कम गलनांक होता है।[15][19] कुछ मिश्रणों का अध्ययन किया गया है: CsHg
2 बैंगनी धात्विक चमक के साथ काले रंग का होता है, जबकि CsHg धात्विक चमक के साथ सुनहरे रंग का होता है।[20]
सीज़ियम का सुनहरा रंग समूह के अवरोही होने पर क्षार धातुओं के इलेक्ट्रॉनों को उत्तेजित करने के लिए आवश्यक प्रकाश की घटती आवृत्ति के कारन प्राप्त होता है। रूबिडियम से लिथियम के लिए यह आवृत्ति पराबैंगनी क्षेत्र में होती है, लेकिन सीज़ियम के लिए यह वर्णक्रम (स्पेक्ट्रम) के अंत में नीले-बैंगनी क्षेत्र में प्रवेश करती है, दूसरे शब्दों में, क्षार धातुओं की प्लाज्मा आवृति लिथियम से सीज़ियम तक कम हो जाती है। इस प्रकार सीज़ियम बैंगनी प्रकाश को प्रेषित करता है और आंशिक रूप से अवशोषित करता है जबकि अन्य रंग (कम आवृत्ति वाले) परावर्तित होते हैं; इसलिए यह पीले रंग का दिखाई देता है।[21]
रासायनिक गुण
सीज़ियम धातु अत्यधिक अभिक्रियाशील और स्वत: ज्वलनशील होती है। यह हवा में स्वतः प्रज्वलित होता है, और कम तापमान पर भी जल के साथ अन्य क्षार धातुओं (आवर्त सारणी के पहले वर्ग) की तुलना में अधिक विस्फोटक रूप से अभिक्रिया करता है।[15] यह −116 °C (−177 °F) तक के न्यूनतम तापमान पर बर्फ के साथ अभिक्रिया करता है।[12] इस उच्च अभिक्रियाशीलता के कारण, सीज़ियम धातु को एक खतरनाक सामग्री के रूप में वर्गीकृत किया गया है। इसे खनिज तेल जैसे शुष्क, संतृप्त हाइड्रोकार्बन में संग्रहीत और स्थानांतरित किया जाता है। इसे केवल अक्रिय गैस, जैसे आर्गन के तहत नियंत्रित किया जा सकता है। हालांकि, सीज़ियम-जल विस्फोट अक्सर सोडियम-जल के विस्फोट से कम शक्तिशाली होता है जिसमें सोडियम की समान मात्रा होती है। इसका कारण यह है कि जल के संपर्क में आने पर सीज़ियम शीघ्र ही विस्फोट कर जाता है, जिससे हाइड्रोजन को एकत्रित होने में बहुत कम समय लगता है।[22] सीज़ियम को निर्वात सील बोरोसिलिकेट ग्लास एम्पाउल्स में संग्रहित किया जा सकता है। लगभग 100 grams (3.5 oz) से अधिक मात्रा में, सीज़ियम को भली भांति बंद करके, जंगरोधी स्टील के पात्र में स्थानांतरित किया जाता है।[12]
सीज़ियम की रसायन अन्य क्षार धातुओं के समान है, विशेष रूप से आवर्त सारणी में सीज़ियम से ऊपर के तत्व रूबिडियम के समान।[23] जैसा कि क्षार धातु के लिए अपेक्षित है, केवल +1 सामान्य ऑक्सीकरण अवस्था है।[note 3] इस तथ्य से कुछ सधारण अंतर जैसे कि इसका परमाणु द्रव्यमान अधिक होता है और अन्य (गैर-रेडियोधर्मी) क्षार धातुओं की तुलना में अधिक विद्युत-धनात्मक होते है, उत्पन्न होते हैं।[25] सीज़ियम सबसे विद्युत धनात्मक रासायनिक तत्व है।[note 4][15] सीज़ियम आयन भी हल्का क्षार धातुओं की तुलना में बड़ा और कम "कठोर" होता है।
यौगिक

अधिकांश सीज़ियम यौगिकों में तत्व धनायन Cs+ होता है, जो आयनिक रूप से विभिन्न प्रकार के आयनों से बंधता है। एक उल्लेखनीय अपवाद केसाइड आयन (Cs−
),[3] है और अन्य कई उपऑक्साइड हैं (नीचे ऑक्साइड पर अनुभाग देखें)। हाल ही में, सीज़ियम को पी-ब्लॉक तत्व के रूप में प्रस्तावितक रने की भविष्यवाणी की गई है और उच्च दाब के अंतर्गत उच्च ऑक्सीकरण अवस्था (अर्थात, n> 1 के साथ CsFn) के साथ उच्च फ्लोराइड बनाने में सक्षम है।[27] इस भविष्यवाणी को और प्रयोगों द्वारा सत्यापित करने की आवश्यकता है।[28]
Cs+ के लवण आमतौर पर रंगहीन होते हैं, जब तक कि आयन स्वयं रंगीन न हो। कई साधारण लवण आर्द्रताग्राही (हाइग्रोस्कोपिक) होते हैं, लेकिन हल्के क्षार धातुओं के संबंधित लवणों की तुलना में कम होते हैं। फास्फेट,[29] एसीटेट, कार्बोनेट, हैलाइड्स, ऑक्साइड, नाइट्रेट, और सल्फेट लवण जल में घुलनशील होते हैं। द्विक लवण अक्सर कम घुलनशील होते हैं, और सीज़ियम एल्युमिनियम सल्फेट की कम घुलनशीलता का उपयोग अयस्कों से Cs के शोधन में किया जाता है। ऐन्टिमनी (जैसे CsSbCl
4), बिस्मथ, कैडमियम, तांबा, लोहा और सीसा के साथ द्विक लवण भी बहुत कम घुलनशील होते है।[12]
सीज़ियम हाइड्रॉक्साइड (CsOH) आर्द्रताग्राही (हाइग्रोस्कोपिक) और अत्यधिक क्षारीय होता है।[23] यह सिलिकॉन जैसे अर्धचालकों की सतह को तेजी से उकेरता है।[30] CsOH को पहले रसायनज्ञों द्वारा "सबसे प्रबल क्षार" माना जाता था, जो बड़े Cs+ आयन और OH− के बीच अपेक्षाकृत कमजोर आकर्षण को दर्शाता है,[17] यह वास्तव में सबसे प्रबल अरहेनियस क्षार है, हालाँकि, कई यौगिक जैसे n-ब्यूटिलिथियम, सोडियम एमाइड, सोडियम हाइड्राइड, सीज़ियम हाइड्राइड आदि, जो इसके साथ तीव्र अभिक्रिया के रूप में जल में घुल नहीं सकता, बल्कि केवल कुछ निर्जल ध्रुवीय ऐप्रोटिक विलायक में उपयोग किया जाता है, यह ब्रोंस्टेड-लोरी अम्ल-क्षार सिद्धांत के आधार पर अत्यधिक क्षारीय होते हैं।[23]
सीज़ियम और सोने का स्टोइकोमीट्रिक मिश्रण गर्म करने पर पीला सीज़ियम ऑराइड (Cs+Au−) बनाने के लिए अभिक्रिया करता है। यहाँ का ऑराइड आयन एक आभासी हैलोजन (स्यूडोहैलोजन) की तरह व्यवहार करता है। यौगिक जल के साथ तीव्रता से अभिक्रिया करता है, जिससे सीज़ियम हाइड्रॉक्साइड, धातु सोना और हाइड्रोजन गैस निकलती है, तरल अमोनिया में टेट्रामेथाइलमोनियम ऑराइड का उत्पादन करने के लिए इसे सीज़ियम-विशिष्ट आयन विनिमय रेज़िन के साथ अभिक्रिया दी जा सकती है। समान प्लेटिनम यौगिक, लाल सीज़ियम प्लैटिनाइड (Cs2Pt), में प्लैटिनाइड आयन होता है जो एक स्यूडोचालकोजन के रूप में व्यवहार करता है।[31]
संकुल
सभी धातु धनायनों की तरह, Cs+ विलयन में लुईस क्षार के साथ संकुल बनाता है। अपने बड़े आकार के कारण, Cs+ आमतौर पर 6 से अधिक समन्वय संख्या रखता है, जो छोटे क्षार धातु उद्धरणों के लिए विशिष्ट संख्या है। CsCl के 8-समन्वय में यह अंतर स्पष्ट है। यह उच्च समन्वय संख्या और कोमलता (सहसंयोजक बंधन बनाने की प्रवृत्ति) नाभिकीय अपशिष्ट के उपचार में Cs+ को अन्य धनायनों से अलग करने में उपयोग किए जाने वाले गुण हैं, जहाँ 137Cs+ को बड़ी मात्रा में गैर-रेडियोधर्मी K+ से अलग किया जाना चाहिए।[32]
हैलाइड्स
सीज़ियम फ्लोराइड (CsF) एक आर्द्रताग्राही (हाइग्रोस्कोपिक) सफेद ठोस है जिसका व्यापक रूप से फ्लोराइड आयनों के स्रोत के रूप में ऑर्गनोफ्लोरीन रसायन विज्ञान में उपयोग किया जाता है।[33] सीज़ियम फ्लोराइड में हैलाइट संरचना होती है, जिसका अर्थ है कि Cs+ और F− एक घन निकटतम पैक्ड सरणी में पैक होते हैं जैसे सोडियम क्लोराइड में Na+ और Cl− करते हैं।[23] विशेष रूप से, सभी ज्ञात तत्वों में सीज़ियम और फ्लोरीन में क्रमशः सबसे कम और उच्चतम विद्युतऋणात्मकता होती है।

सीज़ियम क्लोराइड (CsCl) साधारण घन क्रिस्टल प्रणाली में क्रिस्टलीकृत होता है। इसे "सीज़ियम क्लोराइड संरचना" भी कहा जाता है,[25] यह संरचनात्मक रूपांकन दो-परमाणु आधार के साथ एक आदिम घन जाली से बना है, प्रत्येक आठ गुना समन्वय के साथ, क्लोराइड परमाणु घन के किनारों पर जाली बिंदुओं पर स्थित होते हैं, जबकि सीज़ियम परमाणु घनो के केंद्र में छिद्र में होते हैं। इस संरचना को CsBr और CsI, और कई अन्य यौगिकों के साथ साझा किया जाता है जिनमें Cs नहीं होता है। इसके विपरीत, अधिकांश अन्य क्षारीय हैलाइड में सोडियम क्लोराइड (NaCl) संरचना होती है।[25] CsCl संरचना को प्राथमिकता दी जाती है क्योंकि Cs+ की आयनिक त्रिज्या 174 pm और Cl− 181 pm है।[35]
ऑक्साइड

अन्य क्षार धातुओं की तुलना में, सीज़ियम ऑक्सीजन के साथ कई द्वयंगी यौगिक बनाता है। जब सीज़ियम हवा में जलता है, तो सुपरऑक्साइड CsO
2 मुख्य उत्पाद प्राप्त होता है।[36] "सामान्य" सीज़ियम ऑक्साइड (Cs
2O) पीले-नारंगी हेक्सागोनल क्रिस्टल बनाता है,[37] और CdCl
2 विरोधी प्रकार का एकमात्र ऑक्साइड है।[38] यह 250 °C (482 °F) पर वाष्पीकृत हो जाता है और 400 °C (752 °F) से ऊपर के तापमान पर सीज़ियम धातु और परऑक्साइड Cs
2O
2 को विघटित कर देता है। सुपरऑक्साइड और ओजोनाइड CsO
3,[39][40] के अलावा कई चमकीले रंग के उपऑक्साइड का भी अध्ययन किया गया है।[41] इनमें Cs
7O, Cs
4O, Cs
11O
3, Cs
3O (गहरा-हरा[42]), CsO, Cs
3O
2,[43] और साथ ही Cs
7O
2 शामिल हैं।[44][45] उत्तरार्द्ध को Cs
2O उत्पन्न करने के लिए निर्वात में गर्म किया जाता है।[38] सल्फर, सेलेनियम, और टेल्यूरियम के साथ द्वयंगी यौगिक भी उपस्थित होते है।[12]
समस्थानिक
सीज़ियम में 40 ज्ञात समस्थानिक हैं, जिनकी द्रव्यमान संख्या (अर्थात् नाभिक में न्यूक्लियंस की संख्या) 112 से 151 तक है। इनमें से कई पुराने सितारों के अंदर मंद न्यूट्रॉन कैप्चर प्रक्रिया (S-प्रक्रिया) द्वारा हल्के तत्वों से संश्लेषित किए जाते हैं[46] और सुपरनोवा विस्फोटों में R-प्रक्रिया द्वारा।[47] 78 न्यूट्रॉन के साथ एकमात्र स्थायी सीज़ियम समस्थानिक 133Cs है। यद्यपि इसमें एक बड़ा नाभिकीय स्पिन (7/2+) है, नाभिकीय चुंबकीय अनुनाद अध्ययन इस समस्थानिक का उपयोग 11.7 MHz की प्रतिध्वनि आवृत्ति पर कर सकता है।[48]
रेडियोधर्मी 135Cs का लगभग 2.3 मिलियन वर्षों की बहुत लंबा अर्ध आयु होती है, जो सीज़ियम के सभी रेडियोधर्मी समस्थानिकों में सबसे लंबा है। 137Cs और 134Cs में क्रमशः 30 और दो वर्ष की अर्ध आयु होती है। 137Cs बीटा क्षय द्वारा अल्पकालिक 137mBa और फिर गैर-रेडियोधर्मी बेरियम में विघटित हो जाता है, जबकि 134Cs सीधे 134Ba में बदल जाता है। 129, 131, 132 और 136 की द्रव्यमान संख्या वाले समस्थानिकों का अर्ध आयु एक दिन और दो सप्ताह के बीच होता है, जबकि अधिकांश अन्य समस्थानिकों का अर्ध आयु कुछ सेकंड से लेकर एक सेकंड के अंश तक होता है। कम से कम 21 मितस्थायी (मेटास्टेबल) नाभिकीय समायवयव मौजूद हैं। 134mCs के अलावा (सिर्फ 3 घंटे से कम के अर्ध आयु के साथ), सभी बहुत अस्थिर हैं और कुछ मिनटों या उससे कम के अर्ध आयु के साथ क्षय होते हैं।[49][50]
समस्थानिक 135Cs परमाणु रिएक्टरों में उत्पादित यूरेनियम के दीर्घकालिक विखंडन उत्पादों में से एक है।[51] हालांकि, अधिकांश रिएक्टरों में इस विखंडन उत्पाद की उपज कम हो जाती है क्योंकि पूर्ववर्ती, 135Xe, प्रभावकारी न्यूट्रॉन घातक है और 135Cs तक क्षय होने से पहले अक्सर स्थिर 136Xe में परिवर्तित हो जाता है।[52][53]
137Cs से 137mBa तक बीटा क्षय गामा विकिरण का एक प्रबल उत्सर्जन होता है।[54] 137Cs और 90Sr परमाणु विखंडन के प्रमुख मध्यम-जीवित उत्पाद हैं, और कई सौ वर्षों तक चलने वाले शीतलन के कई वर्षों के बाद खर्च किए गए परमाणु ईंधन से रेडियोधर्मिता के प्रमुख स्रोत हैं।[55] चेरनोबिल आपदा के क्षेत्र में वे दो समस्थानिक अवशिष्ट रेडियोधर्मिता का सबसे बड़ा स्रोत हैं।[56] कम कैप्चर दर के कारण, न्यूट्रॉन कैप्चर के माध्यम से 137Cs प्रवृत्त करना संभव नहीं है और इसका एकमात्र वर्तमान समाधान समय के साथ इसे क्षय होने देना है।[57]
वे सीज़ियम जो नाभिकीय विखंडन से उत्पादित है, मूल रूप से अधिक न्यूट्रॉन युक्त विखंडन उत्पादों के बिटा क्षय से प्राप्त होते है, जो ज़िनॉन और आयोडीन के विभिन्न समस्थानिकों से गुजरते हैं।[58] क्योंकि आयोडीन और ज़िनॉन अस्थिर होते हैं और परमाणु ईंधन या वायु के माध्यम से फैल सकते हैं, रेडियोधर्मी सीज़ियम अक्सर विखंडन की मूल साइट से बहुत दूर बनाया जाता है।[59] 1950 के दशक में 1980 के दशक में परमाणु हथियारों के परीक्षण के साथ, 137Cs को वायुमंडल में छोड़ा गया और रेडियोधर्मी अवपात के एक घटक के रूप में पृथ्वी की सतह पर लौट आया। यह उस समय से मिट्टी और तलछट की गति का एक तैयार अंकन (मार्कर) है।[12]
उपस्थिति
सीज़ियम एक अपेक्षाकृत दुर्लभ तत्व है, जिसका अनुमान भू पर्पटी में प्रति मिलियन औसतन 3 भाग है।[60] यह 45वां सबसे प्रचुर तत्व है और धातुओं में 36वां है। फिर भी, यह ऐन्टिमनी, कैडमियम, टिन और टंगस्टन जैसे तत्वों की तुलना में अधिक प्रचुर मात्रा में होता है, और पारा और चांदी की तुलना में परिमाण के दो क्रम अधिक प्रचुर मात्रा में हैं, यह रुबिडियम के रूप में 3.3% प्रचुर मात्रा में है, जिसके साथ यह रासायनिक रूप से निकटता से जुड़ा हुआ है।[12]
अपने बड़े आयनिक त्रिज्या के कारण, सीज़ियम "असंगत तत्वों" में से एक है।[61] मैग्मा क्रिस्टलीकरण के दौरान, सीज़ियम तरल प्रावस्था में सांद्रित होता है और अंतिम क्रिस्टलीकरण करता है। इसलिए, सीज़ियम का सबसे बड़ा भंडार इस संवर्धन प्रक्रिया द्वारा गठित ज़ोन पेग्माटाइट अयस्क निकाय हैं। चूंकि सीज़ियम पोटाशियम को उतनी आसानी से प्रतिस्थापित नहीं करता जितना रूबिडियम करता है, क्षार वाष्पित खनिज सिल्वाइट (KCl) और कार्नेलाइट (KMgCl
3·6H
2O) में केवल 0.002% सीज़ियम हो सकता है। परिणामस्वरूप, सीज़ियम कुछ खनिजों में पाया जाता है। सीज़ियम की प्रतिशत मात्रा बेरिल (Be
3Al
2(SiO
3)
6) और अवोगाद्राइट ((K,Cs)BF
4) में पाई जा सकती है, 15 wt% Cs2O तक बारीकी से संबंधित खनिज पेज़ोटाटाइट (Cs(Be
2Li)Al
2Si
6O
18) में, 8.4 तक wt% Cs2O दुर्लभ खनिज लोंडोनाईट में ((Cs,K)Al
4Be
4(B,Be)
12O
28), और अधिक व्यापक रोडिज़ाइट में कम।[12] सीज़ियम के लिए एकमात्र आर्थिक रूप से महत्वपूर्ण अयस्क पॉल्युसाइट Cs(AlSi
2O
6) है, जो दुनिया भर में कुछ स्थानों पर ज़ोनड पेगमाटाइट्स में पाया जाता है, जो कि अधिक व्यावसायिक रूप से महत्वपूर्ण लिथियम खनिजों, लेपिडोलाइट और पेटलाइट से जुड़ा है। पेग्माटाइट्स के भीतर, बड़े अनाज के आकार और खनिजों के मजबूत पृथक्करण के परिणामस्वरूप खनन के लिए उच्च श्रेणी का अयस्क प्राप्त होता है।[62]
सीज़ियम का दुनिया का सबसे महत्वपूर्ण और सबसे समृद्ध ज्ञात स्रोत, मैनिटोबा, कनाडा में बर्निक झील में टैंको खदान है, जिसमें अनुमानित रूप से 350,000 मीट्रिक टन पॉल्युसाइट अयस्क है, जो दुनिया के आरक्षित क्षार के दो-तिहाई से अधिक का प्रतिनिधित्व करता है।[62][63] हालांकि पॉल्युसाइट में सीज़ियम की स्टोइकोमेट्रिक सामग्री 42.6% है, इस एकत्रित से शुद्ध पॉल्युसाइट नमूनों में केवल 34% सीज़ियम होता है, जबकि औसत सामग्री 24 wt% होती है।[63] वाणिज्यिक पॉल्युसाइट में 19% से अधिक सीज़ियम होता है।[64] ज़िम्बाब्वे में बिकिता पेगमाटाइट एकत्रित को इसके पेटलाइट के लिए खनन किया जाता है, लेकिन इसमें महत्वपूर्ण मात्रा में प्रदूषण भी होता है। पॉल्युसाइट का एक और उल्लेखनीय स्रोत नामिबिया के करीबिब रेगिस्तान में है।[63] प्रति वर्ष 5 से 10 मीट्रिक टन की विश्व खदान उत्पादन की वर्तमान दर पर, भंडार हजारों वर्षों तक चलेगा।[12]
उत्पादन
पॉल्युसाइट अयस्क का खनन और शोधन छोटे पैमाने पर किया जाता है जो की एक चयनात्मक प्रक्रिया है। अयस्क को बारीक टुकड़ो में तोड़ा जाता है, हाथ से छांटा जाता है, लेकिन आमतौर पर सांद्रित नहीं किया जाता है, और फिर जमीन में डाला जाता है। तब सीज़ियम को मुख्य रूप से तीन तरीकों से पॉल्युसाइट निकाला जाता है: अम्ल पाचन, क्षारीय अपघटन, और प्रत्यक्ष अपचयन।[12][65]
अम्ल पाचन में, सिलिकेट पॉलुसाइट रॉक हाइड्रोक्लोरिक (HCl), सल्फ्यूरिक (H
2SO
4), हाइड्रोब्रोमिक (HBr), या हाइड्रोफ्लोरिक (HF) जैसे प्रबल अम्ल के साथ विलीन किया जाता है। हाइड्रोक्लोरिक अम्ल के साथ, घुलनशील क्लोराइड का मिश्रण तैयार किया जाता है, और सीज़ियम के अघुलनशील क्लोराइड द्विक लवण को सीज़ियम एंटीमोनी क्लोराइड (Cs
4SbCl
7), सीज़ियम आयोडीन क्लोराइड (Cs
2ICl), या सीज़ियम हेक्साक्लोरोसेरेट (Cs
2(CeCl
6)) के रूप में अवक्षेपित किया जाता है। अलग होने के बाद, शुद्ध अवक्षेपित द्विक लवण विघटित हो जाता है, और शुद्ध CsCl जल को वाष्पित करके अवक्षेपित हो जाता है।
सल्फ्यूरिक अम्ल विधि से अघुलनशील द्विक लवण सीधे सीज़ियम फिटकरी (CsAl(SO
4)
2·12H
2O) के रूप में प्राप्त होता है। फिटकरी को कार्बन के साथ भर्जित एल्यूमीनियम सल्फेट घटक अघुलनशील अल्यूमिनियम ऑक्साइड में परिवर्तित हो जाता है, और परिणामी उत्पाद को Cs
2SO
4 मिश्रण प्राप्त करने के लिए जल से निक्षालित किया जाता है।[12]
पॉल्युसाइट को कैल्शियम कार्बोनेट और कैल्शियम क्लोराइड के साथ भर्जन से अघुलनशील कैल्शियम सिलिकेट और घुलनशील सीज़ियम क्लोराइड प्राप्त होता है। जल या तनु अमोनिया (NH
4OH) के साथ लीचिंग करने से तनु क्लोराइड (CsCl) मिश्रण प्राप्त होता है। सीज़ियम क्लोराइड का उत्पादन करने के लिए इस मिश्रण को वाष्पित किया जा सकता है या सीज़ियम फिटकरी या सीज़ियम कार्बोनेट में परिवर्तित किया जा सकता है। हालांकि व्यावसायिक रूप से साध्य नहीं है, अयस्क को सीधे सीज़ियम धातु का उत्पादन करने के लिए निर्वात में पोटेशियम, सोडियम, या कैल्शियम के साथ सीधे कम किया जा सकता है।[12]
अधिकांश खनन किए गए सीज़ियम (लवण के रूप में) को तेल प्रवेधन जैसे अनुप्रयोगों के लिए सीधे सीज़ियम प्रारूप (HCOO−Cs+) में बदल दिया जाता है। विकासशील व्यापार की आपूर्ति के लिए, कैबोट निगम ने 1997 में मैनिटोबा में बर्निक झील के पास टैंको खदान में 12,000 barrels (1,900 m3) प्रति वर्ष सीज़ियम प्रारूप समाधान की क्षमता के साथ एक उत्पादन संयंत्र बनाया।[66] सीज़ियम के प्राथमिक छोटे पैमाने के व्यावसायिक यौगिक सीज़ियम नाइट्रेट और क्लोराइड हैं।[67]
वैकल्पिक रूप से, सीज़ियम धातु अयस्क से प्राप्त शुद्ध यौगिकों से प्राप्त की जा सकती है। सीज़ियम क्लोराइड और अन्य सीज़ियम हलाइड्स को कैल्शियम या बेरियम के साथ 700 to 800 °C (1,292 to 1,472 °F) तक कम किया जा सकता है, और सीज़ियम धातु परिणाम से आसुत हो सकती है। उसी तरह, मैग्नीशियम द्वारा एल्यूमिनेट, कार्बोनेट या हाइड्रोक्साइड को कम किया जा सकता है।[12]
संगलित (फ़्यूज़्ड) सीज़ियम साइनाइड (CsCN) के विद्युत् अपघटन द्वारा धातु को भी अलग किया जा सकता है। असाधारण रूप से शुद्ध और गैस मुक्त सीज़ियम का उत्पादन सीज़ियम एज़ाइड CsN
3 के 390 °C (734 °F) ऊष्मीय अपघटन द्वारा किया जा सकता है, जिसे जलीय सीज़ियम सल्फेट और बेरियम एज़ाइड से उत्पादित किया जा सकता है।[65] निर्वात अनुप्रयोगों में, अन्य गैसीय उत्पादों के बिना शुद्ध सीज़ियम धातु का उत्पादन करने के लिए ज़िरकोनियम के साथ सीज़ियम डाइक्रोमेट की अभिक्रिया की जा सकती है।[67]
- Cs
2Cr
2O
7 + 2 Zr → 2 Cs + 2 ZrO
2+ Cr
2O
3
2009 में 99.8% शुद्ध सीज़ियम (धातु आधार) की कीमत लगभग $10 per gram ($280/oz) थी, लेकिन यौगिक काफी सस्ते हैं।[63]
इतिहास
1860 में, रॉबर्ट बुन्सेन और गुस्ताव किरचॉफ ने जर्मनी के दुर्खीम से खनिज जल में सीज़ियम की खोज की। उत्सर्जन वर्णक्रम (स्पेक्ट्रम) में चमकदार नीली रेखाओं के कारण, उन्होंने यह नाम लैटिन शब्द कैसियस से लिया है, जिसका अर्थ है आकाश-नीला।[note 5][68][69][70] सीज़ियम पहला तत्व था जिसे स्पेक्ट्रोस्कोप के साथ खोजा गया था , जिसका आविष्कार बन्सन और किरचॉफ ने एक साल पहले ही किया था।[15]
सीज़ियम का शुद्ध नमूना प्राप्त करने के लिए, 44,000 litres (9,700 imp gal; 12,000 US gal) खनिज जल को 240 kilograms (530 lb) सांद्रित लवण मिश्रण प्राप्त करने के लिए वाष्पित किया जाता है। क्षारीय मृदा धातुओं को या तो सल्फेट्स या ऑक्सालेट के रूप में अवक्षेपित किया जा सकता है, क्षार धातु को विलयन में छोड़ देते है। नाइट्रेट्स में रूपांतरण और इथेनॉल के साथ निष्कर्षण के बाद, सोडियम मुक्त मिश्रण प्राप्त होता है। इस मिश्रण से लिथियम अमोनियम कार्बोनेट द्वारा अवक्षेपित होता है। पोटेशियम, रूबिडियम और सीज़ियम क्लोरोप्लाटिनिक अम्ल के साथ अघुलनशील लवण बनाते हैं, लेकिन ये लवण गर्म जल में घुलनशीलता में थोड़ा अंतर दिखाते हैं, और कम घुलनशील सीज़ियम और रूबिडियम हेक्साक्लोरोप्लाटिनेट ((Cs,Rb)2PtCl6) भिन्नात्मक क्रिस्टलीकरण द्वारा प्राप्त किए जाते है। हाइड्रोजन के साथ हेक्साक्लोरोप्लाटिनेट की कमी के बाद, सीज़ियम और रूबिडियम को एल्कोहल में उनके कार्बोनेट की घुलनशीलता के अंतर से अलग किया गया। इस प्रक्रिया से शुरुआती 44,000 लीटर खनिज जल से 9.2 grams (0.32 oz) रूबिडियम क्लोराइड और 7.3 grams (0.26 oz) सीज़ियम क्लोराइड प्राप्त होता है।[69]
सीज़ियम क्लोराइड से, दोनों वैज्ञानिकों ने नए तत्व के परमाणु भार का अनुमान 123.35 (वर्तमान में स्वीकृत 132.9 की तुलना में) पर लगाया।[69] उन्होंने पिघले हुए सीज़ियम क्लोराइड के विद्युत् अपघटन द्वारा मौलिक सीज़ियम उत्पन्न करने का प्रयास किया, लेकिन एक धातु के बजाय, उन्होंने एक नीला सजातीय पदार्थ प्राप्त किया, जो "न तो नग्न आंखों के नीचे और न ही माइक्रोस्कोप के तहत धातु पदार्थ का साधारण चिन्ह दिखाया", परिणामस्वरूप, उन्होंने इसे एक सबक्लोराइड (Cs
2Cl) के रूप में निर्दिष्ट किया। वास्तव में, उत्पाद संभवतः धातु और सीज़ियम क्लोराइड का एक कोलाइडयन मिश्रण था।[71] एक पारा कैथोड के साथ क्लोराइड के जलीय मिश्रण के इलेक्ट्रोलिसिस ने एक सीज़ियम अमलगम का उत्पादन किया जो जलीय परिस्थितियों में आसानी से विघटित हो गया।[69] शुद्ध धातु को अंततः जर्मन रसायनज्ञ कार्ल सेटरबर्ग द्वारा केकुले और बन्सन के साथ डॉक्टरेट की उपाधि प्राप्त करने के दौरान अलग कर दिया गया था।[70] 1882 में, उन्होंने सीज़ियम साइनाइड के इलेक्ट्रोलाइज़िंग द्वारा सीज़ियम धातु का उत्पादन किया, क्लोराइड के साथ समस्याओं से बचा।[72]
ऐतिहासिक रूप से, सीज़ियम का सबसे महत्वपूर्ण उपयोग अनुसंधान और विकास में किया गया है, मुख्य रूप से रासायनिक और विद्युत क्षेत्रों में। 1920 के दशक तक सीज़ियम के लिए बहुत कम अनुप्रयोग मौजूद थे, जब यह रेडियो निर्वात नलिका में उपयोग में आया, जहां इसके दो कार्य थे, एक गेट्टर के रूप में, यह निर्माण के बाद अतिरिक्त ऑक्सीजन को हटा देता है, और गर्म कैथोड पर एक कोटिंग के रूप में, यह विद्युत चालकता में वृद्धि करता है। 1950 के दशक तक सीज़ियम को उच्च प्रदर्शन वाली औद्योगिक धातु के रूप में मान्यता नहीं दी गई थी।[73] गैर-रेडियोधर्मी सीज़ियम के अनुप्रयोगों में प्रकाश विद्युत सेल, प्रकाश इलेक्ट्रॉनी संवर्धन नलिका, अवरक्त स्पेक्ट्रम प्रकाशमापी के प्रकाशिक घटक, कई कार्बनिक अभिक्रियाओं के लिए उत्प्रेरक, किरणोत्सर्गी प्रस्फुरण गणित्र के लिए क्रिस्टल और चुंबक द्रवगतिकी पावर जनरेटर शामिल हैं।[12] सीज़ियम का उपयोग द्वितीयक आयन मास स्पेक्ट्रोमेट्री (SIMS) में धनात्मक आयनों के स्रोत के रूप में भी किया जाता है।
1967 के बाद से, मापन की अंतर्राष्ट्रीय प्रणाली ने समय की प्राथमिक इकाई, दूसरी, सीज़ियम के गुणों पर आधारित है। अंतर्राष्ट्रीय इकाई पद्धति (SI) दूसरे को 9,192,631,770 चक्रों की अवधि के रूप में परिभाषित करता है, जो कि सीज़ियम-133 की जमीनी अवस्था के दो अति सूक्ष्म ऊर्जा स्तरों के बीच संक्रमण के अनुरूप वर्णक्रमीय रेखा की माइक्रोवेव आवृत्ति पर होता है।[74] 1967 के वज़न और माप पर 13वें साधारण सम्मेलन ने एक सेकंड को इस प्रकार परिभाषित किया: "9,192,631,770 चक्रों की माइक्रोवेव प्रकाश की अवधि, सीज़ियम-133 परमाणुओं के अति सूक्ष्म संक्रमण द्वारा उनकी जमीनी अवस्था में बाहरी क्षेत्रों द्वारा अबाधित अवशोषित या उत्सर्जित होती है।"
आवेदन
पेट्रोलियम की खोज
गैर-रेडियोधर्मी सीज़ियम का वर्तमान में सबसे बड़ा उपयोग निकालने वाले तेल उद्योग के लिए सीज़ियम प्रारूप प्रवेधन तरल पदार्थ में है।[12] सीज़ियम फ़ॉर्मेट (HCOO−Cs+) के जलीय मिश्रण - जो कि फॉर्मिक अम्ल के साथ सीज़ियम हाइड्रॉक्साइड की अभिक्रिया से बने होते हैं - 1990 के दशक के मध्य में तेल के कुएं की प्रवेधन और पूरा करने वाले तरल पदार्थ के रूप में उपयोग के लिए विकसित किए गए थे। प्रवेधन तरल पदार्थ का कार्य ड्रिल बिट्स को चिकनाई देना, रॉक कटिंग को सतह पर लाना और कुएं की प्रवेधन के दौरान गठन पर दाब बनाए रखना है। समापन तरल प्रवेधन के बाद लेकिन उत्पादन से पहले दाब को बनाए रखते हुए नियंत्रण हार्डवेयर को स्थापित करने में सहायता करते हैं।[12]
सीज़ियम का उच्च घनत्व लवण जल (2.3 g/cm3 या 19.2 पाउंड प्रति गैलन तक) बनाता है,[75] अधिकांश सीज़ियम यौगिकों की अपेक्षाकृत सौम्य प्रकृति के साथ मिलकर, प्रवेधन तरल पदार्थ में हानिकारक उच्च घनत्व वाले निलंबित ठोस पदार्थों की आवश्यकता को कम करता है-एक महत्वपूर्ण तकनीकी, अभियांत्रिकी और पर्यावरणीय लाभ। कई अन्य भारी तरल पदार्थों के घटकों के विपरीत, सीज़ियम प्रारूप अपेक्षाकृत पर्यावरण के अनुकूल होता है।[75] जल के घनत्व को कम करने के लिए सीज़ियम प्रारूप लवण जल को पोटेशियम और सोडियम प्रारूप के साथ मिश्रित किया जा सकता है (1.0 g/cm3, या प्रति गैलन 8.3 पाउंड)। इसके अलावा, यह जैवनिम्नीकरणीय है और इसका पुनर्चक्रण किया जा सकता है, जो इसकी उच्च लागत (2001 में लगभग 4,000 डॉलर प्रति बैरल) को देखते हुए महत्वपूर्ण है।[76] क्षार प्रारूपों को संभालना सुरक्षित है और उत्पादक गठन या डाउनहोल धातुओं को संक्षारक विकल्प के रूप में नुकसान नहीं पहुंचाता है, उच्च घनत्व वाली लवण जल (जैसे जस्ता ब्रोमाइड ZnBr
2 समाधान) कभी-कभी करते हैं, उन्हें कम सफाई की भी आवश्यकता होती है और निष्कासन लागत भी कम होती है।[12]
परमाणु घड़ियां
सीज़ियम-आधारित परमाणु घड़ियाँ एक निर्देश बिंदु के रूप में सीज़ियम-133 परमाणुओं की अति सूक्ष्म संरचना में विद्युतचुंबकीय संक्रमण का उपयोग करती हैं। पहली परिशुद्ध सीज़ियम घड़ी का निर्माण लुइस एसेन ने 1955 में यूके में नराष्ट्रीय भौतिक प्रयोगशाला में किया था।[77] पिछली आधी सदी में सीज़ियम घड़ियों में सुधार हुआ है और इसे "एक इकाई का सबसे सटीक अहसास माना जाता है जिसे मानव जाति ने अभी तक हासिल किया है।"[74] ये घड़ियाँ 1014 में 2 से 3 भागों की त्रुटि के साथ आवृत्ति को मापती हैं, जो प्रति दिन 2 नैनोसेकंड, या 1.4 मिलियन वर्षों में एक सेकंड की सटीकता के अनुरूप है। नवीनतम संस्करण 1015 में 1 भाग की तुलना में अधिक सटीक हैं, 20 मिलियन वर्षों में लगभग 1 सेकंड।[12] सीज़ियम मानक मानक-अनुपालक समय और आवृत्ति माप के लिए प्राथमिक मानक है।[78] सीज़ियम घड़ियाँ सेल फोन नेटवर्क और इंटरनेट के समय को नियंत्रित करती हैं।[79]
दूसरे की परिभाषा
दूसरा, प्रतीक s, समय का SI मात्रक है। इसे सीज़ियम आवृत्ति ΔνCs का निश्चित संख्यात्मक मान, सीज़ियम-133 परमाणु की अप्रभावित ग्राउंड-स्टेट अतिसूक्ष्म संक्रमण आवृत्ति, 9192631770 जब इकाई Hz में व्यक्त किया जाता है, जो s−1 के बराबर है, लेकर परिभाषित किया गया है।
बिजली और इलेक्ट्रॉनिक्स
सीज़ियम वाष्प तापायनिक जनित्र कम-शक्ति वाले उपकरण हैं जो उष्मीय ऊर्जा को विद्युत ऊर्जा में परिवर्तित करते हैं। दो-इलेक्ट्रोड निर्वात नलिका परिवर्तक में, सीज़ियम कैथोड के पास अंतरिक्ष आवेश को निष्प्रभावित करता है और विद्युत धारा प्रवाह को बढ़ाता है।[80]
सीज़ियम अपने प्रकाश उत्सर्जक गुणों के लिए भी महत्वपूर्ण है, जो प्रकाश को इलेक्ट्रॉन प्रवाह में परिवर्तित करते हैं। इसका उपयोग प्रकाश विद्युत सेल में किया जाता है क्योंकि सीज़ियम आधारित कैथोड, जैसे कि अंतराधात्विक योगिक K
2CsSb, में इलेक्ट्रॉनों के उत्सर्जन के लिए कम देहली वोल्टेज होता है।[81] सीज़ियम का उपयोग करने वाले प्रकाश इलेक्ट्रॉन उत्सर्जक उपकरण की श्रेणी में प्रकाशिक संप्रतीक अभिज्ञान उपकरण, प्रकाश इलेक्ट्रॉनी संवर्धन नलिका और वीडियो कैमरा नलिका शामिल हैं।[82][83] फिर भी, जर्मेनियम, रूबिडियम, सेलेनियम, सिलिकॉन, टेल्यूरियम, और कई अन्य तत्वों को प्रकाश संवेदनशील सामग्री में सीज़ियम के लिए प्रतिस्थापित किया जा सकता है।[12]
सीज़ियम आयोडाइड (CsI), ब्रोमाइड (CsBr) और सीज़ियम फ्लोराइड (CsF) क्रिस्टल गामा और एक्स-रे विकिरण का पता लगाने के लिए खनिज अन्वेषण और कण भौतिकी अनुसंधान में व्यापक रूप से उपयोग किए जाने वाले किरणोत्सर्गी प्रस्फुरण गणित्र में स्किंटिलेटर्स के लिए कार्यरत हैं। भारी तत्व होने के कारण, सीज़ियम बेहतर डिटेक्शन के साथ अच्छी रोक शक्ति प्रदान करता है। सीज़ियम यौगिक एक तेज़ अभिक्रिया (CsF) प्रदान कर सकते हैं और कम हीड्रोस्कोपिक (CsI) होते हैं।
सीज़ियम वाष्प का उपयोग कई सामान्य मैग्नेटोमीटर में किया जाता है।[84]
तत्व का प्रयोग स्पेक्ट्रोफोटोमेट्री में एक आंतरिक मानक के रूप में किया जाता है।[85] अन्य क्षार धातुओं की तरह, सीज़ियम में ऑक्सीजन के लिए बहुत अधिक आत्मीयता होती है और इसे निर्वात नलिका में "गेट्टर" के रूप में प्रयोग किया जाता है।[86] धातु के अन्य उपयोगों में उच्च-ऊर्जा लेज़र, वाष्प चमक लैंप, और वाष्प दिष्टकारी शामिल हैं।[12]
अपकेंद्रीकरण तरल पदार्थ
सीज़ियम आयन का उच्च घनत्व, घनत्व प्रवणता द्रुतअपकेंद्रण (अल्ट्रासेंट्रीफ्यूजेशन) के लिए आणविक जीव विज्ञान में उपयोगी सीज़ियम क्लोराइड, सीज़ियम सल्फेट और सीज़ियम ट्राइफ़्लोरोसेटेट (Cs(O
2CCF
3)) का मिश्रण बनाता है।[87] इस तकनीक का उपयोग मुख्य रूप से विषाणुज कणों, उपकोशिकीय जीवों और अंशों और जैविक नमूनों से न्यूक्लिक अम्ल को अलग करने में किया जाता है।[88]
रासायनिक और चिकित्सा उपयोग
अपेक्षाकृत कम रासायनिक अनुप्रयोगों में सीज़ियम का उपयोग किया जाता है।[89] सीज़ियम यौगिकों के साथ डोपिंग रासायनिक संश्लेषण के लिए कई धातु-आयन उत्प्रेरकों की प्रभावशीलता को बढ़ाता है, जैसे एक्रिलिक अम्ल, एन्थ्राक्विनोन, एथिलीन ऑक्साइड, मेथनॉल, फ़ेथलिक एनहाइड्राइड, स्टाइरीन, मिथाइल मेथैक्रिलेट एकलक और विभिन्न ओलेफ़िन। इसका उपयोग सल्फ्यूरिक अम्ल के उत्पादन में सल्फर डाइऑक्साइड के सल्फर ट्रायऑक्साइड में उत्प्रेरक रूपांतरण में भी किया जाता है।[12]
सीज़ियम फ्लोराइड कार्बनिक रसायन विज्ञान में एक आधार के रूप में[23] और फ्लोराइड आयन के निर्जल स्रोत के रूप में एक विशिष्ट उपयोग का आनंद लेता है।[90] सीज़ियम लवण कभी-कभी कार्बनिक संश्लेषण में पोटेशियम या सोडियम लवण की जगह लेते हैं, जैसे चक्रीकरण, एस्टरीफिकेशन और बहुलकीकरण। सीज़ियम का उपयोग तापसंदीप्त (थर्मोल्यूमिनसेंट) विकिरण विकिरणमापी (TLD) में भी किया गया है: जब विकिरण के संपर्क में आता है, तो यह क्रिस्टल दोष प्राप्त करता है, जो गर्म होने पर प्राप्त खुराक के अनुपात में प्रकाश के उत्सर्जन के साथ वापस आ जाता है। इस प्रकार, एक प्रकाश इलेक्ट्रॉनी संवर्धन नलिका के साथ प्रकाश स्पंद को मापने से संचित विकिरण की मात्रा निर्धारित की जाती है।
परमाणु और समस्थानिक अनुप्रयोग
सीज़ियम-137 एक रेडियो-समस्थानिक है जो आमतौर पर औद्योगिक अनुप्रयोगों में गामा-एमिटर के रूप में उपयोग किया जाता है। इसके लाभों में लगभग 30 वर्षों का अर्ध आयु, परमाणु ईंधन चक्र से इसकी उपलब्धता और एक स्थायी अंत उत्पाद के रूप में 137Ba शामिल हैं। जल में उच्च घुलनशीलता एक हानि है जो इसे भोजन और चिकित्सा आपूर्ति के लिए बड़े पूल विकिरणकों के साथ असंगत बनाता है।[91] इसका उपयोग कृषि, कैंसर के उपचार, और भोजन के रोगाणुनाशन, सीवेज कीचड़, और शल्य चिकित्सा उपकरणों में किया गया है।[12][92] विकिरण उपकरणों में सीज़ियम के रेडियोधर्मी समस्थानिकों का उपयोग चिकित्सा क्षेत्र में कुछ प्रकार के कैंसर के इलाज के लिए किया जाता था,[93] लेकिन बेहतर विकल्पों का उद्भव और स्रोतों में जल में घुलनशील सीज़ियम क्लोराइड का उपयोग, जो धीरे-धीरे व्यापक संदूषण पैदा कर सकता था। इन सीज़ियम स्रोतों में से कुछ को उपयोग से बाहर कर दें।[94][95] सीज़ियम-137 को नमी, घनत्व, समतलीकरण और मोटाई गेज सहित विभिन्न औद्योगिक मापन गेजों में नियोजित किया गया है।[96] इसका उपयोग रॉक संरचनाओं के इलेक्ट्रॉन घनत्व को मापने के लिए वेल लॉगिंग उपकरणों में भी किया गया है, जो संरचनाओं के थोक घनत्व के अनुरूप है।[97]
सीज़ियम-137 का उपयोग ट्रिटियम वाले हाइड्रोलॉजिकल अध्ययनों में किया गया है। 1950 के दशक से 1980 के दशक के मध्य तक विखंडन बम परीक्षण के एक छोटे उत्पाद के रूप में, सीज़ियम -137 को वातावरण में छोड़ा गया, जहाँ इसे आसानी से मिश्रण में अवशोषित किया गया। उस अवधि के भीतर ज्ञात साल-दर-साल भिन्नता मिट्टी और तलछट परतों के साथ सहसंबंध की अनुमति देती है। सीज़ियम-134, और कुछ हद तक सीज़ियम-135, का उपयोग जल विज्ञान में भी नाभिकीय ऊर्जा उद्योग द्वारा सीज़ियम उत्पादन को मापने के लिए किया गया है। जबकि वे सीज़ियम-133 या सीज़ियम-137 की तुलना में कम प्रचलित हैं, ये बेलवेदर समस्थानिक केवल मानवजनित स्रोतों से उत्पन्न होते हैं।[98]
अन्य उपयोग
सीज़ियम और पारा का उपयोग प्रारंभिक आयन इंजनों में एक प्रणोदक के रूप में किया गया था, जो कि बहुत लंबे अंतराग्रहीय (इंटरप्लेनेट्री) या अतिग्रहीय (एक्स्ट्राप्लानेटरी) मिशन पर अंतरिक्ष यान प्रणोदन के लिए डिज़ाइन किया गया था। एक आवेशित टंगस्टन के संपर्क से ईंधन को आयनित किया गया। लेकिन अंतरिक्ष यान के घटकों पर सीज़ियम द्वारा जंग ने विकास को अक्रिय गैस प्रणोदक की दिशा में धकेल दिया है, जैसे कि ज़िनॉन, जो जमीन पर आधारित परीक्षणों में संभालना आसान है और अंतरिक्ष यान को कम संभावित नुकसान पहुंचाता है।[12] 1998 में प्रक्षेपित प्रायोगिक अंतरिक्ष यान डीप स्पेस 1 में ज़िनॉन का उपयोग किया गया था।[99][100] फिर भी, सीज़ियम जैसे तरल धातु आयनों को गति देने वाले क्षेत्र-उत्सर्जन विद्युत प्रणोदन प्रणोदक बनाए गए हैं।[101]
सीज़ियम नाइट्रेट का उपयोग ऑक्सीकारक और पाइरोतकनीक रंजक के रूप में अवरक्त झिलमिलाती हुई चमक (फ्लेयर्स) में सिलिकॉन को जलाने के लिए किया जाता है,[102] जैसे कि LUU-19 फ्लेयर,[103] क्योंकि यह अपने अधिकांश प्रकाश को निकट अवरक्त वर्णक्रम (स्पेक्ट्रम) में उत्सर्जित करता है।[104] लॉकहीड ए-12 CIA टोही विमान में एग्जॉस्ट प्लम के रडार संकेत धुन को कम करने के लिए सीज़ियम यौगिकों का उपयोग ईंधन योजक के रूप में किया जाता है।[105] सीज़ियम और रूबिडियम को कांच में कार्बोनेट के रूप में जोड़ा गया है क्योंकि वे विद्युत चालकता को कम करते हैं और (तंतु प्रकाशिकी) फाइबर ऑप्टिक्स और रात्रि दृष्टि उपकरणों की स्थिरता और स्थायित्व में सुधार करते हैं। सीज़ियम फ्लोराइड या सीज़ियम एल्यूमीनियम फ्लोराइड का उपयोग मैग्नीशियम युक्त एल्यूमीनियम मिश्र धातुओं को जोड़ने के लिए तैयार फ्लक्स में किया जाता है।[12]
चुंबक द्रवगतिकी (मैग्नेटोहाइड्रोडायनामिक) (MHD) बिजली पैदा करने वाली प्रणालियों पर शोध किया गया, लेकिन व्यापक स्वीकृति हासिल करने में विफल रहे।[106] सीज़ियम धातु को उच्च-तापमान रैंकिन चक्र टर्बोइलेक्ट्रिक जेनरेटर में कार्यशील तरल पदार्थ के रूप में भी माना जाता है।[107]
आर्सेनिक दवाओं के प्रशासन के बाद सीज़ियम लवण को एंटीशॉक अभिकर्मकों के रूप में मूल्यांकन किया गया है। दिल की लय पर उनके प्रभाव के कारण, हालांकि, पोटेशियम या रूबिडियम लवण की तुलना में उनके उपयोग की संभावना कम होती है। उनका उपयोग मिर्गी के इलाज के लिए भी किया जाता रहा है।[12]
सीज़ियम-133 को लेजर शीतलित किया जाता है और क्वांटम यांत्रिकी में मौलिक और तकनीकी समस्याओं की जांच के लिए इस्तेमाल किया जा सकता है। इसमें विशेष रूप से सुविधाजनक फेशबैक वर्णक्रम (स्पेक्ट्रम) है जो ट्यून करने योग्य अंतःक्रियाओं की आवश्यकता वाले अल्ट्राकोल्ड परमाणुओं के अध्ययन को सक्षम बनाता है।[108]
स्वास्थ्य और सुरक्षा के खतरे
| Hazards | |
|---|---|
| GHS labelling:[109] | |
 
| |
| Danger | |
| H260, H314 | |
| P223, P231+P232, P280, P305+P351+P338, P370+P378, P422 | |
| NFPA 704 (fire diamond) | |
गैर-रेडियोधर्मी सीज़ियम यौगिक केवल हल्के से विषाक्त होते हैं, और गैर-रेडियोधर्मी सीज़ियम एक महत्वपूर्ण पर्यावरणीय खतरा नहीं है। क्योंकि जैव रासायनिक प्रक्रियाएं सीज़ियम को पोटेशियम के साथ भ्रमित और प्रतिस्थापित कर सकती हैं, अतिरिक्त सीज़ियम से हाइपोकैलिमिया, वितालता, और तीव्र हृदय गति रुक सकती है, लेकिन ऐसी मात्रा प्राकृतिक स्रोतों में सामान्य रूप से सामने नहीं आएगी।[111][112]
चूहों में सीज़ियम क्लोराइड के लिए औसत घातक खुराक (LD50) 2.3 ग्राम प्रति किलोग्राम है, जो पोटेशियम क्लोराइड और सोडियम क्लोराइड के LD50 मूल्यों के बराबर है।[113] गैर-रेडियोधर्मी सीज़ियम का मुख्य उपयोग पेट्रोलियम प्रवेधन तरल पदार्थों में सीज़ियम प्रारूप के रूप में होता है क्योंकि यह विकल्पों की तुलना में बहुत कम विषैला होता है, हालांकि यह अधिक महंगा होता है।[75]
सीज़ियम धातु सबसे अभिक्रियाशील तत्वों में से एक है और जल की उपस्थिति में अत्यधिक विस्फोटक है। अभिक्रिया से उत्पन्न हाइड्रोजन गैस एक ही समय में निकलने वाली उष्मीय ऊर्जा से गर्म होती है, जिससे प्रज्वलन और एक ीव्रव िस्फोट होता है। यह अन्य क्षार धातुओं के साथ हो सकता है, लेकिन सीज़ियम इतना शक्तिशाली होता है कि यह विस्फोटक अभिक्रिया ठंडे जल से भी शुरू हो सकती है।[12]
यह अत्यधिक स्वत: ज्वलनशील (पायरोफोरिक) है: सीज़ियम का स्वतः प्रज्वलन तापमान −116 °C (−177 °F) होता है, और यह सीज़ियम हाइड्रॉक्साइड और विभिन्न ऑक्साइड बनाने के लिए हवा में विस्फोटक रूप से प्रज्वलित करता है। सीज़ियम हाइड्रॉक्साइड एक बहुत प्रबल क्षार है, और यह कांच को तेजी से खराब कर देता है।[16]
जीवमंडल में समस्थानिक 134 और 137 मानव गतिविधियों से थोड़ी मात्रा में मौजूद हैं, जो स्थान के अनुसार भिन्न हैं। रेडियोकैसियम शरीर में अन्य विखंडन उत्पादों (जैसे रेडियोआयोडीन और रेडियोस्ट्रोंटियम) की तरह आसानी से एकत्रित नहीं होता है। अवशोषित रेडियोकेशियम का लगभग 10% पसीने और मूत्र में अपेक्षाकृत जल्दी शरीर से निकल जाता है। शेष 90% में 50 और 150 दिनों के बीच जैविक अर्ध आयु होता है।[114] रेडियोकैशियम पोटेशियम का अनुसरण करता है और फलों और सब्जियों सहित पौधों के ऊतकों में एकत्रित होने लगता है।[115][116][117] सीज़ियम के अवशोषण में पौधे व्यापक रूप से भिन्न होते हैं, कभी-कभी इसके प्रति बहुत प्रतिरोध प्रदर्शित करते हैं। यह भी अच्छी तरह से प्रलेखित है कि दूषित जंगलों से मशरूम कवक बीजाणु फलिका (स्पोरोकार्प्स) में रेडियोकैसियम (सीज़ियम-137) एकत्रित करते हैं।[118] चेरनोबिल आपदा के बाद झीलों में सीज़ियम-137 का एकत्रित होना एक बड़ी चिंता का विषय रहा है।[119][120] कुत्तों के साथ किए गए प्रयोगों से पता चला है कि 3.8 मिलीक्यूरीज़ (140 MBq, 4.1 μg सीज़ियम-137) की एक खुराक (डोज़) तीन सप्ताह के भीतर घातक है,[121] कम मात्रा में ऊसरता और कैंसर हो सकता है।[122] अंतर्राष्ट्रीय परमाणु ऊर्जा संस्था और अन्य स्रोतों ने चेतावनी दी है कि रेडियोधर्मी सामग्री, जैसे कि सीज़ियम-137, का उपयोग रेडियोलॉजिकल फैलाव उपकरणों, या "डर्टी बम" में किया जा सकता है।[123]
यह भी देखें
- गोइआनिया दुर्घटना, 1987 में एक प्रमुख रेडियोधर्मी संदूषण घटना जिसमें सीज़ियम-137 शामिल था।
- क्रामाटोर्स्क रेडियोलॉजिकल दुर्घटना, 1980 और 1989 के बीच एक और 137Cs घटना।
- 1998 में एसरिनॉक्स दुर्घटना, सीज़ियम-137 संदूषण दुर्घटना।
टिप्पणियाँ
- ↑ Caesium is the spelling recommended by the International Union of Pure and Applied Chemistry (IUPAC).[7] The American Chemical Society (ACS) has used the spelling cesium since 1921,[8][9] following Webster's New International Dictionary. The element was named after the Latin word caesius, meaning "bluish grey".[10] In medieval and early modern writings caesius was spelled with the ligature æ as cæsius; hence, an alternative but now old-fashioned orthography is cæsium. More spelling explanation at ae/oe vs e.
- ↑ Along with rubidium (39 °C [102 °F]), francium (estimated at 27 °C [81 °F]), mercury (−39 °C [−38 °F]), and gallium (30 °C [86 °F]); bromine is also liquid at room temperature (melting at −7.2 °C [19.0 °F]), but it is a halogen and not a metal. Preliminary work with copernicium and flerovium suggests that they are gaseous metals at room temperature.
- ↑ It differs from this value in caesides, which contain the Cs− anion and thus have caesium in the −1 oxidation state.[3] Additionally, 2013 calculations by Mao-sheng Miao indicate that under conditions of extreme pressure (greater than 30 GPa), the inner 5p electrons could form chemical bonds, where caesium would behave as the seventh 5p element. This discovery indicates that higher caesium fluorides with caesium in oxidation states from +2 to +6 could exist under such conditions.[24]
- ↑ Francium's electropositivity has not been experimentally measured due to its high radioactivity. Measurements of the first ionization energy of francium suggest that its relativistic effects may lower its reactivity and raise its electronegativity above that expected from periodic trends.[26]
- ↑ Bunsen quotes Aulus Gellius Noctes Atticae II, 26 by Nigidius Figulus: Nostris autem veteribus caesia dicts est quae Graecis, ut Nigidus ait, de colore coeli quasi coelia.
संदर्भ
- ↑ "Standard Atomic Weights: Caesium". CIAAW. 2013.
- ↑ Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). Boca Raton, FL: CRC Press. p. 4.121. ISBN 1-4398-5511-0.
- ↑ 3.0 3.1 3.2 Dye, J. L. (1979). "Compounds of Alkali Metal Anions". Angewandte Chemie International Edition. 18 (8): 587–598. doi:10.1002/anie.197905871.
- ↑ "Magnetic susceptibility of the elements and inorganic compounds". Handbook of Chemistry and Physics (PDF) (87th ed.). CRC press. ISBN 0-8493-0487-3. Retrieved 2010-09-26.
- ↑ "NIST Radionuclide Half-Life Measurements". NIST. Retrieved 2011-03-13.
- ↑ "IUPAC Periodic Table of Elements". International Union of Pure and Applied Chemistry.
- ↑ International Union of Pure and Applied Chemistry (2005). Nomenclature of Inorganic Chemistry (IUPAC Recommendations 2005). Cambridge (UK): RSC–IUPAC. ISBN 0-85404-438-8. pp. 248–49. Electronic version..
- ↑ Coghill, Anne M.; Garson, Lorrin R., eds. (2006). The ACS Style Guide: Effective Communication of Scientific Information (3rd ed.). Washington, D.C.: American Chemical Society. p. 127. ISBN 978-0-8412-3999-9.
- ↑ Coplen, T. B.; Peiser, H. S. (1998). "History of the recommended atomic-weight values from 1882 to 1997: a comparison of differences from current values to the estimated uncertainties of earlier values" (PDF). Pure Appl. Chem. 70 (1): 237–257. doi:10.1351/pac199870010237. S2CID 96729044.
- ↑ OED entry for "caesium". Second edition, 1989; online version June 2012. Retrieved 07 September 2012. Earlier version first published in New English Dictionary, 1888.
- ↑ "Isotopes". Ptable.
- ↑ 12.00 12.01 12.02 12.03 12.04 12.05 12.06 12.07 12.08 12.09 12.10 12.11 12.12 12.13 12.14 12.15 12.16 12.17 12.18 12.19 12.20 12.21 12.22 12.23 12.24 12.25 12.26 Butterman, William C.; Brooks, William E.; Reese Jr., Robert G. (2004). "Mineral Commodity Profile: Cesium" (PDF). United States Geological Survey. Archived from the original (PDF) on February 7, 2007. Retrieved 2009-12-27.
- ↑ Heiserman, David L. (1992). Exploring Chemical Elements and their Compounds. McGraw-Hill. pp. 201–203. ISBN 978-0-8306-3015-8.
- ↑ Addison, C. C. (1984). The Chemistry of the Liquid Alkali Metals. Wiley. ISBN 978-0-471-90508-0. Retrieved 2012-09-28.
- ↑ 15.0 15.1 15.2 15.3 15.4 Kaner, Richard (2003). "C&EN: It's Elemental: The Periodic Table – Cesium". American Chemical Society. Retrieved 2010-02-25.
- ↑ 16.0 16.1 "Chemical Data – Caesium – Cs". Royal Society of Chemistry. Retrieved 2010-09-27.
- ↑ 17.0 17.1 Lynch, Charles T. (1974). CRC Handbook of Materials Science. CRC Press. p. 13. ISBN 978-0-8493-2321-8.
- ↑ 18.0 18.1 Clark, Jim (2005). "Flame Tests". chemguide. Retrieved 2012-01-29.
- ↑ Taova, T. M.; et al. (June 22, 2003). "Density of melts of alkali metals and their Na-K-Cs and Na-K-Rb ternary systems" (PDF). Fifteenth symposium on thermophysical properties, Boulder, Colorado, United States. Archived from the original (PDF) on October 9, 2006. Retrieved 2010-09-26.
- ↑ Deiseroth, H. J. (1997). "Alkali metal amalgams, a group of unusual alloys". Progress in Solid State Chemistry. 25 (1–2): 73–123. doi:10.1016/S0079-6786(97)81004-7.
- ↑ Addison, C. C. (1984). The chemistry of the liquid alkali metals. Wiley. p. 7. ISBN 9780471905080.
- ↑ Gray, Theodore (2012) The Elements, Black Dog & Leventhal Publishers, p. 131, ISBN 1-57912-895-5.
- ↑ 23.0 23.1 23.2 23.3 23.4 Greenwood, N. N.; Earnshaw, A. (1984). Chemistry of the Elements. Oxford, UK: Pergamon Press. ISBN 978-0-08-022057-4.
- ↑ Moskowitz, Clara. "A Basic Rule of Chemistry Can Be Broken, Calculations Show". Scientific American. Retrieved 2013-11-22.
- ↑ 25.0 25.1 25.2 Holleman, Arnold F.; Wiberg, Egon; Wiberg, Nils (1985). "Vergleichende Übersicht über die Gruppe der Alkalimetalle". Lehrbuch der Anorganischen Chemie (in Deutsch) (91–100 ed.). Walter de Gruyter. pp. 953–955. ISBN 978-3-11-007511-3.
- ↑ Andreev, S. V.; Letokhov, V. S.; Mishin, V. I. (1987). "Laser resonance photoionization spectroscopy of Rydberg levels in Fr". Physical Review Letters. 59 (12): 1274–76. Bibcode:1987PhRvL..59.1274A. doi:10.1103/PhysRevLett.59.1274. PMID 10035190.
- ↑ Miao, Mao-sheng (2013). "Caesium in high oxidation states and as a p-block element". Nature Chemistry (in English). 5 (10): 846–852. arXiv:1212.6290. Bibcode:2013NatCh...5..846M. doi:10.1038/nchem.1754. ISSN 1755-4349. PMID 24056341. S2CID 38839337.
- ↑ Sneed, D.; Pravica, M.; Kim, E.; Chen, N.; Park, C.; White, M. (2017-10-01). "Forcing Cesium into Higher Oxidation States Using Useful hard x-ray Induced Chemistry under High Pressure". Journal of Physics: Conference Series (in English). 950 (11, 2017): 042055. Bibcode:2017JPhCS.950d2055S. doi:10.1088/1742-6596/950/4/042055. ISSN 1742-6588. OSTI 1409108. S2CID 102912809.
- ↑ Hogan, C. M. (2011)."Phosphate". Archived from the original on 2012-10-25. Retrieved 2012-06-17. in Encyclopedia of Earth. Jorgensen, A. and Cleveland, C.J. (eds.). National Council for Science and the Environment. Washington DC
- ↑ Köhler, Michael J. (1999). Etching in microsystem technology. Wiley-VCH. p. 90. ISBN 978-3-527-29561-6.
- ↑ Jansen, Martin (2005-11-30). "Effects of relativistic motion of electrons on the chemistry of gold and platinum". Solid State Sciences. 7 (12): 1464–1474. Bibcode:2005SSSci...7.1464J. doi:10.1016/j.solidstatesciences.2005.06.015.
- ↑ Moyer, Bruce A.; Birdwell, Joseph F.; Bonnesen, Peter V.; Delmau, Laetitia H. (2005). Use of Macrocycles in Nuclear-Waste Cleanup: A Realworld Application of a Calixcrown in Cesium Separation Technology. pp. 383–405. doi:10.1007/1-4020-3687-6_24. ISBN 978-1-4020-3364-3.
{{cite book}}:|journal=ignored (help). - ↑ Evans, F. W.; Litt, M. H.; Weidler-Kubanek, A. M.; Avonda, F. P. (1968). "Reactions Catalyzed by Potassium Fluoride. 111. The Knoevenagel Reaction". Journal of Organic Chemistry. 33 (5): 1837–1839. doi:10.1021/jo01269a028.
- ↑ Senga, Ryosuke; Suenaga, Kazu (2015). "Single-atom electron energy loss spectroscopy of light elements". Nature Communications. 6: 7943. Bibcode:2015NatCo...6.7943S. doi:10.1038/ncomms8943. PMC 4532884. PMID 26228378.
- ↑ Wells, A. F. (1984). Structural Inorganic Chemistry (5th ed.). Oxford Science Publications. ISBN 978-0-19-855370-0.
- ↑ Cotton, F. Albert; Wilkinson, G. (1962). Advanced Inorganic Chemistry. John Wiley & Sons, Inc. p. 318. ISBN 978-0-471-84997-1.
- ↑ Lide, David R., ed. (2006). CRC Handbook of Chemistry and Physics (87th ed.). Boca Raton, FL: CRC Press. pp. 451, 514. ISBN 0-8493-0487-3.
- ↑ 38.0 38.1 Tsai, Khi-Ruey; Harris, P. M.; Lassettre, E. N. (1956). "The Crystal Structure of Cesium Monoxide". Journal of Physical Chemistry. 60 (3): 338–344. doi:10.1021/j150537a022. Archived from the original on September 24, 2017.
- ↑ Vol'nov, I. I.; Matveev, V. V. (1963). "Synthesis of cesium ozonide through cesium superoxide". Bulletin of the Academy of Sciences, USSR Division of Chemical Science. 12 (6): 1040–1043. doi:10.1007/BF00845494.
- ↑ Tokareva, S. A. (1971). "Alkali and Alkaline Earth Metal Ozonides". Russian Chemical Reviews. 40 (2): 165–174. Bibcode:1971RuCRv..40..165T. doi:10.1070/RC1971v040n02ABEH001903. S2CID 250883291.
- ↑ Simon, A. (1997). "Group 1 and 2 Suboxides and Subnitrides — Metals with Atomic Size Holes and Tunnels". Coordination Chemistry Reviews. 163: 253–270. doi:10.1016/S0010-8545(97)00013-1.
- ↑ Tsai, Khi-Ruey; Harris, P. M.; Lassettre, E. N. (1956). "The Crystal Structure of Tricesium Monoxide". Journal of Physical Chemistry. 60 (3): 345–347. doi:10.1021/j150537a023.
- ↑ Okamoto, H. (2009). "Cs-O (Cesium-Oxygen)". Journal of Phase Equilibria and Diffusion. 31: 86–87. doi:10.1007/s11669-009-9636-5. S2CID 96084147.
- ↑ Band, A.; Albu-Yaron, A.; Livneh, T.; Cohen, H.; Feldman, Y.; Shimon, L.; Popovitz-Biro, R.; Lyahovitskaya, V.; Tenne, R. (2004). "Characterization of Oxides of Cesium". The Journal of Physical Chemistry B. 108 (33): 12360–12367. doi:10.1021/jp036432o.
- ↑ Brauer, G. (1947). "Untersuchungen ber das System Csium-Sauerstoff". Zeitschrift für Anorganische Chemie. 255 (1–3): 101–124. doi:10.1002/zaac.19472550110.
- ↑ Busso, M.; Gallino, R.; Wasserburg, G. J. (1999). "Nucleosynthesis in Asymptotic Giant Branch Stars: Relevance for Galactic Enrichment and Solar System Formation" (PDF). Annual Review of Astronomy and Astrophysics. 37: 239–309. Bibcode:1999ARA&A..37..239B. doi:10.1146/annurev.astro.37.1.239. Retrieved 2010-02-20.
- ↑ Arnett, David (1996). Supernovae and Nucleosynthesis: An Investigation of the History of Matter, from the Big Bang to the Present. Princeton University Press. p. 527. ISBN 978-0-691-01147-9.
- ↑ Goff, C.; Matchette, Michael A.; Shabestary, Nahid; Khazaeli, Sadegh (1996). "Complexation of caesium and rubidium cations with crown ethers in N,N-dimethylformamide". Polyhedron. 15 (21): 3897–3903. doi:10.1016/0277-5387(96)00018-6.
- ↑ Brown, F.; Hall, G. R.; Walter, A. J. (1955). "The half-life of Cs137". Journal of Inorganic and Nuclear Chemistry. 1 (4–5): 241–247. Bibcode:1955PhRv...99..188W. doi:10.1016/0022-1902(55)80027-9.
- ↑ Sonzogni, Alejandro. "Interactive Chart of Nuclides". National Nuclear Data Center: Brookhaven National Laboratory. Archived from the original on 2008-05-22. Retrieved 2008-06-06.
- ↑ Ohki, Shigeo; Takaki, Naoyuki (14–16 October 2002). Transmutation of Cesium-135 with Fast Reactors (PDF). Seventh Information Exchange Meeting on Actinide and Fission Product Partitioning and Transmutation. Jeju, Korea. Archived from the original (PDF) on 2011-09-28. Retrieved 2010-09-26.
- ↑ "20 Xenon: A Fission Product Poison" (PDF). CANDU Fundamentals (Report). CANDU Owners Group Inc. Archived from the original (PDF) on July 23, 2011. Retrieved 2010-09-15.
- ↑ Taylor, V. F.; Evans, R. D.; Cornett, R. J. (2008). "Preliminary evaluation of 135Cs/137Cs as a forensic tool for identifying source of radioactive contamination". Journal of Environmental Radioactivity. 99 (1): 109–118. doi:10.1016/j.jenvrad.2007.07.006. PMID 17869392.
- ↑ "Cesium | Radiation Protection". U.S. Environmental Protection Agency. 2006-06-28. Archived from the original on March 15, 2011. Retrieved 2010-02-15.
- ↑ Zerriffi, Hisham (2000-05-24). IEER Report: Transmutation – Nuclear Alchemy Gamble (Report). Institute for Energy and Environmental Research. Retrieved 2010-02-15.
- ↑ Chernobyl's Legacy: Health, Environmental and Socia-Economic Impacts and Recommendations to the Governments of Belarus, Russian Federation and Ukraine (PDF) (Report). International Atomic Energy Agency. Archived from the original (PDF) on 2010-02-15. Retrieved 2010-02-18.
- ↑ Kase, Takeshi; Konashi, Kenji; Takahashi, Hiroshi; Hirao, Yasuo (1993). "Transmutation of Cesium-137 Using Proton Accelerator". Journal of Nuclear Science and Technology. 30 (9): 911–918. doi:10.3327/jnst.30.911.
- ↑ Knief, Ronald Allen (1992). "Fission Fragments". Nuclear engineering: theory and technology of commercial nuclear power. Taylor & Francis. p. 42. ISBN 978-1-56032-088-3.
- ↑ Ishiwatari, N.; Nagai, H. "Release of xenon-137 and iodine-137 from UO2 pellet by pulse neutron irradiation at NSRR". Nippon Genshiryoku Gakkaishi. 23 (11): 843–850. OSTI 5714707.
- ↑ Turekian, K. K.; Wedepohl, K. H. (1961). "Distribution of the elements in some major units of the Earth's crust". Geological Society of America Bulletin. 72 (2): 175–192. Bibcode:1961GSAB...72..175T. doi:10.1130/0016-7606(1961)72[175:DOTEIS]2.0.CO;2. ISSN 0016-7606.
- ↑ Rowland, Simon (1998-07-04). "Cesium as a Raw Material: Occurrence and Uses". Artemis Society International. Retrieved 2010-02-15.
- ↑ 62.0 62.1 Černý, Petr; Simpson, F. M. (1978). "The Tanco Pegmatite at Bernic Lake, Manitoba: X. Pollucite" (PDF). Canadian Mineralogist. 16: 325–333. Retrieved 2010-09-26.
- ↑ 63.0 63.1 63.2 63.3 Polyak, Désirée E. "Cesium" (PDF). U.S. Geological Survey. Retrieved 2009-10-17.
- ↑ Norton, J. J. (1973). "Lithium, cesium, and rubidium—The rare alkali metals". In Brobst, D. A.; Pratt, W. P. (eds.). United States mineral resources. Vol. Paper 820. U.S. Geological Survey Professional. pp. 365–378. Archived from the original on 2010-07-21. Retrieved 2010-09-26.
- ↑ 65.0 65.1 Burt, R. O. (1993). "Caesium and cesium compounds". Kirk-Othmer encyclopedia of chemical technology. Vol. 5 (4th ed.). New York: John Wiley & Sons, Inc. pp. 749–764. ISBN 978-0-471-48494-3.
- ↑ Benton, William; Turner, Jim (2000). "Cesium formate fluid succeeds in North Sea HPHT field trials" (PDF). Drilling Contractor (May/June): 38–41. Retrieved 2010-09-26.
- ↑ 67.0 67.1 Eagleson, Mary, ed. (1994). Concise encyclopedia chemistry. Eagleson, Mary. Berlin: de Gruyter. p. 198. ISBN 978-3-11-011451-5.
- ↑ Oxford English Dictionary, 2nd Edition
- ↑ 69.0 69.1 69.2 69.3 Kirchhoff, G.; Bunsen, R. (1861). "Chemische Analyse durch Spectralbeobachtungen" (PDF). Annalen der Physik und Chemie. 189 (7): 337–381. Bibcode:1861AnP...189..337K. doi:10.1002/andp.18611890702. hdl:2027/hvd.32044080591324.
- ↑ 70.0 70.1 Weeks, Mary Elvira (1932). "The discovery of the elements. XIII. Some spectroscopic discoveries". Journal of Chemical Education. 9 (8): 1413–1434. Bibcode:1932JChEd...9.1413W. doi:10.1021/ed009p1413.
- ↑ Zsigmondy, Richard (2007). Colloids and the Ultra Microscope. Read books. p. 69. ISBN 978-1-4067-5938-9.
- ↑ Setterberg, Carl (1882). "Ueber die Darstellung von Rubidium- und Cäsiumverbindungen und über die Gewinnung der Metalle selbst". Justus Liebig's Annalen der Chemie. 211: 100–116. doi:10.1002/jlac.18822110105.
- ↑ Strod, A. J. (1957). "Cesium—A new industrial metal". American Ceramic Bulletin. 36 (6): 212–213.
- ↑ 74.0 74.1 "Cesium Atoms at Work". Time Service Department—U.S. Naval Observatory—Department of the Navy. Archived from the original on February 23, 2015. Retrieved 2009-12-20.
- ↑ 75.0 75.1 75.2 Downs, J. D.; Blaszczynski, M.; Turner, J.; Harris, M. (February 2006). Drilling and Completing Difficult HP/HT Wells With the Aid of Cesium Formate Brines-A Performance Review. IADC/SPE Drilling Conference. Miami, Florida, USASociety of Petroleum Engineers. doi:10.2118/99068-MS. Archived from the original on 2007-10-12.
- ↑ Flatern, Rick (2001). "Keeping cool in the HPHT environment". Offshore Engineer (February): 33–37.
- ↑ Essen, L.; Parry, J. V. L. (1955). "An Atomic Standard of Frequency and Time Interval: A Caesium Resonator". Nature. 176 (4476): 280–282. Bibcode:1955Natur.176..280E. doi:10.1038/176280a0. S2CID 4191481.
- ↑ Markowitz, W.; Hall, R.; Essen, L.; Parry, J. (1958). "Frequency of Cesium in Terms of Ephemeris Time". Physical Review Letters. 1 (3): 105–107. Bibcode:1958PhRvL...1..105M. doi:10.1103/PhysRevLett.1.105.
- ↑ Reel, Monte (2003-07-22). "Where timing truly is everything". The Washington Post. p. B1. Archived from the original on 2013-04-29. Retrieved 2010-01-26.
- ↑ Rasor, Ned S.; Warner, Charles (September 1964). "Correlation of Emission Processes for Adsorbed Alkali Films on Metal Surfaces". Journal of Applied Physics. 35 (9): 2589–2600. Bibcode:1964JAP....35.2589R. doi:10.1063/1.1713806.
- ↑ "Cesium Supplier & Technical Information". American Elements. Retrieved 2010-01-25.
- ↑ Smedley, John; Rao, Triveni; Wang, Erdong (2009). "K2CsSb Cathode Development". AIP Conference Proceedings. 1149 (1): 1062–1066. Bibcode:2009AIPC.1149.1062S. doi:10.1063/1.3215593.
- ↑ Görlich, P. (1936). "Über zusammengesetzte, durchsichtige Photokathoden". Zeitschrift für Physik. 101 (5–6): 335–342. Bibcode:1936ZPhy..101..335G. doi:10.1007/BF01342330. S2CID 121613539.
- ↑ Groeger, S.; Pazgalev, A. S.; Weis, A. (2005). "Comparison of discharge lamp and laser pumped cesium magnetometers". Applied Physics B. 80 (6): 645–654. arXiv:physics/0412011. Bibcode:2005ApPhB..80..645G. doi:10.1007/s00340-005-1773-x. S2CID 36065775.
- ↑ Haven, Mary C.; Tetrault, Gregory A.; Schenken, Jerald R. (1994). "Internal Standards". Laboratory instrumentation. New York: John Wiley and Sons. p. 108. ISBN 978-0-471-28572-4.
- ↑ McGee, James D. (1969). Photo-electronic image devices: proceedings of the fourth symposium held at Imperial College, London, September 16–20, 1968. Vol. 1. Academic Press. p. 391. ISBN 978-0-12-014528-7.
- ↑ Manfred Bick, Horst Prinz, "Cesium and Cesium Compounds" in Ullmann's Encyclopedia of Industrial Chemistry 2005, Wiley-VCH, Weinheim. doi:10.1002/14356007.a06_153.
- ↑ Desai, Mohamed A., ed. (2000). "Gradient Materials". Downstream processing methods. Totowa, N.J.: Humana Press. pp. 61–62. ISBN 978-0-89603-564-5.
- ↑ Burt, R. O. (1993). "Cesium and cesium compounds". Kirk-Othmer encyclopedia of chemical technology. Vol. 5 (4th ed.). New York: John Wiley & Sons. p. 759. ISBN 978-0-471-15158-6.
- ↑ Friestad, Gregory K.; Branchaud, Bruce P.; Navarrini, Walter and Sansotera, Maurizio (2007) "Cesium Fluoride" in Encyclopedia of Reagents for Organic Synthesis, John Wiley & Sons. doi:10.1002/047084289X.rc050.pub2
- ↑ Okumura, Takeshi (2003-10-21). "The material flow of radioactive cesium-137 in the U.S. 2000" (PDF). United States Environmental Protection Agency. Archived from the original (PDF) on July 20, 2011. Retrieved 2009-12-20.
- ↑ Jensen, N. L. (1985). "Cesium". Mineral facts and problems. Vol. Bulletin 675. U.S. Bureau of Mines. pp. 133–138.
- ↑ "IsoRay's Cesium-131 Medical Isotope Used In Milestone Procedure Treating Eye Cancers At Tufts-New England Medical Center". Medical News Today. 2007-12-17. Retrieved 2010-02-15.
- ↑ Bentel, Gunilla Carleson (1996). "Caesium-137 Machines". Radiation therapy planning. McGraw-Hill Professional. pp. 22–23. ISBN 978-0-07-005115-7. Retrieved 2010-09-26.
- ↑ National Research Council (U.S.). Committee on Radiation Source Use and Replacement (2008). Radiation source use and replacement: abbreviated version. National Academies Press. ISBN 978-0-309-11014-3.
- ↑ Loxton, R.; Pope, P., eds. (1995). "Level and density measurement using non-contact nuclear gauges". Instrumentation : A Reader. London: Chapman & Hall. pp. 82–85. ISBN 978-0-412-53400-3.
- ↑ Timur, A.; Toksoz, M. N. (1985). "Downhole Geophysical Logging". Annual Review of Earth and Planetary Sciences. 13: 315–344. Bibcode:1985AREPS..13..315T. doi:10.1146/annurev.ea.13.050185.001531.
- ↑ Kendall, Carol. "Isotope Tracers Project – Resources on Isotopes – Cesium". National Research Program – U.S. Geological Survey. Retrieved 2010-01-25.
- ↑ Marcucci, M. G.; Polk, J. E. (2000). "NSTAR Xenon Ion Thruster on Deep Space 1: Ground and flight tests (invited)". Review of Scientific Instruments. 71 (3): 1389–1400. Bibcode:2000RScI...71.1389M. doi:10.1063/1.1150468.
- ↑ Sovey, James S.; Rawlin, Vincent K.; Patterson, Michael J. "A Synopsis of Ion Propulsion Development Projects in the United States: SERT I to Deep Space I" (PDF). NASA. Archived from the original (PDF) on June 29, 2009. Retrieved 2009-12-12.
- ↑ Marrese, C.; Polk, J.; Mueller, J.; Owens, A.; Tajmar, M.; Fink, R. & Spindt, C. (October 2001). In-FEEP Thruster Ion Beam Neutralization with Thermionic and Field Emission Cathodes. 27th International Electric Propulsion Conference. Pasadena, California. pp. 1–15. Archived from the original (PDF) on 2010-05-27. Retrieved 2010-01-25.
- ↑ "Infrared illumination compositions and articles containing the same". United States Patent 6230628. Freepatentsonline.com. Retrieved 2010-01-25.
- ↑ "LUU-19 Flare". Federation of American Scientists. 2000-04-23. Archived from the original on 2010-08-06. Retrieved 2009-12-12.
- ↑ Charrier, E.; Charsley, E. L.; Laye, P. G.; Markham, H. M.; Berger, B.; Griffiths, T. T. (2006). "Determination of the temperature and enthalpy of the solid–solid phase transition of caesium nitrate by differential scanning calorimetry". Thermochimica Acta. 445: 36–39. doi:10.1016/j.tca.2006.04.002.
- ↑ Crickmore, Paul F. (2000). Lockheed SR-71: the secret missions exposed. Osprey. p. 47. ISBN 978-1-84176-098-8.
- ↑ National Research Council (U.S.) (2001). Energy research at DOE—Was it worth it?. National Academy Press. pp. 190–194. doi:10.17226/10165. ISBN 978-0-309-07448-3. Retrieved 2010-09-26.
- ↑ Roskill Information Services (1984). Economics of Caesium and Rubidium (Reports on Metals & Minerals). London, United Kingdom: Roskill Information Services. p. 51. ISBN 978-0-86214-250-6.
- ↑ Chin, Cheng; Grimm, Rudolf; Julienne, Paul; Tiesinga, Eite (2010-04-29). "Feshbach resonances in ultracold gases". Reviews of Modern Physics. 82 (2): 1225–1286. arXiv:0812.1496. Bibcode:2010RvMP...82.1225C. doi:10.1103/RevModPhys.82.1225. S2CID 118340314.
- ↑ "Cesium 239240". Sigma-Aldrich. 2021-09-17. Retrieved 2021-12-21.
- ↑ Data from The Radiochemical Manual and Wilson, B. J. (1966) The Radiochemical Manual (2nd ed.).
- ↑ Melnikov, P.; Zanoni, L. Z. (June 2010). "Clinical effects of cesium intake". Biological Trace Element Research. 135 (1–3): 1–9. doi:10.1007/s12011-009-8486-7. PMID 19655100. S2CID 19186683.
- ↑ Pinsky, Carl; Bose, Ranjan; Taylor, J. R.; McKee, Jasper; Lapointe, Claude; Birchall, James (1981). "Cesium in mammals: Acute toxicity, organ changes and tissue accumulation". Journal of Environmental Science and Health, Part A. 16 (5): 549–567. doi:10.1080/10934528109375003.
- ↑ Johnson, Garland T.; Lewis, Trent R.; Wagner, D. Wagner (1975). "Acute toxicity of cesium and rubidium compounds". Toxicology and Applied Pharmacology. 32 (2): 239–245. doi:10.1016/0041-008X(75)90216-1. PMID 1154391.
- ↑ Rundo, J. (1964). "A Survey of the Metabolism of Caesium in Man". British Journal of Radiology. 37 (434): 108–114. doi:10.1259/0007-1285-37-434-108. PMID 14120787.
- ↑ Nishita, H.; Dixon, D.; Larson, K. H. (1962). "Accumulation of Cs and K and growth of bean plants in nutrient solution and soils". Plant and Soil. 17 (2): 221–242. doi:10.1007/BF01376226. S2CID 10293954.
- ↑ Avery, S. (1996). "Fate of caesium in the environment: Distribution between the abiotic and biotic components of aquatic and terrestrial ecosystems". Journal of Environmental Radioactivity. 30 (2): 139–171. doi:10.1016/0265-931X(96)89276-9.
- ↑ Salbu, Brit; Østby, Georg; Garmo, Torstein H.; Hove, Knut (1992). "Availability of caesium isotopes in vegetation estimated from incubation and extraction experiments". Analyst. 117 (3): 487–491. Bibcode:1992Ana...117..487S. doi:10.1039/AN9921700487. PMID 1580386.
- ↑ Vinichuk, M. (2010). "Accumulation of potassium, rubidium and caesium (133Cs and 137Cs) in various fractions of soil and fungi in a Swedish forest". Science of the Total Environment. 408 (12): 2543–2548. Bibcode:2010ScTEn.408.2543V. doi:10.1016/j.scitotenv.2010.02.024. PMID 20334900.
- ↑ Smith, Jim T.; Beresford, Nicholas A. (2005). Chernobyl: Catastrophe and Consequences. Berlin: Springer. ISBN 978-3-540-23866-9.
- ↑ Eremeev, V. N.; Chudinovskikh, T. V.; Batrakov, G. F.; Ivanova, T. M. (1991). "Radioactive isotopes of caesium in the waters and near-water atmospheric layer of the Black Sea". Physical Oceanography. 2 (1): 57–64. doi:10.1007/BF02197418. S2CID 127482742.
- ↑ Redman, H. C.; McClellan, R. O.; Jones, R. K.; Boecker, B. B.; Chiffelle, T. L.; Pickrell, J. A.; Rypka, E. W. (1972). "Toxicity of 137-CsCl in the Beagle. Early Biological Effects". Radiation Research. 50 (3): 629–648. Bibcode:1972RadR...50..629R. doi:10.2307/3573559. JSTOR 3573559. PMID 5030090.
- ↑ "Chinese 'find' radioactive ball". BBC News. 2009-03-27. Retrieved 2010-01-25.
- ↑ Charbonneau, Louis (2003-03-12). "IAEA director warns of 'dirty bomb' risk". The Washington Post. Reuters. p. A15. Archived from the original on 2008-12-05. Retrieved 2010-04-28.
इस पृष्ठ में अनुपलब्ध आंतरिक कड़ियों की सूची
- रैखिक फिल्टर
- मूर्ति प्रोद्योगिकी
- करणीय
- खास समय
- सिग्नल (इलेक्ट्रॉनिक्स)
- लगातार कश्मीर फिल्टर
- चरण विलंब
- एम-व्युत्पन्न फ़िल्टर
- स्थानांतरण प्रकार्य
- बहुपदीय फलन
- लो पास फिल्टर
- अंतःप्रतीक हस्तक्षेप
- फ़िल्टर (प्रकाशिकी)
- युग्मित उपकरण को चार्ज करें
- गांठदार तत्व
- पतली फिल्म थोक ध्वनिक गुंजयमान यंत्र
- लोहा
- परमाणु घड़ी
- फुरियर रूपांतरण
- लहर (फ़िल्टर)
- कार्तीय समन्वय प्रणाली
- अंक शास्त्र
- यूक्लिडियन स्पेस
- मामला
- ब्रम्हांड
- कद
- द्वि-आयामी अंतरिक्ष
- निर्देशांक तरीका
- अदिश (गणित)
- शास्त्रीय हैमिल्टनियन quaternions
- quaternions
- पार उत्पाद
- उत्पत्ति (गणित)
- दो प्रतिच्छेद रेखाएँ
- तिरछी रेखाएं
- समानांतर पंक्ति
- रेखीय समीकरण
- समानांतर चतुर्भुज
- वृत्त
- शंकु खंड
- विकृति (गणित)
- निर्देशांक वेक्टर
- लीनियर अलजेब्रा
- सीधा
- भौतिक विज्ञान
- लेट बीजगणित
- एक क्षेत्र पर बीजगणित
- जोड़नेवाला
- समाकृतिकता
- कार्तीय गुणन
- अंदरूनी प्रोडक्ट
- आइंस्टीन योग सम्मेलन
- इकाई वेक्टर
- टुकड़े-टुकड़े चिकना
- द्विभाजित
- आंशिक व्युत्पन्न
- आयतन तत्व
- समारोह (गणित)
- रेखा समाकलन का मौलिक प्रमेय
- खंड अनुसार
- सौम्य सतह
- फ़ानो विमान
- प्रक्षेप्य स्थान
- प्रक्षेप्य ज्यामिति
- चार आयामी अंतरिक्ष
- विद्युत प्रवाह
- उच्च लाभ एंटीना
- सर्वदिशात्मक एंटीना
- गामा किरणें
- विद्युत संकेत
- वाहक लहर
- आयाम अधिमिश्रण
- चैनल क्षमता
- आर्थिक अच्छा
- आधार - सामग्री संकोचन
- शोर उन्मुक्ति
- कॉल चिह्न
- शिशु की देखरेख करने वाला
- आईएसएम बैंड
- लंबी लहर
- एफएम प्रसारण
- सत्य के प्रति निष्ठा
- जमीनी लहर
- कम आवृत्ति
- श्रव्य विकृति
- वह-एएसी
- एमपीईजी-4
- संशोधित असतत कोसाइन परिवर्तन
- भू-स्थिर
- प्रत्यक्ष प्रसारण उपग्रह टेलीविजन
- माध्यमिक आवृत्ति
- परमाणु घड़ी
- बीपीसी (समय संकेत)
- फुल डुप्लेक्स
- बिट प्रति सेकंड
- पहला प्रतिसादकर्ता
- हवाई गलियारा
- नागरिक बंद
- विविधता स्वागत
- शून्य (रेडियो)
- बिजली का मीटर
- जमीन (बिजली)
- हवाई अड्डे की निगरानी रडार
- altimeter
- समुद्री रडार
- देशान्तर
- तोपखाने का खोल
- बचाव बीकन का संकेत देने वाली आपातकालीन स्थिति
- अंतर्राष्ट्रीय कॉस्पास-सरसैट कार्यक्रम
- संरक्षण जीवविज्ञान
- हवाई आलोक चित्र विद्या
- गैराज का दरवाज़ा
- मुख्य जेब
- अंतरिक्ष-विज्ञान
- ध्वनि-विज्ञान
- निरंतर संकेत
- मिड-रेंज स्पीकर
- फ़िल्टर (सिग्नल प्रोसेसिंग)
- उष्ण ऊर्जा
- विद्युतीय प्रतिरोध
- लंबी लाइन (दूरसंचार)
- इलास्टेंस
- गूंज
- ध्वनिक प्रतिध्वनि
- प्रत्यावर्ती धारा
- आवृत्ति विभाजन बहुसंकेतन
- छवि फ़िल्टर
- वाहक लहर
- ऊष्मा समीकरण
- प्रतिक दर
- विद्युत चालकता
- आवृति का उतार - चढ़ाव
- निरंतर कश्मीर फिल्टर
- जटिल विमान
- फासर (साइन वेव्स)
- पोर्ट (सर्किट सिद्धांत)
- लग्रांगियन यांत्रिकी
- जाल विश्लेषण
- पॉइसन इंटीग्रल
- affine परिवर्तन
- तर्कसंगत कार्य
- शोर अनुपात का संकेत
- मिलान फ़िल्टर
- रैखिक-द्विघात-गाऊसी नियंत्रण
- राज्य स्थान (नियंत्रण)
- ऑपरेशनल एंप्लीफायर
- एलटीआई प्रणाली सिद्धांत
- विशिष्ट एकीकृत परिपथ आवेदन
- सतत समय
- एंटी - एलियासिंग फ़िल्टर
- भाजक
- निश्चित बिंदु अंकगणित
- फ्लोटिंग-पॉइंट अंकगणित
- डिजिटल बाइकैड फ़िल्टर
- अनुकूली फिल्टर
- अध्यारोपण सिद्धांत
- कदम की अभिक्रिया
- राज्य स्थान (नियंत्रण)
- नियंत्रण प्रणाली
- वोल्टेज नियंत्रित थरथरानवाला
- कंपंडोर
- नमूना और पकड़
- संगणक
- अनेक संभावनाओं में से चुनी हूई प्रक्रिया
- प्रायिकता वितरण
- वर्तमान परिपथ
- गूंज रद्दीकरण
- सुविधा निकासी
- छवि उन्नीतकरण
- एक प्रकार की प्रोग्रामिंग की पर्त
- ओ एस आई मॉडल
- समानता (संचार)
- आंकड़ा अधिग्रहण
- रूपांतरण सिद्धांत
- लीनियर अलजेब्रा
- स्टचास्तिक प्रोसेसेज़
- संभावना
- गैर-स्थानीय साधन
- घटना (सिंक्रनाइज़ेशन आदिम)
- एंटीलोक ब्रेक
- उद्यम प्रणाली
- सुरक्षा-महत्वपूर्ण प्रणाली
- डेटा सामान्य
- आर टी -11
- डंब टर्मिनल
- समय बताना
- सेब II
- जल्द से जल्द समय सीमा पहले शेड्यूलिंग
- अनुकूली विभाजन अनुसूचक
- वीडियो गेम कंसोल की चौथी पीढ़ी
- वीडियो गेम कंसोल की तीसरी पीढ़ी
- नमूनाकरण दर
- अंकगणित औसत
- उच्च प्रदर्शन कंप्यूटिंग
- भयावह विफलता
- हुड विधि
- प्रणाली विश्लेषण
- समय अपरिवर्तनीय
- औद्योगिक नियंत्रण प्रणाली
- निर्देशयोग्य तर्क नियंत्रक
- प्रक्रिया अभियंता)
- नियंत्रण पाश
- संयंत्र (नियंत्रण सिद्धांत)
- क्रूज नियंत्रण
- अनुक्रमिक कार्य चार्ट
- नकारात्मक प्रतिपुष्टि
- अन्देंप्त
- नियंत्रण वॉल्व
- पीआईडी नियंत्रक
- यौगिक
- फिल्टर (सिग्नल प्रोसेसिंग)
- वितरित कोटा पद्धति
- महाकाव्यों
- डूप गति नियंत्रण
- हवाई जहाज
- संक्षिप्त और प्रारंभिकवाद
- मोटर गाड़ी
- संयुक्त राज्य नौसेना
- निर्देशित मिसाइलें
- भूभाग-निम्नलिखित रडार
- अवरक्त किरणे
- प्रेसिजन-निर्देशित युद्धपोत
- विमान भेदी युद्ध
- शाही रूसी नौसेना
- हस्तक्षेप हरा
- सेंट पीटर्सबर्ग
- योण क्षेत्र
- आकाशीय बिजली
- द्वितीय विश्वयुद्ध
- संयुक्त राज्य सेना
- डेथ रे
- पर्ल हार्बर पर हमला
- ओबाउ (नेविगेशन)
- जमीन नियंत्रित दृष्टिकोण
- भूविज्ञानी
- आंधी तूफान
- मौसम पूर्वानुमान
- बहुत बुरा मौसम
- सर्दियों का तूफान
- संकेत पहचान
- बिखरने
- इलेक्ट्रिकल कंडक्टीविटी
- पराबैगनी प्रकाश
- खालीपन
- भूसा (प्रतिमाप)
- पारद्युतिक स्थिरांक
- विद्युत चुम्बकीय विकिरण
- विद्युतीय प्रतिरोध
- प्रतिचुम्बकत्व
- बहुपथ प्रसार
- तरंग दैर्ध्य
- अर्ध-सक्रिय रडार होमिंग
- Nyquist आवृत्ति
- ध्रुवीकरण (लहरें)
- अपवर्तक सूचकांक
- नाड़ी पुनरावृत्ति आवृत्ति
- शोर मचाने वाला फ़र्श
- प्रकाश गूंज
- रेत का तूफान
- स्वत: नियंत्रण प्राप्त करें
- जय स्पाइक
- घबराना
- आयनमंडलीय परावर्तन
- वायुमंडलीय वाहिनी
- व्युत्क्रम वर्ग नियम
- इलेक्ट्रानिक युद्ध
- उड़ान का समय
- प्रकाश कि गति
- पूर्व चेतावनी रडार
- रफ़्तार
- निरंतर-लहर रडार
- स्पेकट्रूम विशेष्यग्य
- रेंज अस्पष्टता संकल्प
- मिलान फ़िल्टर
- रोटेशन
- चरणबद्ध व्यूह रचना
- मैमथ राडार
- निगरानी करना
- स्क्रीन
- पतला सरणी अभिशाप
- हवाई रडार प्रणाली
- परिमाणक्रम
- इंस्टीट्यूट ऑफ़ इलेक्ट्रिकल एंड इलेक्ट्रॉनिक्स इंजीनियर्स
- क्षितिज राडार के ऊपर
- पल्स बनाने वाला नेटवर्क
- अमेरिका में प्रदूषण की रोकथाम
- आईटी रेडियो विनियम
- रडार संकेत विशेषताएं
- हैस (रडार)
- एवियोनिक्स में एक्रोनिम्स और संक्षिप्ताक्षर
- समय की इकाई
- गुणात्मक प्रतिलोम
- रोशनी
- दिल की आवाज
- हिलाना
- सरल आवर्त गति
- नहीं (पत्र)
- एसआई व्युत्पन्न इकाई
- इंटरनेशनल इलेक्ट्रोटेक्नीकल कमीशन
- प्रति मिनट धूर्णन
- हवा की लहर
- एक समारोह का तर्क
- चरण (लहरें)
- आयामहीन मात्रा
- असतत समय संकेत
- विशेष मामला
- मध्यम (प्रकाशिकी)
- कोई भी त्रुटि
- ध्वनि की तरंग
- दृश्यमान प्रतिबिम्ब
- लय
- सुनवाई की दहलीज
- प्रजातियाँ
- मुख्य विधुत
- नाबालिग तीसरा
- माप की इकाइयां
- आवधिकता (बहुविकल्पी)
- परिमाण के आदेश (आवृत्ति)
- वर्णक्रमीय घटक
- रैखिक समय-अपरिवर्तनीय प्रणाली
- असतत समय फिल्टर
- ऑटोरेग्रेसिव मॉडल
- डिजिटल डाटा
- डिजिटल देरी लाइन
- बीआईबीओ स्थिरता
- फोरियर श्रेणी
- दोषी
- दशमलव (सिग्नल प्रोसेसिंग)
- असतत फूरियर रूपांतरण
- एफआईआर ट्रांसफर फंक्शन
- 3डी परीक्षण मॉडल
- ब्लेंडर (सॉफ्टवेयर)
- वैज्ञानिक दृश्य
- प्रतिपादन (कंप्यूटर ग्राफिक्स)
- विज्ञापन देना
- चलचित्र
- अनुभूति
- निहित सतह
- विमानन
- भूतपूर्व छात्र
- छिपी सतह निर्धारण
- अंतरिक्ष आक्रमणकारी
- लकीर खींचने की क्रिया
- एनएमओएस तर्क
- उच्च संकल्प
- एमओएस मेमोरी
- पूरक राज्य मंत्री
- नक्षत्र-भवन
- वैश्विक चमक
- मैकिंटोश कंप्यूटर
- प्रथम व्यक्ति शूटर
- साधारण मानचित्रण
- हिमयुग (2002 फ़िल्म)
- मेडागास्कर (2005 फ़िल्म)
- बायोइनफॉरमैटिक्स
- शारीरिक रूप से आधारित प्रतिपादन
- हीरे की थाली
- प्रतिबिंब (कंप्यूटर ग्राफिक्स)
- 2010 की एनिमेटेड फीचर फिल्मों की सूची
- परिवेशी बाधा
- वास्तविक समय (मीडिया)
- जानकारी
- कंकाल एनिमेशन
- भीड़ अनुकरण
- प्रक्रियात्मक एनिमेशन
- अणु प्रणाली
- कैमरा
- माइक्रोस्कोप
- इंजीनियरिंग के चित्र
- रेखापुंज छवि
- नक्शा
- हार्डवेयर एक्सिलरेशन
- अंधेरा
- गैर-समान तर्कसंगत बी-तख़्ता
- नक्शा टक्कर
- चुम्बकीय अनुनाद इमेजिंग
- नमूनाकरण (सिग्नल प्रोसेसिंग)
- sculpting
- आधुनिक कला का संग्रहालय
- गेम डेवलपर्स कांफ्रेंस
- शैक्षिक
- आपूर्ती बंद करने की आवृत्ति
- अभिक्रिया (इलेक्ट्रॉनिक्स)
- अण्डाकार फिल्टर
- सीरिज़ सर्किट)
- मिलान जेड-ट्रांसफॉर्म विधि
- कंघी फ़िल्टर
- समूह देरी
- सप्टक
- दूसरों से अलग
- लो पास फिल्टर
- निर्देश प्रति सेकंड
- अंकगणित अतिप्रवाह
- चरण (लहरें)
- हस्तक्षेप (लहर प्रसार)
- बीट (ध्वनिक)
- अण्डाकार तर्कसंगत कार्य
- जैकोबी अण्डाकार कार्य
- क्यू कारक
- यूनिट सर्कल
- फी (पत्र)
- सुनहरा अनुपात
- मोनोटोनिक
- Immittance
- ऑप एंप
- आवेग invariance
- बेसेल फ़ंक्शन
- जटिल सन्युग्म
- संकेत प्रतिबिंब
- विद्युतीय ऊर्जा
- इनपुट उपस्थिति
- एकदिश धारा
- जटिल संख्या
- भार प्रतिबाधा
- विद्युतचुंबकीय व्यवधान
- बिजली की आपूर्ति
- आम-कैथोड
- अवमन्दन कारक
- ध्वनिरोधन
- गूंज (घटना)
- फ्रेस्नेल समीकरण
- रोड़ी
- लोडिंग कॉइल
- आर एस होयतो
- लोड हो रहा है कॉइल
- चेबीशेव बहुपद
- एक बंदरगाह
- सकारात्मक-वास्तविक कार्य
- आपूर्ती बंद करने की आवृत्ति
- उच्च मार्ग
- रैखिक फ़िल्टर
- प्रतिक दर
- घेरा
- नॉन-रिटर्न-टू-जीरो
- अनियमित चर
- संघ बाध्य
- एकाधिक आवृत्ति-शिफ्ट कुंजीयन
- COMPARATOR
- द्विआधारी जोड़
- असंबद्ध संचरण
- त्रुटि समारोह
- आपसी जानकारी
- बिखरा हुआ1
- डिजिटल मॉडुलन
- डिमॉड्युलेटर
- कंघा
- खड़ी तरंगें
- नमूना दर
- प्रक्षेप
- ऑडियो सिग्नल प्रोसेसिंग
- खगोल-कंघी
- खास समय
- पोल (जटिल विश्लेषण)
- दुर्लभ
- आरसी सर्किट
- अवरोध
- स्थिर समय
- एक घोड़ा
- पुनरावृत्ति संबंध
- निष्क्रिय फिल्टर
- श्रव्य सीमा
- मिक्सिंग कंसोल
- एसी कपलिंग
- क्यूएससी ऑडियो
- संकट
- दूसरों से अलग
- डीएसएल मॉडम
- फाइबर ऑप्टिक संचार
- व्यावर्तित जोड़ी
- बातचीत का माध्यम
- समाक्षीय तार
- लंबी दूरी का टेलीफोन कनेक्शन
- डाउनस्ट्रीम (कंप्यूटर विज्ञान)
- आवृत्ति द्वैध
- आवृत्ति अभिक्रिया
- आकड़ों की योग्यता
- परीक्षण के अंतर्गत उपकरण
- कंघी फिल्टर
- निष्क्रियता (इंजीनियरिंग)
- लाभ (इलेक्ट्रॉनिक्स)
- कोने की आवृत्ति
- फील्ड इफ़ेक्ट ट्रांजिस्टर
- कम आवृत्ति दोलन
- एकीकृत परिपथ
- निरंतर-प्रतिरोध नेटवर्क
- यूनिट सर्कल
- अधिकतम प्रयोग करने योग्य आवृत्ति
- विशेषता समीकरण (कलन)
- लहर संख्या
- वेवगाइड (प्रकाशिकी)
- लाप्लासियान
- वेवनंबर
- अपवर्तन तरंग
- एकतरफा बहुपद
- एकपदी की डिग्री
- एक बहुपद का क्रम (बहुविकल्पी)
- रैखिक प्रकार्य
- कामुक समीकरण
- चतुर्थक कार्य
- क्रमसूचक अंक
- त्रिनाम
- इंटीग्रल डोमेन
- सदिश स्थल
- फील्ड (गणित)
- सेट (गणित)
- अंगूठी (गणित)
- पूर्णांक मॉड्यूल n
- लोगारित्म
- घातांक प्रकार्य
- एल्गोरिदम का विश्लेषण
- बीजगणित का मौलिक प्रमेय
- डिजिटल डाटा
- प्रारंभ करनेवाला
- ध्वनि दाब स्तर
- साधारण सेल
- निरंतर संकेत
- व्यावर्तित जोड़ी
- आवृत्ति वर्णक्रम (स्पेक्ट्रम)
- जुड़वां सीसा
- नेटवर्क विश्लेषण (विद्युत सर्किट)
- सैटेलाइट टेलीविज़न
- एक बहुपद की घात
- क्यू कारक
- निविष्टी की हानि
- खड़ी लहर
- गांठदार घटक
- गांठदार तत्व मॉडल
- विरोधी गूंज
- वितरित तत्व फ़िल्टर
- मिटटी तेल
- बहुपथ हस्तक्षेप
- पहली पीढ़ी का कंप्यूटर
- ऊर्जा परिवर्तन
- उपकरण को मापना
- ऊर्जा का रूप
- repeatability
- अभिक्रिया (इंजीनियरिंग)
- बिजली का शोर
- संचार प्रणाली
- चुंबकीय कारतूस
- स्पर्श संवेदक
- ध्वनि परावर्तन
- उज्ज्वल दीपक
- द्वितीय विश्व युद्ध के दौरान प्रौद्योगिकी
- शोर (इलेक्ट्रॉनिक्स)
- फिल्टर सिद्धांत
- डिप्लेक्सर
- हार्मोनिक विकृति
- आस्पेक्ट अनुपात
- लॉर्ड रेले
- हंस बेथे
- संतुलित जोड़ी
- असंतुलित रेखा
- भिन्नात्मक बैंडविड्थ
- स्वतंत्रता की डिग्री (भौतिकी और रसायन विज्ञान)
- देरी बराबरी
- अधिष्ठापन
- लाइनों के संचालन पर संकेतों का प्रतिबिंब
- परावर्तन गुणांक
- कसने वाला नट
- कम तापमान सह-निकाल दिया सिरेमिक
- हवाई जहाज
- परावैद्युतांक
- ऊष्मीय चालकता
- वैफ़ल आयरन
- नकारात्मक प्रतिरोध एम्पलीफायर
- आधार मिलान
- इस्पात मिश्र धातु
- लाउडस्पीकर बाड़े
- ताकत
- दोहरी प्रतिबाधा
- गांठदार-तत्व मॉडल
- गैरपेशेवर रेडियो
- भंवर धारा
- चीनी मिट्टी
- विद्युत यांत्रिक युग्मन गुणांक
- भाग प्रति अरब
- आपसी अधिष्ठापन
- शिखर से शिखर तक
- वारैक्टर
- पीस (अपघर्षक काटने)
- स्पंदित लेजर बयान
- ध्रुव (जटिल विश्लेषण)
- कम उत्तीर्ण
- ऑपरेशनल एंप्लीफायर
- YIG क्षेत्र
- अनुरूप संकेत
- सभा की भाषा
- घुमाव
- निश्चित बिंदु अंकगणित
- डेटा पथ
- पता पीढ़ी इकाई
- बुंदाडा इटाकुरा
- मोशन वेक्टर
- SE444
- गति मुआवजा
- भाषा संकलन
- पीएमओएस तर्क
- तंग पाश
- अंकगणितीय तर्क इकाई
- ट्राईमीडिया (मीडिया प्रोसेसर)
- कृत्रिम होशियारी
- एक चिप पर सिस्टम
- पुनर्निर्माण फिल्टर
- नमूनाकरण (सिग्नल प्रोसेसिंग)
- तेजी से अनुमानित एंटी-अलियासिंग
- नमूनाचयन आवृत्ति
- डिजीटल
- फ़िल्टर बैंक
- स्थानीय थरथरानवाला
- सुपरहेटरोडाइन रिसीवर
- यव (रोटेशन)
- चूरा लहर
- पीजोइलेक्ट्रिक सामग्री की सूची
- स्कैनिंग जांच माइक्रोस्कोपी
- पिकअप (संगीत प्रौद्योगिकी)
- विद्युतीय संभाव्यता
- टोपाज़
- पहला विश्व युद्ध
- गूंज (घटना)
- गन्ना की चीनी
- वेक्टर क्षेत्र
- चार्ज का घनत्व
- खिसकाना
- वोइगट नोटेशन
- मैडेलुंग स्थिरांक
- लिथियम टैंटलेट
- पीतल
- काल्कोजन
- ध्रुवीय अर्धचालकों में गैर रेखीय पीजोइलेक्ट्रिक प्रभाव
- पैरीलीन
- फोजी
- संपर्क माइक्रोफ़ोन
- गैर विनाशकारी परीक्षण
- उठाओ (संगीत प्रौद्योगिकी)
- स्कैनिंग टनलिंग माइक्रोस्कोप
- रॉबर्ट बॉश GmbH
- चुम्बकीय अनुनाद इमेजिंग
- सार्वजनिक रेल
- गुहिकायन
- उच्च तीव्रता केंद्रित अल्ट्रासाउंड
- थरथरानवाला
- घड़ी की नाड़ी
- टकराव
- तार की रस्सी
- अत्यंत सहनशक्ति
- उपज (इंजीनियरिंग)
- लोहे के अपरूप
- समुंद्री जहाज
- क्रिस्टल लैटिस
- हथियार, शस्त्र
- आधारभूत संरचना
- रॉकेट्स
- अस्थिभंग बेरहमी
- एनीलिंग (धातु विज्ञान)
- तड़के (धातु विज्ञान)
- औजार
- ग्रीनहाउस गैस का उत्सर्जन
- बोरान
- अलॉय स्टील
- ताँबा
- नरम लोहा
- क्रस्ट (भूविज्ञान)
- लकड़ी का कोयला
- धातु थकान
- निष्क्रियता (रसायन विज्ञान)
- उच्च गति स्टील
- प्रमुख
- कमरे का तापमान
- शरीर केंद्रित घन
- चेहरा केंद्रित घन
- अनाज सीमाएं
- तलछट
- शरीर केंद्रित चतुष्कोणीय
- अपरूपण तनाव
- काम सख्त
- शारीरिक संपीड़न
- अनाज के आकार में वृद्धि
- वसूली (धातु विज्ञान)
- उष्मा उपचार
- निरंतर ढलाई
- इनगट
- कास्टिंग (धातु का काम)
- हॉट रोलिंग
- इबेरिआ का प्रायद्वीप
- श्री लंका
- युद्धरत राज्यों की अवधि
- हान साम्राज्य
- क्लासिकल एंटिक्विटी
- Tissamaharama तमिल ब्राह्मी शिलालेख
- चेरा डायनेस्टी
- पैगोपोलिस के ज़ोसिमोस
- तत्व का पता लगाएं
- कम कार्बन अर्थव्यवस्था
- गीत राजवंश
- फाइनरी फोर्ज
- तुलसी ब्रुक (धातुकर्मी)
- मामले को मजबूत बनाना
- लौह अयस्क
- खुली चूल्हा भट्टी
- उत्थान और पतन
- इस्पात उत्पादकों की सूची
- कम मिश्र धातु स्टील
- एचएसएलए स्टील
- दोहरे चरण स्टील
- हॉट डिप गल्वनाइजिंग
- तेजी से सख्त होना
- बढ़ने की योग्यता
- जिंदगी के जबड़े
- नाखून (इंजीनियरिंग)
- हाथ - या
- खुदाई
- लुढ़का सजातीय कवच
- सफेद वस्तुओं
- इस्पात की पतली तारें
- छुरा
- ओवरहेड पावर लाइन
- घड़ी
- परमाणु हथियार परीक्षण
- मशीन की
- ताप विस्तार प्रसार गुणांक
- नकारात्मक प्रतिपुष्टि
- गर्म करने वाला तत्व
- घड़ी
- कैल्शियम मानक
- अरेखीय प्रकाशिकी
- धरती
- मणि पत्थर
- मोह पैमाने की कठोरता
- खरोंच कठोरता
- पूर्व मध्य जर्मन
- मध्य उच्च जर्मन
- प्राचीन यूनानी
- पारदर्शिता और पारदर्शिता
- सकल (भूविज्ञान)
- कैल्सेडनी
- सुलेमानी पत्थर
- बिल्लौर
- बैंगनी रंग)
- नीला रंग)
- खनिज कठोरता का मोह पैमाना
- क्षुद्रग्रह (रत्न विज्ञान)
- मैंने
- एराइड आइलैंड
- सेशल्स
- तलछटी पत्थर
- रूपांतरित चट्टान
- धरती
- परिपक्वता (तलछट विज्ञान)
- नस (भूविज्ञान)
- सेमीकंडक्टर
- बटन लगाना
- पत्थर का औजार
- पाषाण प्रौद्योगिकी
- आयरलैंड का गणराज्य
- पूर्व-कोलंबियाई युग
- पियर्स थरथरानवाला
- पतली फिल्म मोटाई मॉनिटर
- ट्यूनेड सर्किट
- पेंडुलम क्लॉक
- बेल लेबोरेटरीज
- ट्यूनिंग कांटा
- एलसी थरथरानवाला
- सामरिक सामग्री
- एचिंग
- सतह ध्वनिक तरंग
- समावेशन (खनिज)
- जिंक आक्साइड
- नव युवक
- गैस निकालना
- शॉक (यांत्रिकी)
- जी बल
- रासायनिक चमकाने
- प्रति-चुंबकीय
- रैंडम संख्या जनरेटर
- दिमाग
- कंपन
- विवेक
- लोंगिट्युडिनल वेव
- डायाफ्राम (ध्वनिकी)
- प्रतिबिंब (भौतिकी)
- श्यानता
- वस्तुस्थिति
- विरल करना
- समतल लहर
- ध्वनि का दाब
- ध्वनि तीव्रता
- रुद्धोष्म प्रक्रिया
- आपेक्षिक यूलर समीकरण
- वर्गमूल औसत का वर्ग
- वर्गमूल औसत का वर्ग
- जवाबदेही
- आवृत्तियों
- बर्ड वोकलिज़ेशन
- समुद्री स्तनधारियों
- सस्तन प्राणी
- हीड्रास्फीयर
- प्रबलता
- शिकार
- भाषण संचार
- श्वेत रव
- ध्वनिरोधन
- सोनार
- रॉयल सोसाइटी के फेलो
- रडार अनुसंधान प्रतिष्ठान
- रॉयल सिग्नल और रडार स्थापना
- रेले तरंगें
- एचएफई वंशानुगत हेमोक्रोमैटोसिस
- लौह अधिभार
- ध्वनिकी संस्थान (यूनाइटेड किंगडम)
- गैबर मेडल
- हाइब्रिड इंटीग्रेटेड सर्किट
- खास समय
- समय क्षेत्र
- मैक्सिम इंटीग्रेटेड प्रोडक्ट्स
- प्यार की तरंगे
- लोंगिट्युडिनल वेव
- देखा फिल्टर
- एलसी फिल्टर
- सतह ध्वनिक तरंग सेंसर
- टॉर्कः
- चरण बंद लूप
- भूकंप का झटका
- फोनोन
- qubit
- स्पिन वेव
- क्वांटम जानकारी
- ध्वनिक-विद्युत प्रभाव
- बहाव का वेग
- जेट (द्रव)
- मिश्रण (प्रक्रिया इंजीनियरिंग)
- छोटी बूंद आधारित माइक्रोफ्लुइडिक्स
- अर्ध-लहर द्विध्रुव
- सकारात्मक आरोप
- प्रेरित तत्व
- विकिरण स्वरुप
- विद्युतचुम्बकीय तरंगें
- लॉग-आवधिक एंटीना
- चरणबद्ध व्यूह रचना
- चुंबकीय पाश एंटीना
- काउंटरपोइज़ (ग्राउंड सिस्टम)
- जमीन (बिजली)
- तांबे का नुकसान
- फोकस (प्रकाशिकी)
- गैरपेशेवर रेडियो
- दिशिकता
- लाभ (विद्युत चुम्बकीय)
- कम शोर एम्पलीफायर
- शून्य (रेडियो)
- चरणबद्ध
- वोर्सिगट एंटीना
- फील्ड की छमता
- प्रतिबाधा मैच
- लाइन-ऑफ़-विज़न प्रसार
- दाहिने हाथ का नियम
- विशिष्टता (तकनीकी मानक)
- आकाश की लहर
- परावर्तक प्रतिबिंब
- व्युत्क्रम वर्ग नियम
- ऊर्जा घटक
- एंटीना प्रकार
- लौहचुंबकीय
- स्थिर हरा
- रेखा की चौडाई
- YIG फ़िल्टर
- प्रकाश तरंगदैर्घ्य
- solenoid
- इन्सुलेटर (बिजली)
- चुंबकीय क्षेत्र
- गति देनेवाला
- पार्टिकल एक्सेलेटर
- प्रेरण ऊष्मन
- चुंबकीय ताला
- एम्पीयर-टर्न
- अरेखीय
- सीमित तत्व विधि
- remanence
- चुंबकीय परिपथ
- टेस्ला (इकाई)
- चुम्बकीय भेद्यता
- वयर्थ ऊष्मा
- एकदिश धारा
- इलेक्ट्रिक आर्क
- चुंबकीय क्षेत्र रेखाएं
- फाड़ना
- भंवर धारा
- हिस्टैरिसीस हानि
- क्षेत्र रेखा
- प्रत्यारोपण (यांत्रिक प्रक्रिया)
- पदार्थ विज्ञान
- परमाणु क्रमांक
- समस्थानिक
- श्वसन संबंधी रोग
- तत्व का पता लगाएं
- Ytterby
- वैद्युतीयऋणात्मकता
- समूह 3 तत्व
- भाप
- संयोजकता (रसायन विज्ञान)
- यट्रियम (III) ऑक्साइड
- घुलनशीलता
- यट्रियम (III) फ्लोराइड
- यट्रियम (III) क्लोराइड
- ऑर्गेनोयट्रियम केमिस्ट्री
- ट्रिमराइज़ेशन
- सौर प्रणाली
- न्यूट्रॉन कैप्चर
- मीरा
- परमाणु कचरा
- हाफ लाइफ
- निम्नतम अवस्था
- समावयवी संक्रमण
- जोहान गैडोलिन
- पृथ्वी (रसायन विज्ञान)
- येट्रियम बेरियम कॉपर ऑक्साइड
- ज़ेनोटाइम
- भाग प्रति दस लाख
- स्तन का दूध
- पत्ता गोभी
- परमाणु भार
- माउंटेन पास रेयर अर्थ माइन
- येट्रियम फ्लोराइड
- सीआरटी टेलीविजन
- यत्रियम आयरन गार्नेट
- हीरा
- दोपंत
- थर्मल विस्तार
- नस
- मेरुदण्ड
- रूमेटाइड गठिया
- वाईबीसीओ
- बिजली के वाहन
- रंग
- फुफ्फुसीय शोथ
- व्यावसायिक सुरक्षा और स्वास्थ्य प्रसाशन
- अनुशंसित जोखिम सीमा
- अनाज की सीमा
- क्रिस्टलोग्राफी
- क्रिस्टलोग्राफिक दोष
- एनिस्ट्रोपिक
- अपवित्रता
- पुन: क्रिस्टलीकरण (रसायन विज्ञान)
- किरोपोलोस विधि
- वर्न्यूइल विधि
- तरल चरण एपिटॉक्सी
- फील्ड इफ़ेक्ट ट्रांजिस्टर
- राष्ट्रीय प्रज्वलन सुविधा
- अतिसंतृप्ति
- इलेक्ट्रिकल कंडक्टीविटी
- इंटरनेशनल एनील्ड कॉपर स्टैंडर्ड
- भूतल विज्ञान
- संघनित पदार्थ भौतिकी
- हीलियम परमाणु प्रकीर्णन
- क्रिस्टल की संरचना
- कम ऊर्जा इलेक्ट्रॉन विवर्तन
- कोण-समाधानित प्रकाश उत्सर्जन स्पेक्ट्रोस्कोपी
- आंशिक क्रिस्टलीकरण (रसायन विज्ञान)
- अलकाली धातु
- सीज़ियम-133
- नापाक
- दूसरा
- रेडियोसमस्थानिक
- उत्सर्जन चित्र
- लचीलापन
- चमक (खनिज)
- प्रकाश द्वारा सहज प्रभावित
- दाढ़ एकाग्रता
- क्षारीय धातु
- कटियन
- ऋणायन
- अरहेनियस क्षार
- काल्कोजन
- लुईस क्षार
- सीज़ियम फ्लोराइड
- आदिम कोशिका
- जन अंक
- नाभिकीय चुबकीय अनुनाद
- परमाणु समावयवी
- विखंडन उत्पाद उपज
- खर्च किया गया परमाणु ईंधन
- आयोडीन के समस्थानिक
- पृथ्वी का वातावरण
- परमाणु नतीजा
- भाग प्रति दस लाख
- फिटकिरी
- निक्षालन (धातु विज्ञान)
- शुद्ध जल
- एल्कलाइन अर्थ मेटल
- परमाण्विक भार
- माध्यमिक आयन मास स्पेक्ट्रोमेट्री
- तौल और माप पर सामान्य सम्मेलन
- निष्कर्षण तेल उद्योग
- पूर्णता (तेल और गैस के कुएं)
- डिफरेंशियल सेंट्रीफ्यूजेशन
- ऑर्गेनेल
- कार्बनिक रसायन शास्त्र
- विकिरण उपचार
- सीज़ियम के समस्थानिक
- भड़कना (आतिशबाजी)
- मिरगी
- फेशबैक प्रतिध्वनि
- क्वांटम तकनीक
- हृदय गति रुकना
- ऑटो ज्वलन ताप
- बीओस्फिअ
- अंतरराष्ट्रीय परमाणु ऊर्जा एजेंसी
- गंदा बम
- मेपल के पेड़ दुर्घटना
बाहरी संबंध
- Caesium or Cesium at The Periodic Table of Videos (University of Nottingham)
- View the reaction of Caesium (most reactive metal in the periodic table) with Fluorine (most reactive non-metal) courtesy of The Royal Institution.
- Rogachev, Andrey Yu.; Miao, Mao-Sheng; Merino, Gabriel; Hoffmann, Roald (2015). "Molecular CsF5and CsF2+". Angewandte Chemie. 127 (28): 8393–8396. Bibcode:2015AngCh.127.8393R. doi:10.1002/ange.201500402.

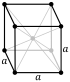








![Graph of percentage of the radioactive output by each nuclide that form after a nuclear fallout vs. घटना के बाद समय का लघुगणक। विभिन्न रंगों के वक्रों में, विकिरण के प्रमुख स्रोत को क्रम में दर्शाया गया है: पहले पांच या इतने दिनों के लिए Te-132/I-132; I-131 अगले पांच के लिए; संक्षेप में बीए-140/ला-140; Zr-95/Nb-95 दिन 10 से दिन 200 तक; और अंत में सीएस-137। रेडियोधर्मिता का उत्पादन करने वाले अन्य न्यूक्लाइड, लेकिन एक प्रमुख घटक के रूप में चरम पर नहीं हैं, आरयू, लगभग 50 दिनों में, और सीएस-134 लगभग 600 दिनों में। चेरनोबिल आपदा। दुर्घटना के लगभग 200 दिन बाद सीज़ियम-137 विकिरण का प्राथमिक स्रोत बन गया।[110]](https://upload.wikimedia.org/wikipedia/commons/thumb/2/2c/AirDoseChernobylVector.svg/langen-gb-420px-AirDoseChernobylVector.svg.png)