आयनीकरण ऊर्जा

भौतिकी और रसायन विज्ञान में आयनीकरण ऊर्जा (IE) (अमेरिकी अंग्रेजी वर्तनी) आयनीकरण ऊर्जा (ब्रिटिश अंग्रेजी वर्तनी) पृथक गैसीय परमाणु, आयन या अणु के सबसे शिथिल बाध्य इलेक्ट्रॉन को पृथक करने के लिए आवश्यक न्यूनतम ऊर्जा है।[1] पहली आयनीकरण ऊर्जा को मात्रात्मक रूप में व्यक्त किया जाता है
- X (g) + ऊर्जा ⟶ X+(g) + e-
जहाँ X कोई परमाणु या अणु है एवं X+ परिणामी आयन है जब मूल परमाणु को एकल इलेक्ट्रॉन से पृथक किया गया और e− इलेक्ट्रॉन निकाला गया है।[2] आयनीकरण ऊर्जा तटस्थ परमाणुओं के लिए सकारात्मक है जिसका अर्थ है कि आयनीकरण एंडोथर्मिक प्रक्रिया है। सामान्य शब्दों में सबसे बाहरी इलेक्ट्रॉन परमाणु नाभिक के जितने पास होते हैं परमाणु की आयनीकरण ऊर्जा उतनी ही अधिक होती है।
भौतिकी में आयनीकरण ऊर्जा को सामान्य रूप में इलेक्ट्रॉनवोल्ट (eV) या जूल (J) में व्यक्त किया जाता है। रसायन विज्ञान में इसे परमाणुओं या अणुओं के एक मोल (इकाई) को आयनित करने के लिए ऊर्जा के रूप में तथा सामान्य रूप में जूल प्रति मोल (kj/mol) या किलोकैलोरीज प्रति मोल (kcal/mol) व्यक्त किया जाता है।[3]
आवर्त सारणी में परमाणुओं की आयनीकरण ऊर्जाओं की तुलना से दो आवर्त प्रवृत्तियों का पता चलता है जो कूलम्बिक आकर्षण के नियमों का पालन करती हैं:[4]
- आयनीकरण ऊर्जा सामान्य रूप से निश्चित अवधि (आवर्त सारणी) (अर्थात पंक्ति) के भीतर बाएं से दाएं बढ़ती है।
- आयनीकरण ऊर्जा सामान्य रूप से किसी दिए गए समूह (आवर्त सारणी) (अर्थात कॉलम) में ऊपर से नीचे की ओर घटती है।
बाद की प्रवृत्ति बाहरी इलेक्ट्रॉन कवच से नाभिक से उत्तरोत्तर दूर होने के परिणामस्वरूप होती है जहाँ प्रति पंक्ति आंतरिक शेल के अतिरिक्त के रूप में एक स्तंभ नीचे जाता है।
nवें आयनीकरण ऊर्जा (n - 1) के धनात्मक आवेश वाली प्रजातियों से सबसे अधिक दुर्बल इलेक्ट्रॉन बन्ध को पृथक करने के लिए आवश्यक ऊर्जा की मात्रा को संदर्भित करती है। उदाहरण के लिए प्रथम तीन आयनीकरण ऊर्जाओं को इस प्रकार परिभाषित किया गया है:
- प्रथम आयनीकरण ऊर्जा वह ऊर्जा है जो प्रतिक्रिया X ⟶ X+ + e- को सक्षम बनाती है
- द्वितीय आयनीकरण ऊर्जा वह ऊर्जा है जो प्रतिक्रिया X+⟶ X2 + e- को सक्षम बनाती है
- तृतीय आयनीकरण ऊर्जा वह ऊर्जा है जो प्रतिक्रिया X2+ ⟶ X3+ + e- को सक्षम बनाती है
आयनीकरण ऊर्जा को निर्धारित करने वाले सबसे उल्लेखनीय प्रभावों में निम्नलिखित सम्मिलित हैं:
- इलेक्ट्रॉन विन्यास: यह अधिकांश तत्वों के IE के लिए गणना है क्योंकि उनके सभी रासायनिक और भौतिक विशेषताओं को केवल उनके संबंधित इलेक्ट्रॉन विन्यास का निर्धारण करके पता लगाया जा सकता है।
- नाभिकीय आवेश: यदि नाभिकीय आवेश (परमाणु क्रमांक) अधिक है तो इलेक्ट्रॉन नाभिक द्वारा अधिक मजबूती से बंधे होते हैं और इसलिए आयनीकरण ऊर्जा अधिक (किसी निश्चित अवधि के भीतर उल्लिखित प्रवृत्ति 1 की ओर अग्रसर) होगी।
- इलेक्ट्रॉन कोशों की संख्या: यदि अधिक कोशों की उपस्थिति के कारण परमाणु का आकार बड़ा होता है तो इलेक्ट्रॉनों को नाभिक द्वारा कम शक्ति से पकड़ा जाता है जहाँ आयनीकरण ऊर्जा कम होगी।
- प्रभावी परमाणु प्रभार (Zeff): यदि इलेक्ट्रॉन परिरक्षण प्रभाव और प्रवेश अधिक है तो इलेक्ट्रॉनों को नाभिक द्वारा कम मजबूती से रखा जाता है जहाँ Zeff इलेक्ट्रॉन और आयनीकरण ऊर्जा छोटी होती है।[5]
- स्थिरता: अधिक स्थिर इलेक्ट्रॉन विन्यास वाले परमाणु में इलेक्ट्रॉनों के लुप्त होने की प्रवृत्ति कम होती है और इसके परिणामस्वरूप उच्च आयनीकरण ऊर्जा होती है।
सामान्य प्रभावों में निम्नलिखित सम्मिलित हैं:
- आपेक्षिकीय क्वांटम रसायन: भारी तत्व (विशेष रूप से जिनकी परमाणु संख्या लगभग 70 से अधिक है) इनसे प्रभावित होते हैं क्योंकि उनके इलेक्ट्रॉन प्रकाश की गति के निकट पहुंच रहे हैं। इसलिए उनके पास कम परमाणु त्रिज्या और उच्च आयनीकरण ऊर्जा होती है।
- लैंथेनाइड संकुचन (और डी-ब्लॉक संकुचन): तत्वों का सिकुड़ना आयनीकरण ऊर्जा को प्रभावित करता है क्योंकि नाभिक का शुद्ध आवेश अधिक शक्ति से अनुभव होता है।
- इलेक्ट्रॉन युग्म: आधे भरे हुए उपकोश सामान्य रूप में उच्च आयनीकरण ऊर्जा में परिणत होते हैं।
आयनीकरण क्षमता शब्द आयनीकरण ऊर्जा के लिए[6] पुराना और अप्रचलित शब्द है[7] क्योंकि आयनीकरण ऊर्जा को मापने का सबसे पुराना उपाय नमूने को आयनित करने और इलेक्ट्रोस्टैटिक कण त्वरक का उपयोग करके हटाए गए इलेक्ट्रॉन को गति देने पर आधारित था।
आयनीकरण ऊर्जा का निर्धारण
परमाणुओं की आयनीकरण ऊर्जा जिसे Ei द्वारा निरूपित किया जाता है इसे प्रकाश क्वांटा (फोटॉन) या ज्ञात ऊर्जा के लिए त्वरित इलेक्ट्रॉनों की न्यूनतम ऊर्जा का पता लगाकर मापा जाता है[8] जो कम से कम बाध्य परमाणु इलेक्ट्रॉनों को बाहर निकाल देता है। इसका मापन एकल परमाणुओं पर गैस चरण में किया जाता है। जबकि केवल नोबल गैसें एक परमाणुक गैस के रूप में होती हैं तथा अन्य गैसों को एकल परमाणुओं में विभाजित किया जा सकता है।[9] साथ ही कई ठोस तत्वों को गर्म करके एकल परमाणुओं में वाष्पीकृत किया जा सकता है। मोनोएटोमिक वाष्प पहले से रिक्त ट्यूब में समाहित है जिसमें वोल्टेज स्रोत से जुड़े दो समानांतर इलेक्ट्रोड होते हैं। आयनीकरण उत्तीव्रना ट्यूब की दीवारों के माध्यम से प्रस्तुत की जाती है या भीतर उत्पन्न होती है।
जब पराबैंगनी प्रकाश का उपयोग किया जाता है तो तरंग दैर्ध्य पराबैंगनी सीमा से नीचे बह जाता है। एक निश्चित तरंग दैर्ध्य (λ) और प्रकाश की आवृत्ति (ν=c/λ, जहां c प्रकाश की गति है) पर प्रकाश क्वांटा की ऊर्जा आवृत्ति के समानुपाती होती है जो कम से कम बाध्य इलेक्ट्रॉनों को पृथक करने के लिए पर्याप्त ऊर्जा होगी। ये इलेक्ट्रॉन धनात्मक इलेक्ट्रोड की ओर आकर्षित होंगे और फोटोआयनीकरण के बाद शेष धनात्मक आयन ऋणात्मक रूप से आवेशित इलेक्ट्रोड की ओर आकर्षित होंगे। ये इलेक्ट्रॉन और आयन ट्यूब के माध्यम से धारा स्थापित करेंगे। आयनीकरण ऊर्जा फोटॉन hvi की ऊर्जा होगी (h प्लैंक स्थिरांक है) जिसने धारा Ei = hvi में तीव्रता से वृद्धि की: .
जब परमाणुओं को आयनित करने के लिए उच्च-वेग वाले इलेक्ट्रॉनों का उपयोग किया जाता है तो वे एक समान खाली ट्यूब के अंदर एक इलेक्ट्रॉन बंदूक द्वारा निर्मित होते हैं। इलेक्ट्रॉन गन की ऊर्जा को त्वरण वोल्टेज द्वारा नियंत्रित किया जा सकता है। इन इलेक्ट्रॉनों की ऊर्जा जो ट्यूब के माध्यम से आयनों और मुक्त इलेक्ट्रॉनों की धारा की तीव्रता को उत्पन्न करती है जो परमाणुओं की आयनीकरण ऊर्जा से मेल खाती है।
परमाणु: मूल्य और रुझान
सामान्य रूप से किसी विशेष तत्व की (N+1) वीं आयनीकरण ऊर्जा Nवीं आयनीकरण ऊर्जा से बड़ी होती है (यह भी ध्यान दिया जा सकता है कि आयनों की आयनीकरण ऊर्जा सामान्य रूप से उसी तत्व के लिए धनायन और तटस्थ परमाणु से कम होती है)। जब अगली आयनीकरण ऊर्जा में उसी इलेक्ट्रॉन शेल से एक इलेक्ट्रॉन को निकालना सम्मिलित होता है तो आयनीकरण ऊर्जा में वृद्धि मुख्य रूप से आयन के बढ़े हुए शुद्ध आवेश के कारण होती है जिससे इलेक्ट्रॉन को हटाया जा रहा है। अधिक आवेशित आयनों से निकाले गए इलेक्ट्रॉन इलेक्ट्रोस्टैटिक आकर्षण के अधिक बल का अनुभव करते हैं; इस प्रकार उनके निष्कासन के लिए अधिक ऊर्जा की आवश्यकता होती है। इसके अतिरिक्त जब अगली आयनीकरण ऊर्जा में एक इलेक्ट्रॉन को एक निचले इलेक्ट्रॉन खोल से निकालना सम्मिलित होता है तो नाभिक और इलेक्ट्रॉन के मध्य की बहुत कम दूरी भी इलेक्ट्रोस्टैटिक बल और उस दूरी को बढ़ाती है जिस पर इलेक्ट्रॉन को हटाने के लिए उस बल को पार करना होगा। ये दोनों कारक आयनीकरण ऊर्जा को और बढ़ाते हैं।
तृतीय आवर्त के तत्वों के कुछ मान निम्नलिखित तालिका में दिए गए हैं:
| तत्व | पहला | दूसरा | तीसरा | चौथा | पांचवां | छठा | सातवां |
|---|---|---|---|---|---|---|---|
| Na | 496 | 4,560 | |||||
| Mg | 738 | 1,450 | 7,730 | ||||
| Al | 577 | 1,816 | 2,881 | 11,600 | |||
| Si | 786 | 1,577 | 3,228 | 4,354 | 16,100 | ||
| P | 1,060 | 1,890 | 2,905 | 4,950 | 6,270 | 21,200 | |
| S | 1,000 | 2,295 | 3,375 | 4,565 | 6,950 | 8,490 | 27,107 |
| Cl | 1,256 | 2,260 | 3,850 | 5,160 | 6,560 | 9,360 | 11,000 |
| Ar | 1,520 | 2,665 | 3,945 | 5,770 | 7,230 | 8,780 | 12,000 |
उत्तरोत्तर मोलर आयनीकरण ऊर्जा में बड़ी छलांग तब लगती है जब नोबल गैस विन्यास अस्थायी होते हैं। उदाहरण के लिए जैसा कि ऊपर दी गई तालिका में देखा जा सकता है मैग्नीशियम की पहली दो मोलर आयनीकरण ऊर्जा (मैग्नीशियम परमाणु से दो 3s इलेक्ट्रॉनों को पृथक करना) तीसरे की तुलना में बहुत छोटी है जिसके लिए mg2+ के नियोन कॉन्फ़िगरेशन से 2p इलेक्ट्रॉन को पृथक करने की आवश्यकता होती है। वे 2p इलेक्ट्रॉन पहले हटाए गए 3s इलेक्ट्रॉनों की तुलना में नाभिक के अधिक निकट है।
आवर्त सारणी के भीतर आयनीकरण ऊर्जा भी आवधिक प्रवृत्ति है। आवर्त (आवर्त सारणी) के भीतर बाएँ से दाएँ जाने पर या समूह (आवर्त सारणी) के भीतर ऊपर की ओर जाने पर पहली आयनीकरण ऊर्जा सामान्य रूप से बढ़ जाती है[10] उदारहणार्थ उपरोक्त तालिका में एल्यूमीनियम और सल्फर जैसे अपवादों के साथ। जैसे-जैसे अवधि के दौरान नाभिक का परमाणु आवेश बढ़ता है इलेक्ट्रॉनों और प्रोटॉन के मध्य इलेक्ट्रोस्टैटिक आकर्षण बढ़ता है इसलिए परमाणु त्रिज्या कम हो जाती है और इलेक्ट्रॉन बादल नाभिक के निकट आ जाता है।[11] क्योंकि इलेक्ट्रॉन विशेष रूप से सबसे बाहरी उच्च प्रभावी परमाणु आवेश द्वारा अधिक मजबूती से बंधे होते हैं।
किसी दिए गए समूह के भीतर नीचे की ओर जाने पर इलेक्ट्रॉनों को उच्च-ऊर्जा के वृत्त में रखा जाता है जिसमें उच्च प्रमुख क्वांटम संख्या n होती है जो नाभिक से आगे होती है और इसलिए अधिक शिथिल रूप से बंधी होती है ताकि आयनीकरण ऊर्जा कम हो जाए। प्रभावी नाभिकीय आवेश केवल धीरे-धीरे बढ़ता है ताकि इसका प्रभाव n में वृद्धि से अधिक हो जाए।[12]
आयनीकरण ऊर्जा में अपवाद
एक अवधि के भीतर बढ़ती आयनीकरण ऊर्जाओं की सामान्य प्रवृत्ति के अपवाद हैं। उदाहरण के लिए बैरीलियम(
4Be
: 9.3 eV) से बोरॉन (
5B
: 8.3 eV), और नाइट्रोजन (
7N
: 14.5 eV) से ऑक्सीजन (
8O
: 13.6 eV) मान घटता है। इलेक्ट्रॉन विन्यास के संदर्भ में इन डिप्स को समझाया जा सकता है।[13]
बोरॉन का अपना अंतिम इलेक्ट्रॉन 2p कक्षीय में होता है जिसका इलेक्ट्रॉन घनत्व समान शेल में 2s इलेक्ट्रॉनों की तुलना में औसतन नाभिक से अधिक दूर होता है। 2s इलेक्ट्रॉन तब नाभिक से 2p इलेक्ट्रॉन को कुछ सीमा तक ढाल देते हैं, और बेरिलियम से 2s इलेक्ट्रॉन को निकालने की तुलना में बोरॉन से 2p इलेक्ट्रॉन को निकालना सरल होता है जिसके परिणामस्वरूप B के लिए आयनीकरण ऊर्जा कम होती है।[2]
ऑक्सीजन में अंतिम इलेक्ट्रॉन विरोधी स्पिन (भौतिकी) के एक इलेक्ट्रॉन के साथ एक दोगुना व्याप्त पी-ऑर्बिटल साझा करता है। एक ही कक्षीय में दो इलेक्ट्रॉन विभिन्न कक्षकों में दो इलेक्ट्रॉनों की तुलना में औसतन एक साथ निकट होते हैं जिससे वे एक दूसरे को अधिक प्रभावी ढंग से ढाल देते हैं और एक को पृथक करना सरल होता है जिसके परिणामस्वरूप कम आयनीकरण ऊर्जा होती है।[2][14]
इसके अतिरिक्त हर नोबल गैस तत्व के पश्चात आयनीकरण ऊर्जा में भारी गिरावट आती है। ऐसा इसलिए होता है क्योंकि क्षार धातुओं में बाहरी इलेक्ट्रॉन को परमाणु से आंतरिक वृत्त की तुलना में बहुत कम मात्रा में ऊर्जा की आवश्यकता होती है। यह क्षार धातुओं के लिए निम्न वैद्युतीयऋणात्मकता मानों को भी उत्पन्न करता है।[15][16][17]
प्रवृत्तियों और अपवादों को निम्नलिखित उपखंडों में संक्षेपित किया गया है:
आयनीकरण ऊर्जा घट जाती है जब
- नई अवधि के लिए संक्रमण: क्षार धातु ऑक्टेट नियम या छद्म-उत्कृष्ट गैस विन्यास छोड़ने के लिए सरलता से एक इलेक्ट्रॉन खो देता है इसलिए उन तत्वों के IE के लिए केवल छोटे मान होते हैं।
- S-ब्लॉक से P-ब्लॉक में जाना: पी-ऑर्बिटल अधिक सरलता से एक इलेक्ट्रॉन खो देता है। इलेक्ट्रॉन विन्यास 1s2 2s2 2p1 के साथ बेरिलियम से बोरॉन का एक उदाहरण है । 2s इलेक्ट्रॉन नाभिक से उच्च-ऊर्जा 2p इलेक्ट्रॉन को ढाल देते हैं जिससे इसे निकालना थोड़ा सरल हो जाता है। मैगनीशियम से अल्युमीनियम तक भी ऐसा होता है।[19]
- अन्य इलेक्ट्रॉनों के विपरीत स्पिन के साथ अपने पहले इलेक्ट्रॉन के साथ P-उपकोश पर अधिकार करना: जैसे नाइट्रोजन में (
7N
: 14.5 eV) से ऑक्सीजन (
8O
: 13.6 eV) साथ ही फास्फोरस (
15P
: 10.48 eV) से गंधक (
16S
: 10.36 eV)। इसका कारण यह है कि परिरक्षण प्रभाव के कारण ऑक्सीजन, सल्फर और सेलेनियम सभी में डिपिंग आयनीकरण ऊर्जा होती है।[20] जबकि यह टेल्यूरियम से आरम्भ होता है जहाँ परिरक्षण डिप उत्पन्न करने के लिए बहुत छोटा होता है। - D-ब्लॉक से P-ब्लॉक में जाना: जैसा कि जस्ते की स्थिति में (
30Zn
: 9.4 eV) से गैलियम (
31Ga
: 6.0 eV) - विशेष स्थिति: सीसा से कमी (
82Pb
: 7.42 eV) से बिस्मथ (
83Bi
: 7.29 eV)। इसे आकार के लिए उत्तरदायी नहीं ठहराया जा सकता है (अंतर न्यूनतम है: सीसा का सहसंयोजक त्रिज्या 146 पीकोमीटर है जबकि बिस्मथ का 148 अपराह्न है[21])। यह 6p शेल के स्पिन-ऑर्बिट विभाजन के कारण है (सीसा स्थिर 6p1/2 से एक इलेक्ट्रॉन को हटा रहा है) परन्तु बिस्मथ अस्थिर 6p3/2स्तर से एक को हटा रहा है)। - विशेष स्थिति: रेडियम से कमी (
88Ra
: 5.27 eV) से जंगी (
89Ac
: 5.17 eV) जो s से d कक्षीय में स्विच है। जबकि बेरियम से अनुरूप स्विच (
56Ba
: 5.2 eV) से लेण्टेनियुम (
57La
: 5.6 eV) नीचे की ओर परिवर्तन नहीं दिखाता है। - पेरिस (
71Lu
) और लोरेनसियम (
103Lr
) दोनों में पिछले तत्वों की तुलना में आयनीकरण ऊर्जा कम होती है। दोनों ही स्थितियों में अंतिम इलेक्ट्रॉन ने तत्वों के इलेक्ट्रॉन विन्यास (डेटा पृष्ठ) को जोड़ा: इलेक्ट्रॉन विन्यास [Xe] 4f के साथ Lu के लिए 5d14 5d1 6S2, और 7p विन्यास [Rn] 5f4 7s2 7p1 के साथ Lr के लिए जोड़ा जाता है। आयनीकरण ऊर्जा और ल्यूटेटियम और विशेष रूप से लॉरेंशियम में ये गिरावट दर्शाती है कि ये तत्व D-ब्लॉक में हैं न कि लेण्टेनियुम और एक्टिनियम।[22]
आयनीकरण ऊर्जा तब बढ़ती है जब
- समूह 18 उत्कृष्ट गैस तत्वों तक पहुँचना: यह उनके पूर्ण इलेक्ट्रॉन उपकोशों के कारण है[23] ताकि एक इलेक्ट्रॉन को निकालने के लिए इन तत्वों को बड़ी मात्रा में ऊर्जा की आवश्यकता हो।
- समूह 12: यहाँ के तत्व जस्ता (
30Zn
: 9.4 eV), कैडमियम (
48Cd
: 9.0 eV) और पारा (तत्व) (
80Hg
: 10.4 eV) सभी अपने पिछले तत्वों के विपरीत अचानक बढ़ते IE मूल्यों को रिकॉर्ड करते हैं: तांबा (
29Cu
: 7.7 eV), चांदी (
47Ag
: 7.6 eV) और सोना (
79Au
: 9.2 eV), क्रमशः। पारे के लिए यह एक्सट्रपलेशन किया जा सकता है कि 6s इलेक्ट्रॉनों के सापेक्षिक क्वांटम रसायन स्थिरीकरण से 4f इलेक्ट्रॉनों द्वारा खराब परिरक्षण के अतिरिक्त आयनीकरण ऊर्जा बढ़ जाती है जो बाहरी संतुलित इलेक्ट्रॉनों पर प्रभावी परमाणु प्रभार को बढ़ाता है। इसके अतिरिक्त बंद उपकोश इलेक्ट्रॉन विन्यास: [Ar] 3d10 4s2 , [Kr] 4d105s2 और [Xe] 4f14 5d10 6s2 बढ़ी हुई स्थिरता प्रदान करते हैं। - विशेष स्थिति: रोडियाम से परिवर्तन (
45Rh
: 7.5 eV) से पैलेडियम (
46Pd
: 8.3 eV)। अन्य समूह 10 तत्वों के विपरीत पैलेडियम में इलेक्ट्रॉन विन्यास के कारण पूर्ववर्ती परमाणु की तुलना में उच्च आयनीकरण ऊर्जा होती है। निकल के [Ar] 3d8 4s2 के विपरीत और प्लैटिनम का [Xe] 4f14 5d9 6s1 पैलेडियम का इलेक्ट्रॉन विन्यास [Kr] 4d10 5s0 है (भले ही औफबाऊ सिद्धांत संक्रमण धातु में नियम के अपवाद [Kr] 4d8 5s2 की भविष्यवाणी करता है)। अंत में चांदी का निचला IE (
47Ag
: 7.6 eV) पैलेडियम के उच्च मूल्य को और बढ़ाता है; एकल जोड़ा गया इलेक्ट्रॉन पैलेडियम की तुलना में कम आयनीकरण ऊर्जा के साथ हटा दिया जाता है[24] जो पैलेडियम के उच्च IE पर जोर देता है (जैसा IE के लिए उपरोक्त रैखिक तालिका मानों में दिखाया गया है) - गैडोलीनियम का IE (
64Gd
: 6.15 eV) पिछले दोनों की तुलना में कुछ अधिक है (
62Sm
: 5.64 eV), (
63Eu
: 5.67 eV) और निम्नलिखित तत्व (
65Tb
: 5.86 eV), (
66Dy
: 5.94 eV)। यह विसंगति इस तथ्य के कारण है कि गैडोलीनियम संतुलित डी-सबशेल संतुलित f-सबशेल से 1 इलेक्ट्रॉन उधार लेता है। अब संयोजी उपकोश d-उपकोश है और f-उपकोश के इलेक्ट्रॉनों द्वारा धनात्मक परमाणु आवेश के खराब परिरक्षण के कारण संयोजकता d-उपकोश का इलेक्ट्रॉन नाभिक के लिए अधिक आकर्षण का अनुभव करता है इसलिए आवश्यक ऊर्जा में वृद्धि (सबसे बाहरी) संतुलित इलेक्ट्रॉन को हटा देता है। - d-ब्लॉक तत्वों में जाना: Sc के तत्व एक 3d1 के साथ इलेक्ट्रॉनिक कॉन्फ़िगरेशन का IP (
21Sc
: 6.56 eV) उच्च होता है पूर्ववर्ती तत्व की तुलना में (
20Ca
: 6.11 eV), s-ब्लॉक और p-ब्लॉक तत्वों में जाने पर घटने के विपरीत 4s और 3d इलेक्ट्रॉनों में समान परिरक्षण क्षमता होती है: 3d कक्षीय n = 3 खोल का भाग होता है, जिसकी औसत स्थिति 4s कक्षीय और n = 4 खोल की तुलना में नाभिक के निकट होती है, परन्तु s कक्षकों में इलेक्ट्रॉन डी ऑर्बिटल्स में इलेक्ट्रॉनों की तुलना में नाभिक अधिक प्रवेश का अनुभव करते हैं। तो 3d और 4s इलेक्ट्रॉनों का पारस्परिक परिरक्षण शक्तिहीन है और आयनित इलेक्ट्रॉन पर प्रभावी परमाणु आवेश अपेक्षाकृत बड़ा है। येट्रियम (
39Y
),
38Sr
: 5.69 eV की तुलना में इसी प्रकार का एक उच्च IP (6.22 eV) है। - f-ब्लॉक तत्वों में जाना; अवयव (
57La
: 5.18 eV) और (
89Ac
: 5.17 eV) के पास अपने पिछले तत्वों (
56Ba
: 5.21 eV) और (
88Ra
: 5.18 eV) की तुलना में केवल थोड़ा सा कम IP है जबकि उनके परमाणु विसंगतिपूर्ण हैं क्योंकि वे f-इलेक्ट्रॉन के स्थान पर d-इलेक्ट्रॉन जोड़ते हैं। जैसा कि उपरोक्त ग्राफ में आयनीकरण ऊर्जाओं के लिए देखा जा सकता है, IE मूल्यों में तीव्र वृद्धि (
55Cs
) को (
56Ba
) एक छोटे से लगभग रैखिक वृद्धि के बाद f इलेक्ट्रॉनों को जोड़ा जाता है। यह लैंथेनाइड संकुचन (लैंथेनाइड्स के लिए) के कारण है।[25][26][27] आयनिक त्रिज्या में यह कमी आयनीकरण ऊर्जा में वृद्धि के साथ जुड़ी हुई है, बदले में दो गुणों की आवधिक प्रवृत्तियों के बाद से बढ़ जाती है।[10] d-ब्लॉक तत्वों के लिए इलेक्ट्रॉनों को आंतरिक खोल में जोड़ दिया जाता है ताकि कोई नया खोल न बने। जोड़े गए ऑर्बिटल्स का आकार उन्हें न्यूक्लियस में प्रवेश करने से रोकता है ताकि उन पर कब्जा करने वाले इलेक्ट्रॉनों की परिरक्षण क्षमता कम हो।
आयनीकरण ऊर्जा समूहों में विसंगतियाँ
समूह के भीतर भारी तत्वों में जाने पर आयनीकरण ऊर्जा का मान कम हो जाता है[13]जैसा कि अधिक इलेक्ट्रॉनों द्वारा परिरक्षण प्रदान किया जाता है और समग्र रूप से संतुलित शेल नाभिक से शक्तिहीन आकर्षण का अनुभव करते हैं जो बड़े सहसंयोजक त्रिज्या के लिए उत्तरदायी होता है जो समूह में नीचे जाने पर बढ़ता है[28] परन्तु सदैव ऐसा नहीं होता है। अपवाद के रूप में समूह 10 पैलेडियम (
46Pd
: 8.34 eV) में निकल की तुलना में उच्च आयनीकरण ऊर्जा (
28Ni
: 7.64 eV) होती है एवं टेक्नेटियम से तत्वों के लिए सामान्य कमी के विपरीत
43Tc
क्सीनन के लिए
54Xe
. ऐसी विसंगतियों का सारांश नीचे दिया गया है:
- समूह 1:
- क्षार धातुओं की तुलना में हाइड्रोजन की आयनीकरण ऊर्जा बहुत अधिक (13.59844 eV पर) है। यह इसके एकल इलेक्ट्रॉन (और इसलिए, बहुत छोटा इलेक्ट्रॉन बादल) के कारण है जो नाभिक के निकट है। इसी तरह चूंकि कोई अन्य इलेक्ट्रॉन नहीं हैं जो परिरक्षण का कारण बन सकते हैं वह एकल इलेक्ट्रॉन नाभिक के पूर्ण शुद्ध धनात्मक आवेश का अनुभव करता है।[29]
- फ्रैनशियम की आयनीकरण ऊर्जा पूर्ववर्ती क्षार धातु, सीज़ियम से अधिक है। यह इसके (और रेडियम के) छोटे आयनिक रेडी के कारण सापेक्ष प्रभाव के कारण है। उनके बड़े द्रव्यमान और आकार के कारण, इसका अर्थ है कि इसके इलेक्ट्रॉन अत्यधिक उच्च गति से यात्रा कर रहे हैं जिसके परिणामस्वरूप इलेक्ट्रॉन अपेक्षा से अधिक नाभिक के निकट आ रहे हैं और परिणामस्वरूप उन्हें निकालना कठिन होता है (उच्च IE)।[30]
- समूह 2: रेडियम की आयनीकरण ऊर्जा इसके पूर्ववर्ती क्षारीय पृथ्वी धातु बेरियम, जैसे फ्रांसियम से अधिक है, जो कि सापेक्ष प्रभाव के कारण भी है। इलेक्ट्रॉन, विशेष रूप से 1s इलेक्ट्रॉन, अत्यधिक प्रभावी नाभिकीय आवेशों का अनुभव करते हैं। नाभिक में गिरने से बचने के लिए 1s इलेक्ट्रॉनों को अधिक तीव्र गति से चलना चाहिए जिससे विशेष सापेक्षतावादी सुधार अनुमानित क्लासिकल संवेग से काफी अधिक हो जाते हैं। अनिश्चितता के सिद्धांत के अनुसार यह 1s कक्षीय (और नाभिक के निकट इलेक्ट्रॉन घनत्व वाले अन्य कक्षकों, विशेष रूप से ns और np कक्षकों) के सापेक्षिक संकुचन का कारण बनता है। इसलिए यह इलेक्ट्रॉन परिवर्तनों के प्रपात का कारण बनता है जिसके परिणामस्वरूप सबसे बाहरी इलेक्ट्रॉन वृत्त सिकुड़ते हैं और नाभिक के निकट आते हैं।
- समूह 4:
- IE में जिर्कोनियम के साथ हेफ़नियम की लगभग समानता। लैंथेनाइड संकुचन के प्रभाव अभी भी अनुभव किए जा सकते हैं।[26] इसे पूर्व के छोटे परमाणु त्रिज्या के माध्यम से देखा जा सकता है [31] जो बाद के 155 pm से भिन्न है।[32][33] यह बदले में इसकी आयनीकरण ऊर्जा को 18 kJ/mol-1 से बढ़ा देता है।
- टाइटेनियम का IE हेफ़नियम और जिरकोनियम दोनों से छोटा है। लैंथेनाइड संकुचन के कारण हेफ़नियम की आयनीकरण ऊर्जा जिरकोनियम के समान है। जबकि जिरकोनियम की आयनीकरण ऊर्जा पिछले तत्वों की तुलना में अधिक क्यों है जोअस्पष्ट बनी हुई है; हम इसे परमाणु त्रिज्या के लिए विशेषता नहीं दे सकते क्योंकि यह जिरकोनियम और हेफ़नियम के लिए 15 pm तक अधिक है।[34] हम संघनित आयनीकरण ऊर्जा का भी आह्वान नहीं कर सकते क्योंकि यह एक जैसी है ([Ar] 3d2 4s2 टाइटेनियम के लिए जबकि [Kr] 4d2 5s2 जिरकोनियम के लिए)। इसके अतिरिक्त ये न तो आधे भरे हुए हैं और न ही पूरी तरह से भरे हुए ऑर्बिटल्स हैं जिनकी हम तुलना कर सकते हैं। इसलिए हम केवल जिरकोनियम के पूर्ण इलेक्ट्रॉन विन्यास का आह्वान कर सकते हैं जो कि 1s22s22p63s23p63d104s24p6chd25s2 है।[35] पूर्ण 3d-ब्लॉक सबलेवल की उपस्थिति 4d-ब्लॉक तत्वों (जो केवल दो इलेक्ट्रॉन हैं) की तुलना में उच्च परिरक्षण दक्षता के समान है।[lower-alpha 1]
- समूह 5: समूह 4 के समान, नाइओबियम और टैंटलम उनके इलेक्ट्रॉन विन्यास और बाद के तत्व को प्रभावित करने वाले लैंथेनाइड संकुचन के कारण[36] एक दूसरे के अनुरूप हैं। Ipso facto समूह में सबसे प्रमुख तत्व, वैनेडियम की तुलना में IE में उनकी महत्वपूर्ण वृद्धि को उनके इलेक्ट्रॉन विन्यास के अतिरिक्त उनके पूर्ण d-ब्लॉक इलेक्ट्रॉनों के कारण उत्तरदायी ठहराया जा सकता है। एक और जटिल धारणा नाइओबियम का आधा भरा 5s कक्षीय है; प्रतिकर्षण और विनिमय ऊर्जा के कारण (दूसरे शब्दों में इलेक्ट्रॉन को उच्च-ऊर्जा उप-स्तर में रखने के स्थान पर इसे पूर्णतयः भरने के लिए कम-ऊर्जा उप-स्तर में डालने की लागत) s- और d- (या) के मध्य ऊर्जा अंतर पर काबू पाने के कारण ) ब्लॉक इलेक्ट्रॉन, ईसी मैडेलुंग नियम का पालन नहीं करता है।
- समूह 6: अपने पूर्ववर्ती समूह 4 और 5 की तरह समूह 6 भी नीचे की ओर बढ़ते समय उच्च मूल्यों को रिकॉर्ड करता है। टंगस्टन पुनः उनके इलेक्ट्रॉन विन्यास के कारण मोलिब्डेनम के समान है।[37] इसी प्रकार इसे अपने इलेक्ट्रॉन विन्यास में पूर्ण 3डी-कक्षक के लिए भी उत्तरदायी ठहराया जाता है।अन्य कारण मोलिब्डेनम का आधा भरा हुआ 4d कक्षीय है जो इलेक्ट्रॉन युग्म ऊर्जा के कारण ऑफबाउ सिद्धांत का उल्लंघन करता है।
- समूह 7-12 6वीं तालिका के तत्व (रेनीयाम, आज़मियम, इरिडियम, प्लेटिनम, सोना और पारा (तत्व)): इन सभी तत्वों में उनके संबंधित समूहों में पूर्ववर्ती तत्वों की तुलना में अत्यधिक उच्च आयनीकरण ऊर्जा होती है। इसका सार 6s कक्षीय के सापेक्षिकीय स्थिरीकरण के अतिरिक्त पोस्ट लैंथेनाइड्स पर लैंथेनाइड संकुचन के प्रभाव के कारण है।
- समूह 13:
- गैलियम का IE एल्युमीनियम से अधिक है। यह पुनः d-ऑर्बिटल्स के कारण होता है एवं स्कैंडाइड संकुचन के अतिरिक्त शक्तिहीन परिरक्षण प्रदान करता है और इसलिए प्रभावी परमाणु शुल्क बढ़ जाते हैं।
- थैलियम का IE, 4f इलेक्ट्रॉनों के खराब परिरक्षण के कारण[5] लैंथेनाइड संकुचन के अतिरिक्त इसके IE को इसके पूर्ववर्ती ईण्डीयुम के विपरीत बढ़ाया जा सकता है।
- समूह 14: सीसे की असामान्य रूप से उच्च आयनीकरण ऊर्जा (
82Pb
: 7.42 eV) समूह 13 के थैलियम के समान है तथा पूर्ण 5d और 4f उपकोशों का परिणाम है। लैंथेनाइड संकुचन और 4f इलेक्ट्रॉनों द्वारा नाभिक की अक्षम स्क्रीनिंग के परिणामस्वरूप टिन (
50Sn
: 7.34 eV)।[38][5] की तुलना में सीसा के लिए थोड़ी अधिक आयनीकरण ऊर्जा होती है।
हाइड्रोजन परमाणु के लिए बोहर मॉडल
हाइड्रोजन परमाणु () की आयनीकरण ऊर्जा का बोहर मॉडल में मूल्यांकन किया जा सकता है[39] जो भविष्यवाणी करता है कि परमाणु ऊर्जा स्तर ऊर्जा है,
RH हाइड्रोजन परमाणु के लिए रिडबर्ग नियतांक है। जमीनी अवस्था में हाइड्रोजन के लिए और ताकि आयनीकरण से पहले परमाणु की ऊर्जा सरल हो।
आयनीकरण के पश्चात गतिहीन इलेक्ट्रॉन के लिए प्रोटॉन से असीम रूप से दूर ऊर्जा शून्य होती है ताकि आयनीकरण ऊर्जा
- हो, यह हाइड्रोजन परमाणु के प्रायोगिक मूल्य से सहमत है।
क्वांटम-मैकेनिकल स्पष्टीकरण
क्वांटम यांत्रिकी के अधिक पूर्ण सिद्धांत के अनुसार, एक इलेक्ट्रॉन का स्थान एक इलेक्ट्रॉन क्लाउड, यानी परमाणु कक्षीय के भीतर संभाव्यता वितरण के रूप में सबसे अच्छा वर्णित है।[40][41] इस बादल के ऊपर एकीकृत करके ऊर्जा की गणना की जा सकती है। क्लाउड का अंतर्निहित गणितीय प्रतिनिधित्व तरंग क्रिया है जो आणविक स्पिन ऑर्बिटल्स से युक्त स्लेटर निर्धारकों से बनाया गया है।[42] ये पाउली के बहिष्करण सिद्धांत द्वारा परमाणु या आणविक कक्षाओं के एंटीसिमेट्रिज्ड उत्पादों से संबंधित हैं।
आयनीकरण ऊर्जा की गणना करने के दो मुख्य प्रकार हैं। सामान्य रूप से Nवें आयनीकरण ऊर्जा की गणना के लिए की ऊर्जाओं और इलेक्ट्रॉन प्रणाली की गणना की आवश्यकता होती है। सरलतम प्रणालियों (अर्थात् हाइड्रोजन और हाइड्रोजन जैसे तत्व) को छोड़कर इन ऊर्जाओं की सटीक गणना मुख्य रूप से इलेक्ट्रॉन सहसंबंध शर्तों को एकीकृत करने में कठिनाइयों के कारण संभव नहीं है।[43] इसलिए अनुभवजन्य डेटा की तुलना में जटिलता (कम्प्यूटेशनल समय) और सटीकता में भिन्नता के साथ सन्निकटन विधियों को नियमित रूप से नियोजित किया जाता है। यह अच्छी तरह से अध्ययन की जाने वाली समस्या बन गई है और कम्प्यूटेशनल रसायन शास्त्र में नियमित रूप से अध्यन की जाती है। आयनीकरण ऊर्जाओं की गणना करने का दूसरा प्रकार मुख्य रूप से सन्निकटन के निम्नतम स्तर पर उपयोग किया जाता है जहां कोपमैन्स प्रमेय द्वारा आयनीकरण ऊर्जा प्रदान की जाती है जिसमें उच्चतम व्याप्त आणविक कक्षीय या HOMO और LUMO और निम्नतम अप्रकाशित आणविक कक्षीय या HOMO और LUMO सम्मिलित होते हैं। और यह बताता है कि किसी परमाणु या अणु की आयनीकरण ऊर्जा उस कक्षीय ऊर्जा के बराबर होती है जिससे इलेक्ट्रॉन को बाहर निकाला जाता है।[44] इसका अर्थ है कि आयनीकरण ऊर्जा HOMO ऊर्जा के बराबर है जिसे औपचारिक समीकरण में इस प्रकार लिखा जा सकता है: .[45]
अणु: ऊर्ध्वाधर और एडियाबेटिक आयनीकरण ऊर्जा

अणुओं के आयनीकरण से अधिकतर आणविक ज्यामिति में परिवर्तन होता है और इसमें दो प्रकार की (पहली) आयनीकरण ऊर्जा को परिभाषित किया जाता है - एडियाबेटिक और वर्टिकल।[46]
रुद्धोष्म आयनीकरण ऊर्जा
किसी अणु की रूद्धोष्म प्रमेय आयनीकरण ऊर्जा उदासीन अणु से एक इलेक्ट्रॉन को निकालने के लिए आवश्यक ऊर्जा की न्यूनतम मात्रा है अर्थात तटस्थ प्रजातियों (v = 0 स्तर) की आणविक कंपन जमीनी स्थिति की ऊर्जा के मध्य का अंतर (v = 0 स्तर) धनात्मक आयन (v' = 0)। प्रत्येक प्रजाति की विशिष्ट संतुलन ज्यामिति इस मान को प्रभावित नहीं करती है।
कार्यक्षेत्र आयनीकरण ऊर्जा
आणविक ज्यामिति में संभावित परिवर्तनों के कारण जो आयनीकरण से उत्पन्न हो सकते हैं वे तटस्थ प्रजातियों की कंपन जमीनी स्थिति और सकारात्मक आयन के आणविक कंपन उत्तीव्रित स्थितियों के मध्य अतिरिक्त संक्रमण उपस्थित हो सकते हैं। दूसरे शब्दों में आयनीकरण कंपन स्पेक्ट्रोस्कोपी के साथ होता है। इस तरह के संक्रमणों की तीव्रता को फ्रेंक-कॉन्डन सिद्धांत द्वारा समझाया गया है जो भविष्यवाणी करता है कि सबसे संभावित और तीव्र संक्रमण सकारात्मक आयन के कंपन से उत्तीव्रित अवस्था से मेल खाता है जिसमें तटस्थ अणु के समान ज्यामिति होती है। इस संक्रमण को ऊर्ध्वाधर आयनीकरण ऊर्जा के रूप में संदर्भित किया जाता है क्योंकि यह संभावित ऊर्जा आरेख (चित्र देखें) पर पूरी तरह से लंबवत रेखा द्वारा दर्शाया जाता है।
द्विपरमाणुक अणु के लिए ज्यामिति को एकल बंधन लंबाई की लंबाई से परिभाषित किया जाता है। एक बंधन आणविक कक्षीय से एक इलेक्ट्रॉन को हटाने से बंधन शक्तिहीन हो जाता है और बंधन की लंबाई बढ़ जाती है। चित्र 1 में निम्न संभावित ऊर्जा सतह तटस्थ अणु के लिए है और ऊपरी सतह सकारात्मक आयन के लिए है। दोनों वक्र संभावित ऊर्जा को बांड की लंबाई के फंक्शन के रूप में प्लॉट करते हैं। क्षैतिज रेखाएँ उनके संबंधित क्वांटम हार्मोनिक ऑसिलेटर के साथ आणविक कंपन के अनुरूप हैं। चूँकि आयन का बंधन शक्तिहीन होता है इसलिए उसकी बंधन लंबाई अधिक होगी। इस प्रभाव को न्यूनतम संभावित ऊर्जा वक्र को तटस्थ प्रजातियों के दाईं ओर स्थानांतरित करके दर्शाया गया है। एडियाबेटिक आयनीकरण आयन की कंपन जमीनी स्थिति के लिए विकर्ण संक्रमण है। ऊर्ध्वाधर आयनीकरण में आयनिक अवस्था का कंपन उत्तीव्रना सम्मिलित हो सकती है और इसलिए अधिक ऊर्जा की आवश्यकता होती है।
कई परिस्थितियों में रूद्धोष्म आयनीकरण ऊर्जा अधिकतर एक अधिक दिलचस्प भौतिक मात्रा होती है क्योंकि यह दो संभावित ऊर्जा सतहों के मध्य ऊर्जा में अंतर का वर्णन करती है। जबकि प्रयोगात्मक सीमाओं के कारण रुद्धोष्म आयनीकरण ऊर्जा को निर्धारित करना अधिकतर कठिन होता है जबकि ऊर्ध्वाधर टुकड़ी ऊर्जा सरलता से पहचानने योग्य और औसत श्रेणी की होती है।
अन्य प्रणालियों के लिए आयनीकरण ऊर्जा के अनुरूप
जबकि आयनीकरण ऊर्जा अवधि का उपयोग बड़े पैमाने पर केवल गैस-चरण परमाणु, धनायनित, या आणविक प्रजातियों के लिए किया जाता है, वहां कई समान मात्राएं हैं जो अन्य भौतिक प्रणालियों से एक इलेक्ट्रॉन को निकालने के लिए आवश्यक ऊर्जा की मात्रा पर विचार करती हैं।
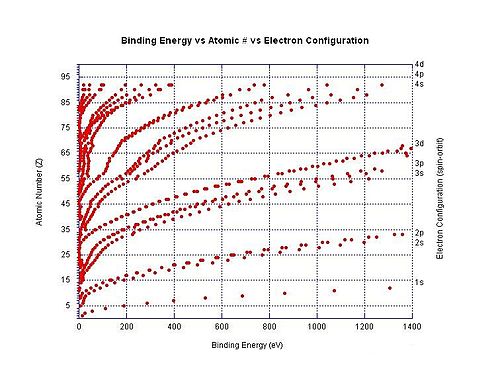
इलेक्ट्रॉन बंधन ऊर्जा
इलेक्ट्रॉन बाध्यकारी ऊर्जा एक परमाणु या आयन के लिए विशेष इलेक्ट्रॉन खोल से एक इलेक्ट्रॉन को निकालने के लिए आवश्यक न्यूनतम ऊर्जा के लिए सामान्य शब्द है क्योंकि ये नकारात्मक रूप से चार्ज किए गए इलेक्ट्रॉनों को सकारात्मक रूप से आवेशित नाभिक के इलेक्ट्रोस्टैटिक पुल द्वारा जगह में रखा जाता है।[47] उदाहरण के लिए 3p3/2 को हटाने के लिए इलेक्ट्रॉन बंधन ऊर्जा क्लोराइड आयन से इलेक्ट्रॉन क्लोरीन परमाणु से एक इलेक्ट्रॉन को निकालने के लिए आवश्यक ऊर्जा की न्यूनतम मात्रा है जब इसमें -1 का आवेश होता है। इस विशेष उदाहरण में इलेक्ट्रॉन बंधन ऊर्जा का वही परिमाण है जो तटस्थ क्लोरीन परमाणु के लिए इलेक्ट्रॉन बंधुता का है। एक अन्य उदाहरण में इलेक्ट्रॉन बंधन ऊर्जा डाइकार्बोक्सिलेट डायनियन −O2C (CH2)8CO−
2 से एक इलेक्ट्रॉन को निकालने के लिए आवश्यक ऊर्जा की न्यूनतम मात्रा को संदर्भित करती है।
दाईं ओर का ग्राफ तटस्थ परमाणुओं में विभिन्न कोशों में इलेक्ट्रॉनों के लिए बाध्यकारी ऊर्जा को दर्शाता है। किसी विशेष परमाणु के लिए आयनीकरण ऊर्जा सबसे कम बाध्यकारी ऊर्जा है (जबकि ये सभी ग्राफ में नहीं दिखाए गए हैं)।
ठोस सतहें: कार्य फंक्शन
कार्य फलन एक ठोस सतह से एक इलेक्ट्रॉन को निकालने के लिए आवश्यक ऊर्जा की न्यूनतम मात्रा है जहाँ W कार्य कार्य करता है किसी दिए गए सतह के लिए अंतर द्वारा परिभाषित किया गया है[48]
जहाँ −e एक इलेक्ट्रॉन का प्रभार है एवं ϕ सतह के पास के वैक्यूम में इलेक्ट्रोस्टैटिक क्षमता है और EF सामग्री के अंदर फर्मी स्तर (इलेक्ट्रॉनों की विद्युत रासायनिक क्षमता) है।
नोट
- ↑ Nonetheless, further research is still needed to corroborate this mere inference.
यह भी देखें
- रिडबर्ग समीकरण एक गणना जो हाइड्रोजन और हाइड्रोजन जैसे परमाणु|हाइड्रोजन जैसे तत्वों की आयनीकरण ऊर्जा निर्धारित कर सकती है। इसके माध्यम से इसे और विस्तृत किया गया है साइट।
- इलेक्ट्रॉन आत्मीयता तटस्थ परमाणु या अणु में एक इलेक्ट्रॉन जोड़कर जारी ऊर्जा का वर्णन करने वाली एक निकट से संबंधित अवधारणा।
- जाली ऊर्जा, यौगिक बनाने के लिए आयनों के संयुक्त होने पर निकलने वाली ऊर्जा का एक उपाय।
- इलेक्ट्रोनगेटिविटी एक संख्या है जो आयनीकरण ऊर्जा के साथ कुछ समानताएं साझा करती है।
- कोपमैन्स प्रमेय, हार्ट्री-फॉक सिद्धांत में अनुमानित आयनीकरण ऊर्जा के विषय में।
- डिटुंगस्टन टेट्रा (एचपीपी) में स्थिर रासायनिक यौगिक के लिए सबसे कम दर्ज की गई आयनीकरण ऊर्जा है।
- बंधन-पृथक्करण ऊर्जा, एक रासायनिक बंधन की शक्ति की माप होमोलिसिस द्वारा क्लीविंग के माध्यम से गणना की जाती है जिससे दो कट्टरपंथी टुकड़े A और B और एन्थैल्पी परिवर्तन के बाद के मूल्यांकन
- बांड ऊर्जा रासायनिक बंधन की शक्ति की औसत माप सभी रासायनिक बंधनों को अलग-अलग परमाणुओं में तोड़ने के लिए आवश्यक ऊष्मा की मात्रा के माध्यम से गणना की जाती है।
संदर्भ
- ↑ "Periodic Trends". Chemistry LibreTexts (in English). 2013-10-02. Retrieved 2020-09-13.
- ↑ 2.0 2.1 2.2 Miessler, Gary L.; Tarr, Donald A. (1999). Inorganic Chemistry (2nd ed.). Prentice Hall. p. 41. ISBN 0-13-841891-8.
- ↑ "Ionization Energy". ChemWiki. University of California, Davis. 2013-10-02.
- ↑ "Chapter 9: Quantum Mechanics". faculty.chem.queesu.ca (in English). January 15, 2018. Archived from the original on July 24, 2020. Retrieved October 31, 2020.
- ↑ 5.0 5.1 5.2 5.3 Lang, Peter F.; Smith, Barry C. (August 2003). "Ionization Energies of Atoms and Atomic Ions". Journal of Chemical Education. 80 (8): 938. Bibcode:2003JChEd..80..938L. doi:10.1021/ed080p938.
- ↑ Cotton, F. Albert; Wilkinson, Geoffrey (1988). Advanced Inorganic Chemistry (5th ed.). John Wiley. p. 1381. ISBN 0-471-84997-9.
- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "ionization potential". doi:10.1351/goldbook.I03208
- ↑ Mahan, Bruce H. (1962). "Ionization Energy". College of Chemistry, University of California Berkeley. Retrieved 2020-09-13.
- ↑ "Monatomic Gas - an overview | ScienceDirect Topics". www.sciencedirect.com. Retrieved 2022-01-08.
- ↑ 10.0 10.1 Stone, E.G. (December 19, 2020v). "Atomic Structure : Periodic Trends". Department of Chemistry. chem.tamu.edu (in English). 400 Bizzell St, College Station, TX 77843, Texas, United States: Texas A&M University. Archived from the original on October 11, 2018. Retrieved December 19, 2020.
{{cite web}}: CS1 maint: location (link) - ↑ "Anomalous trends in ionization energy". Chemistry Stack Exchange. Retrieved 2020-09-20.
- ↑ Petrucci, Ralph H.; Harwood, William S.; Herring, F. Geoffrey (2002). General Chemistry (8th ed.). Prentice Hall. p. 370. ISBN 0-13-014329-4.
- ↑ 13.0 13.1 Grandinetti, Philip J. (September 8, 2019). "Ionization Energy Trends | Grandinetti Group". www.grandinetti.org. Retrieved 2020-09-13.
- ↑ Kent, Mr. "First Ionization Energy". kentchemistry.com. KentChemistry. Retrieved December 6, 2020.
...The addition of the second electron into an already occupied orbital introduces repulsion between the electrons, thus it is easier to remove. that is why there is a dip in the ionization energy.
- ↑ "Group IA". chemed.chem.purdue.edu. Retrieved 2020-09-20.
- ↑ "Alkali Metals". hyperphysics.phy-astr.gsu.edu. Retrieved 2020-09-13.
- ↑ "The Alkali Metals | Introduction to Chemistry". courses.lumenlearning.com. Retrieved 2020-09-13.
- ↑ "Chemical elements listed by ionization energy". lenntech.com. Lenntech BV. 2018. Retrieved December 6, 2020.
The elements of the periodic table sorted by ionization energy click on any element's name for further information on chemical properties, environmental data or health effects. This list contains the 118 elements of chemistry.
- ↑ Boudreaux, K.A. (August 13, 2020) [July 26, 2006]. "The Parts of the Periodic Table". Department of Chemistry and Biochemistry. angelo.edu/faculty/kboudrea/ (in English). 2601 W. Avenue N, San Angelo, TX 76909, Texas: Angelo State University. Retrieved December 19, 2020 – via angelo.edu.
{{cite web}}: CS1 maint: location (link) - ↑ "18.10: The Group 6A Elements". Chemistry LibreTexts (in English). 2014-07-02. Retrieved 2020-09-20.
- ↑ "Covalent Radius for all the elements in the Periodic Table". periodictable.com. Retrieved 2020-09-13.
- ↑ Jensen, W. B. (2015). "Some Comments on the Position of Lawrencium in the Periodic Table" (PDF). Archived from the original (PDF) on 23 December 2015. Retrieved 20 September 2015.
- ↑ Singh, Jasvinder (1999). "Inert Gases". Sterling Dictionary of Physics. Sterling Publishers Pvt. Ltd. p. 122. ISBN 978-81-7359-124-2.
- ↑ "Vanadium, Niobium and Tantalum". Chemistry of the Elements. 1997. pp. 976–1001. doi:10.1016/B978-0-7506-3365-9.50028-6. ISBN 978-0-7506-3365-9.
- ↑ Housecroft, C.E.; Sharpe, A.G. (November 1, 1993). Inorganic Chemistry (eBook). Inorganic Chemistry (in English). Vol. 3 (15th ed.). Switzerland: Pearson Prentice-Hall. pp. 536, 649, 743. doi:10.1021/ed070pA304.1. ISBN 978-0-273-74275-3. Archived from the original on April 14, 2021. Retrieved December 14, 2020.
{{cite book}}: CS1 maint: bot: original URL status unknown (link) - ↑ 26.0 26.1 Cotton, F. Albert; Wilkinson, Geoffrey (1988), Advanced Inorganic Chemistry (5th ed.), New York: Wiley-Interscience, pp. 776, 955, ISBN 0-471-84997-9
- ↑ Billo, E. J. (1985). "Modern Inorganic Chemistry (Jolly, William L.)". Journal of Chemical Education. 62 (4): A137. Bibcode:1985JChEd..62..137B. doi:10.1021/ed062pA137.1.
- ↑ "Patterns and trends in the periodic table - Periodicity - Higher Chemistry Revision". BBC Bitesize (in British English). Retrieved 2020-09-20.
- ↑ "Ionization Energies". Chemistry LibreTexts (in English). 2013-10-03. Retrieved 2020-09-20.
- ↑ "IYPT 2019 Elements 087: Francium: Not the most reactive Group 1 element". Compound Interest (in British English). 2019-11-06. Retrieved 2020-09-20.
- ↑ "Hafnium". gordonengland.co.uk. Gordon England. 2020. Retrieved December 7, 2020.
...Atomic Radius 159 pm...
- ↑ "Zirconium (Element) - Atomic Radius". pubchem.ncbi.nlm.nih.gov. PubChem. Retrieved December 8, 2020.
155 pm (Empirical)
- ↑ Slater, J. C. (15 November 1964). "Atomic Radii in Crystals". The Journal of Chemical Physics. 41 (10): 3199–3204. Bibcode:1964JChPh..41.3199S. doi:10.1063/1.1725697.
- ↑ "WebElements Periodic Table » Titanium » radii of atoms and ions". www.webelements.com. Retrieved 2020-09-20.
- ↑ Straka, J. "Periodic Table of the Elements: Zirconium - Electronic configuration". www.tabulka.cz. Retrieved 2020-09-20.
- ↑ "Tantalum | chemical element". Encyclopedia Britannica (in English). Retrieved 2020-09-20.
- ↑ Langård, Sverre (2015). "Chromium, Molybdenum, and Tungsten". Patty's Toxicology. doi:10.1002/0471435139.tox038. ISBN 978-0-471-12547-1.
- ↑ "The Group 14 elements". Chemistry Nexus (in English). 2015-12-02. Retrieved 2020-09-13.
- ↑ Bohr, N. (July 1913). "I. On the constitution of atoms and molecules". The London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science. 26 (151): 1–25. doi:10.1080/14786441308634955.
- ↑ "Orbitals, Electron Clouds, Probabilities, and Energies". chem.libretexts.org. UC Davis ChemWiki. May 23, 2019. Retrieved November 2, 2020.
- ↑ "Quantum numbers and orbitals- The quantum mechanical model of the atom". Khan Academy. Retrieved November 2, 2020.
- ↑ Levine 1991, p. 315: "In the Hartree-Fock approximation, the wave function of an atom (or molecule) is a Slater determinant or a linear combination of a few Slater determinants"
- ↑ Levine 1991, pp. 290–291.
- ↑ Levine 1991, p. 475.
- ↑ "Background Reading for Ionization Energy". shodor.org. The Shodor Education Foundation, Inc. 2000. Retrieved November 15, 2020.
... The second method is called Koopman's Theory. This method involves the HOMO.
- ↑ "The difference between a vertical ionization energy and adiabatic ionization energy". Computational Chemistry Comparison and Benchmark Database. National Institute of Standards and Technology.
- ↑ Murphy, Andrew; Wong, Monica (2019). "Electron binding energy". radiopaedia.org. Radiopaedia. Retrieved December 7, 2020.
The electron binding energy is the minimum energy that is required to remove an electron from an atom
- ↑ Kittel, Charles (January 1, 1996) [1953]. "6". In Zainab, R.; Du, D.; Tanner, B.K.; Chambers, R.G. (eds.). Introduction to Solid State Physics. pp. 18–19. Bibcode:1969Natur.224..983C. doi:10.1063/1.3061720. ISBN 978-0-471-11181-8. LCCN 95-018445. OCLC 263625446. S2CID 121571376. Archived from the original on September 28, 2021. Retrieved December 18, 2020.
{{cite book}}:|journal=ignored (help)CS1 maint: bot: original URL status unknown (link)[page needed]
स्रोत
- Levine, Ira N. (1991). क्वांटम रसायन. Prentice Hall. ISBN 978-0-205-12770-2.